Przeczytaj
Związki organiczne to ogromna rodzina związków o różnorodnych właściwościach fizycznych i chemicznych. Pomimo dużej różnorodności, możliwe jest jednak wskazanie pewnych ogólnych trendów zmian.
Różnorodność właściwości związków organicznych wynika z wielu aspektów. Do najbardziej istotnych można zaliczyć m.in.:
długość i kształt łańcucha węglowegołańcucha węglowego;
obecność różnych grup funkcyjnychgrup funkcyjnych;
obecność podstawnikówpodstawników.
Dlatego związki organiczne zostały podzielone na grupy wykazujące podobne cechy budowy, a przez to właściwości. Należy pamiętać, że większość właściwości danego związku stanowi sumę właściwości składowych poszczególnych elementów budulcowych.
Wpływ budowy związków organicznych na ich właściwości fizyczne
Elementy budowy cząsteczek, takie jak: grupa funkcyjna, kształt i długość łańcucha węglowego oraz liczba i rodzaj podstawników, mają bardzo duży wpływ na właściwości fizyczne związków organicznych. Do tych właściwości należą m.in. polarność cząsteczek danego związku, wpływająca na ich zdolność do mieszania się z innymi substancjami, a także temperatury wrzenia i topnienia oraz gęstość.
Polarność
Polarność cząsteczek jest ściśle związana z rozkładem ładunków cząstkowych, gromadzących się wokół atomów połączonych za pomocą wiązania kowalencyjnego spolaryzowanego. Wiązanie to tworzy się na skutek utworzenia wspólnej pary elektronowej, przy czym para ta przesunięta jest w stronę bardziej elektroujemnego atomu. W związku z tym, wokół atomów gromadzą się cząstkowe ładunki. Wokół atomu bardziej elektroujemnego (zawierającego najczęściej wolne pary elektronowe) – ładunek ujemny, wokół atomu mniej elektroujemnego – ładunek dodatni.
Jeżeli rozłożenie ładunków jest nierównomierne, to powstaje niezerowy moment dipolowy (). O takiej cząsteczce mówimy, że jest polarna i nazywamy ją często dipolem. Natomiast jeśli w cząsteczce mamy do czynienia z równomiernym rozkładem ładunków, to mówimy, że dana cząsteczka jest niepolarna i wykazuje zerowy moment dipolowy ().
Równomierny rozkład ładunków może być spowodowany zarówno występowaniem wiązań kowalencyjnych niespolaryzowanych, jak i symetrią cząsteczki – wtedy wpływy poszczególnych ładunków cząstkowych w skali cząsteczki zostają wzajemnie zredukowane.
Wśród związków organicznych wyróżniamy zarówno cząsteczki polarne, jak i niepolarne. Zgodnie z zasadą „podobne rozpuszcza się w podobnym” cząsteczki polarne będą rozpuszczały się w rozpuszczalnikach polarnych, takich jak woda czy metanol. Natomiast cząsteczki niepolarne będą chętniej rozpuszczały się w rozpuszczalnikach niepolarnych, takich jak np.: benzen, toluen, aceton czy heksan.
Które związki organiczne są zatem polarne, a które niepolarne?
Węglowodory to grupa niepolarnych związków organicznych. Pomiędzy atomami występują wiązania kowalencyjne niespolaryzowane (różnica elektroujemności między atomem węgla i wodoru jest niewielka).
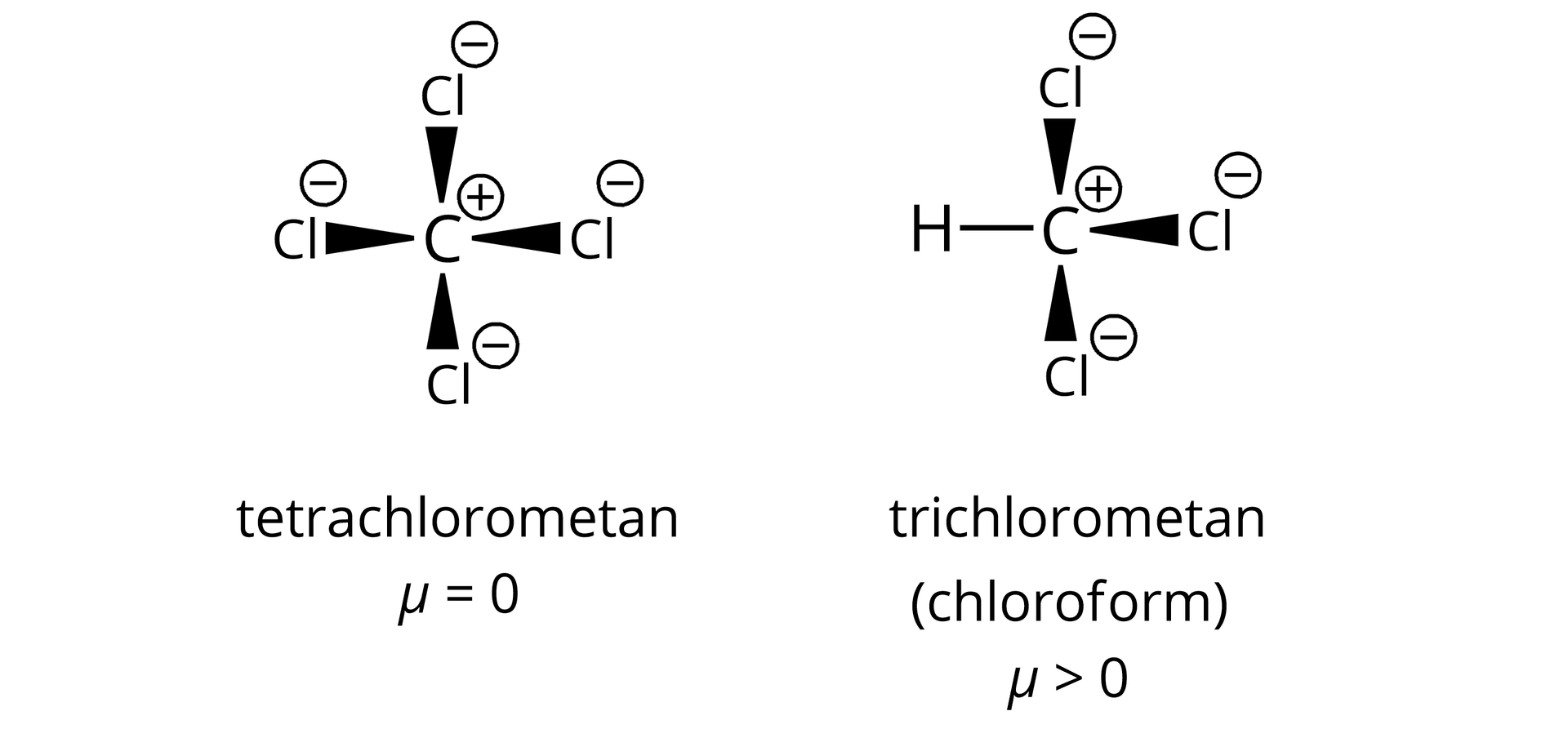
Jeśli wprowadzony zostanie podstawnik wykazujący wysoką elektroujemność, np. atom fluoru, chloru czy bromu, to pomiędzy tymi atomami a atomami węgla dojdzie do utworzenia wiązań kowalencyjnych spolaryzowanych. Możemy mieć wówczas do czynienia z równomiernym lub nierównomiernym rozkładem ładunków cząstkowych, tak jak np. w przypadku tetrachlorometanu i chloroformu (trichlorometanu).
W przypadku jedno-jedno- i wielofunkcyjnych pochodnych węglowodorówwielofunkcyjnych pochodnych węglowodorów, mamy do czynienia z grupami funkcyjnymi, w których pomiędzy atomami występują wiązania kowalencyjne spolaryzowane.
Grupa hydroksylowa | Grupa karboksylowa | Grupa estrowa | Grupa karbonylowa | Grupa aminowa | Grupa amidowa |
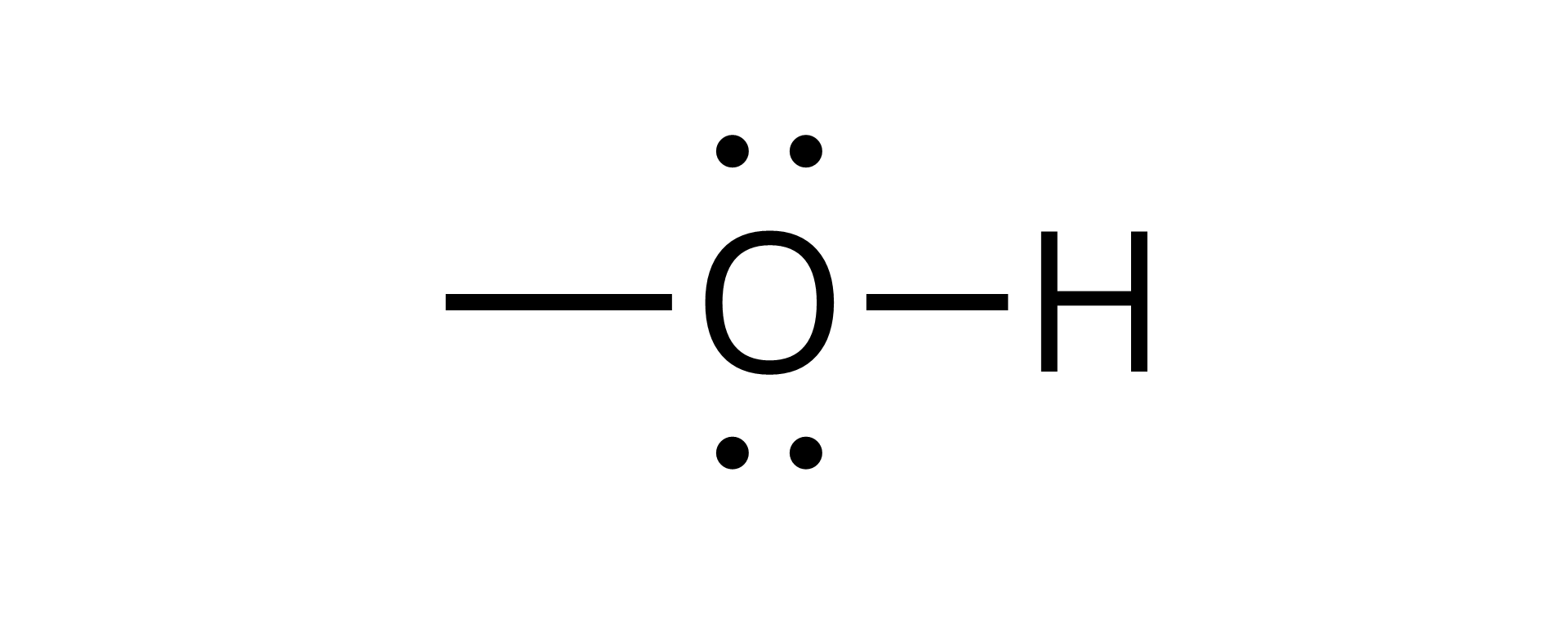 |  | 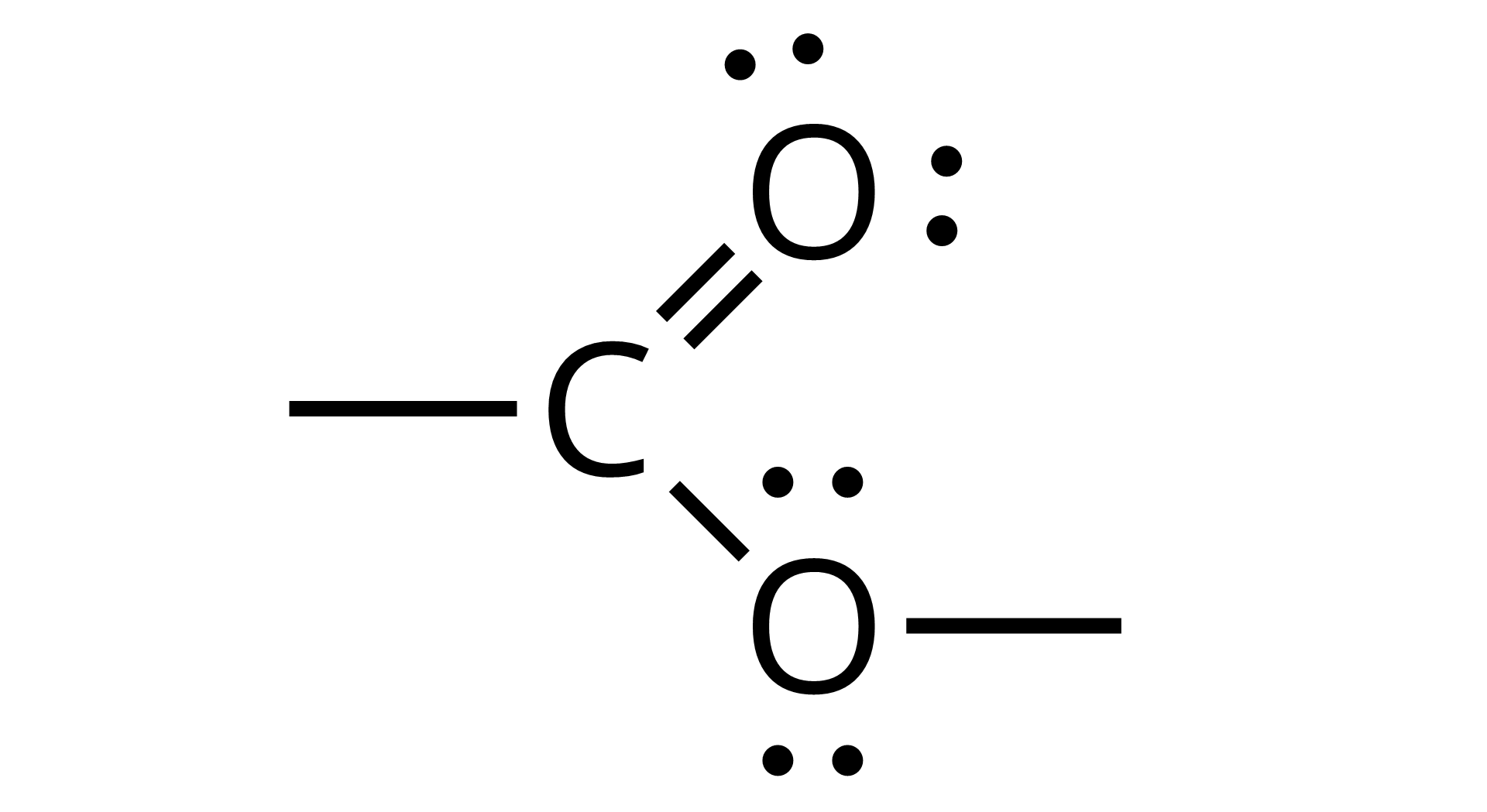 | 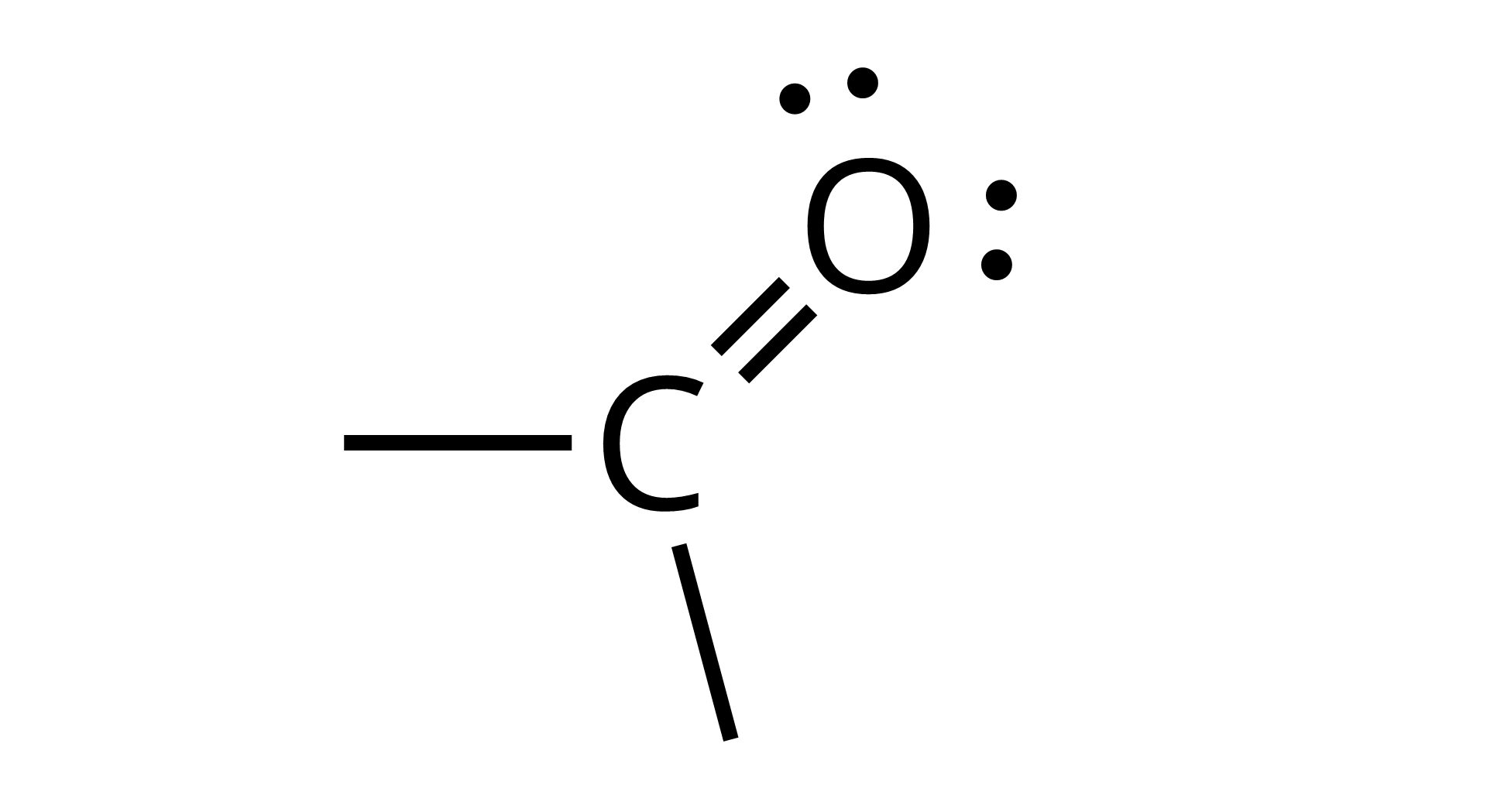 |  |  |
Indeks górny Źródło: GroMar Sp. z o.o., licencja CC BY‑SA 3.0 Indeks górny koniecŹródło: GroMar Sp. z o.o., licencja CC BY‑SA 3.0
Grupy te istotnie wpływają na wzrost polarności cząsteczek. Jednak wraz ze wzrostem niepolarnego łańcucha węglowego, polarność cząsteczek maleje. Dzieje się tak, ponieważ udział polarnej grupy funkcyjnej, w stosunku do długiego niepolarnego łańcucha węglowego, jest znikomy. Dlatego np. alkohole o krótkich łańcuchach węglowych, takie jak np. metanol i etanol, dobrze rozpuszczają się w wodzie. Co więcej, same stanowią rozpuszczalniki polarne dla innych cząsteczek.
Analogicznie, kwasy karboksylowe, aldehydy czy aminy o krótkich łańcuchach węglowych będą stanowiły związki polarne, dobrze rozpuszczalne w rozpuszczalnikach polarnych. Natomiast wraz ze wzrostem długości łańcucha węglowego będziemy obserwować tendencję spadku ich polarności.
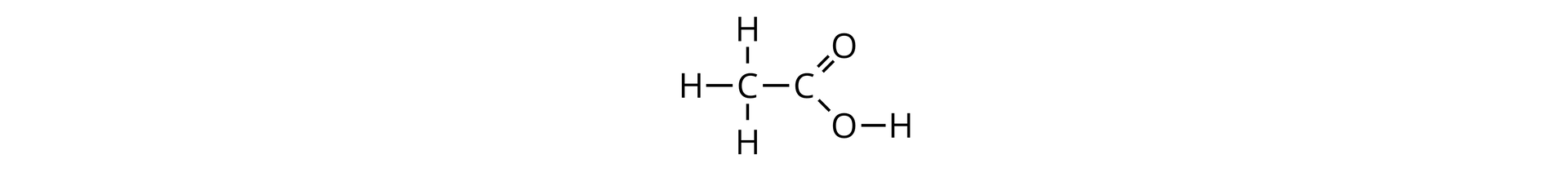
Kwas octowy, ze względu na krótki łańcuch węglowy i duży udział grupy karboksylowej w całej cząsteczce, jest rozpuszczalny w wodzie.

Kwas palmitynowy, ze względu na długi łańcuch węglowy i znikomy udział grupy karboksylowej w całej cząsteczce, jest nierozpuszczalny w wodzie.
Temperatury wrzenia i topnienia
Wraz ze wzrostem liczby atomów węgla w łańcuchach węglowych związków organicznych obserwuje się tendencję wzrostową dla temperatur wrzenia oraz na ogół dla temperatur topnienia.
Najpierw przyjrzymy się danym w tabelach dla wybranych związków organicznych.
Metanol | Etanol | Propan‑‑ol | Butan‑‑ol | |
Temperatura wrzenia [°C] | ||||
Temperatura topnienia [°C] |
Metanal | Etanal | Propanal | Butanal | |
Temperatura wrzenia [°C] | ||||
Temperatura topnienia [°C] |
Kwas metanowy | Kwas etanowy | Kwas propanowy | Kwas butanowy | |
Temperatura wrzenia [°C] | ||||
Temperatura topnienia [°C] |
Wzrost temperatur wrzenia i topnienia dla cząsteczek organicznych o coraz dłuższych łańcuchach węglowych wynika z coraz większych mas cząsteczkowych. Aby zatem zmienić stan skupienia związków organicznych o długich łańcuchach węglowych, należy dostarczyć więcej energii niż w przypadku cząsteczek o krótkich łańcuchach węglowych, a w związku z tym małych masach cząsteczkowych.
Spójrzmy jednak na inny aspekt. Dlaczego cząsteczki organiczne o zbliżonych masach cząsteczkowych różnią się temperaturami wrzenia i topnienia?
Propan | Etanol | Etanal | Kwas mrówkowy (metanowy) | |
Wzór półstrukturalny |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 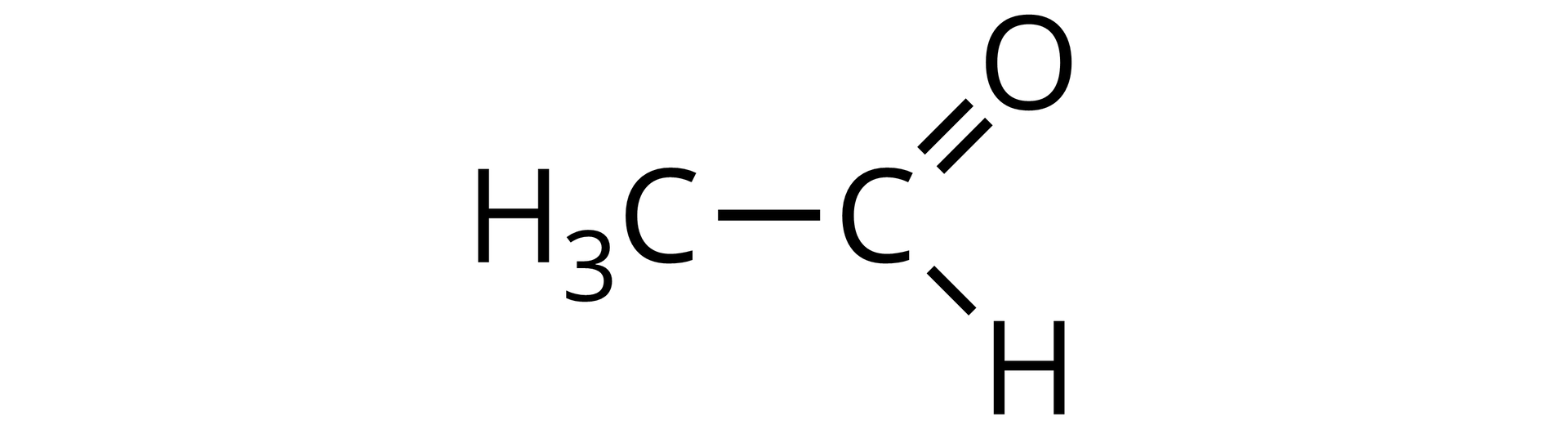 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Masa cząsteczkowa [u] | 44 | 46 | 44 | 46 |
Temperatura wrzenia [°C] | -42 | 78 | 20 | 101 |
Temperatura topnienia [°C] | -188 | -114 | -123 | 8 |
W przypadku etanolu i kwasu mrówkowego, mamy do czynienia ze znacznie wyższymi temperaturami wrzenia niż dla propanu i etanalu. Wynika to z możliwości tworzenia przez alkohole i kwasy karboksylowe wielu oddziaływań międzycząsteczkowych, przede wszystkim wiązań wodorowych.
Możliwość tworzenia wiązań wodorowych wynika z występowania w cząsteczce atomu wodoru, związanego z silnie elektroujemnym atomem, w tym przypadku atomem tlenu. Węglowodory oraz związki karbonylowe, czyli aldehydy i ketony, nie mają możliwości tworzenia wiązań wodorowych pomiędzy swoimi cząsteczkami, co wynika z braku odpowiedniego atomu wodoru. Ma to istotny wpływ na temperatury wrzenia i topnienia, ponieważ aby zmienić stan skupienia tych związków, należy dostarczyć więcej energii, w celu zerwania wiązań wodorowych.

Im więcej podstawników, zawierających atomy wodoru związane z silnie elektroujemnym atomem (np., lub ), tym więcej możliwości tworzenia wiązań wodorowych przez związki organiczne, tym zatem wyższe temperatury wrzenia i topnienia.
Należy również wspomnieć o wpływie rozgałęzienia łańcucha węglowego na temperatury wrzenia i topnienia. Zauważyć możemy tendencję, że im bardziej rozgałęzione cząsteczki, tym mają one niższe temperatury topnienia i wrzenia. Dlaczego tak się dzieje?
Cząsteczki, które są bardziej rozgałęzione nie mają możliwości tworzenia tak wielu oddziaływań międzycząsteczkowych, jak odpowiadające im izomery nierozgałęzione. Słabsze oddziaływania międzycząsteczkowe oraz mniejsza ich ilość powoduje, że należy dostarczyć mniej energii, aby oddziaływania zostały zerwane, a związki uległy stopieniu lub odparowaniu.
Gęstość
Wraz ze wzrostem długości łańcucha węglowego zwiększa się również gęstość związków organicznych. Gęstość zależy od masy substancji. Zatem im więcej atomów węgla w cząsteczce, tym większa masa cząsteczkowa, a w związku z tym większa gęstość. Pamiętajmy również, że coraz większe cząsteczki tworzą coraz więcej oddziaływań międzycząsteczkowych, powodując ścisłe dopasowanie się przestrzenne cząsteczek do siebie.
Zwróćmy również uwagę na to, że nie tylko długość łańcucha węglowego wpływa na gęstość związków organicznych, a również liczba oraz rodzaj wprowadzonych podstawników. Przyjrzymy się poniższemu schematowi doświadczenia chemicznego.
Do dwóch probówek z wodą dodano:
do pierwszej kilka heksanu;
do drugiej kilka

Możemy zaobserwować, że heksan pływa po powierzchni wody, natomiast chloroform opada na dno probówki. Zauważmy, że heksan zawiera więcej atomów węgla niż chloroform, ale to gęstość chloroformu jest większa. Dlaczego? Wynika to z różnicy mas cząsteczkowych obu związków. Chloroform zbudowany jest z atomu węgla połączonego z atomem wodoru oraz trzema atomami chloru, co powoduje, że ma większą masę cząsteczkową niż heksan.
Wprowadzenie atomów fluorowców lub grup wodorotlenowych () do cząsteczek organicznych powoduje wzrost mas cząsteczkowych, a co za tym idzie – wzrost gęstości, jak pokazano w poniższej tabeli.
Propan‑1‑ol | Propano‑1,2‑diol (glikol propylenowy) | Propano‑1,2,3‑triol (glicerol) | |
Wzór półstrukturalny | 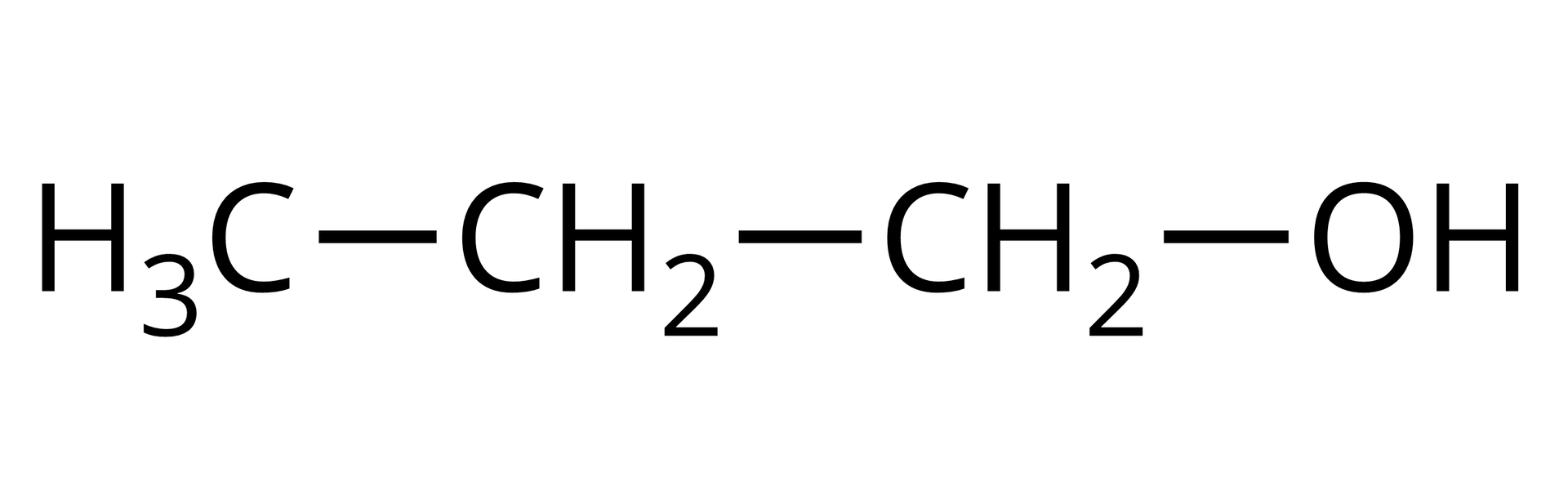 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 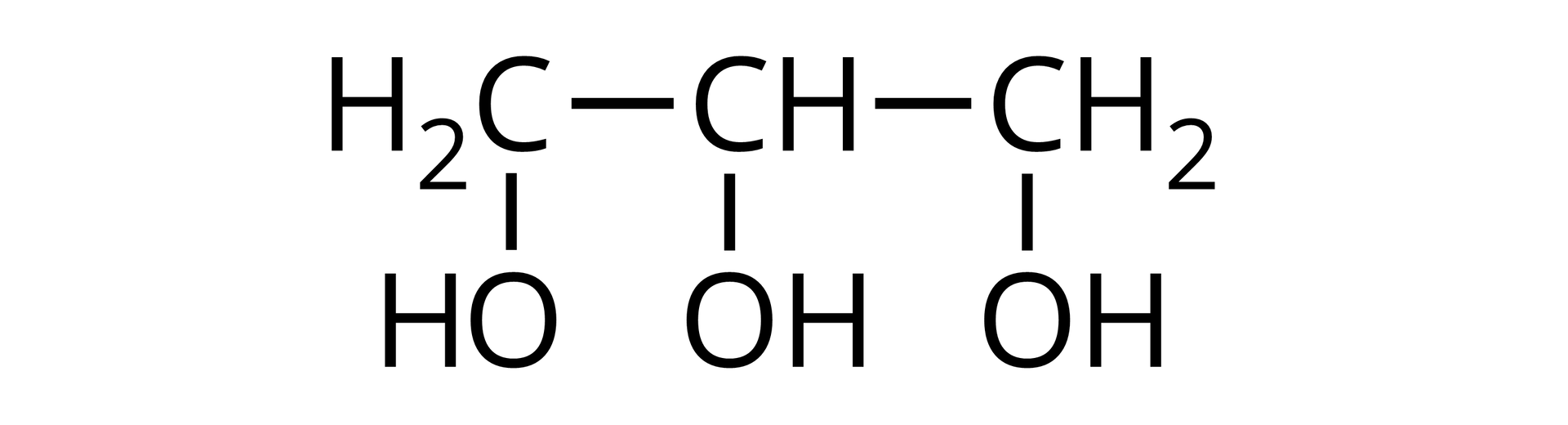 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Gęstość | 0,80 | 1,04 | 1,26 |
Wpływ budowy związków organicznych na ich właściwości chemiczne
Reakcje spalania
Wspólną cechą wszystkich związków organicznych jest możliwość ulegania reakcjom spalania. Spalanie to egzotermiczna reakcja chemiczna, która przebiega z wydzieleniem ciepła oraz światła. Podstawą tego procesu jest gwałtowna reakcja utleniania, polegająca na łączeniu się substancji spalanej (paliwa) z utleniaczem (tlenem). Spalanie związków organicznych prowadzi najczęściej do powstania tlenku węgla(), tlenku węgla() lub węgla, w zależności od dostępnej ilości tlenu w powietrzu.
W przypadku spalania związków organicznych, zbudowanych z atomów węgla, wodoru i tlenu, mamy do czynienia głównie z dwoma typami spalania: całkowitym, prowadzącym do powstania tlenku węgla(), oraz niecałkowitym, realizowanym dwiema drogami, prowadzącymi do otrzymania węgla w postaci sadzy lub tlenku węgla().
Do powstania tlenku węgla() dochodzi najczęściej wtedy, gdy spalanie zachodzi w czystym tlenie. Natomiast jeżeli spalamy dany związek chemiczny w powietrzu, gdzie procentowa zawartość objętościowa tlenu wynosi około 20%, wówczas mamy do czynienia ze spalaniem niecałkowitym. Dobrym przykładem jest tutaj spalanie etynu (acetylenu).
Przy spalaniu całkowitym występuje nadmiar tlenu w stosunku do substancji spalanej (w przypadku etynu stosunek molowy wynosi ).
Natomiast przy spalaniu niecałkowitym tlen występuje w niedomiarze w stosunku do substancji spalanej (w przypadku acetylenu stosunek molowy wynosi lub ).
Należy przy tym pamiętać, że związki organiczne składają się nie tylko z atomów węgla, wodoru i tlenu, ale również np. atomów azotu, chloru, siarki oraz wielu innych pierwiastków. W takich przypadkach, oprócz produktów utleniania atomów węgla, powstają produkty utleniania innych atomów.
Na przykład w wyniku spalania 2‑etylo‑4-nitrobenzenu, oprócz klasycznych produktów spalania, powstaje tlenek azotu().
Siarkowy analog metanolu, czyli metanotiol, to związek o wzorze . Ulega on spalaniu, prowadząc do otrzymania tlenku węgla(), tlenku siarki() oraz wody.
Natomiast spalanie chloropochodnych alkanów prowadzi do otrzymania chlorowodoru, oprócz tlenku węgla() i wody.
Właściwości kwasowo‑zasadowe
Związki organiczne wykazują w roztworach wodnych odczyn obojętny, kwasowy lub zasadowy. Zarówno właściwości chemiczne, jak i odczyn wodnego roztworu związków organicznych wynikają z obecności grup funkcyjnych, zdolnych do dysocjacji elektrolitycznej, a także z długości łańcucha węglowego.
Grupy funkcyjne, w których pomiędzy atomami występują wiązania kowalencyjne spolaryzowane, a ładunki cząstkowe są nierównomiernie rozłożone, ulegają dysocjacji elektrolitycznej lub hydrolizie w roztworze wodnym. Wówczas tworzą się jony odpowiedzialne za odczyn kwasowy (jony hydroniowe ) lub odczyn zasadowy (jony wodorotlenkowe ). Do związków organicznych, ulegających tym procesom, zaliczyć można:
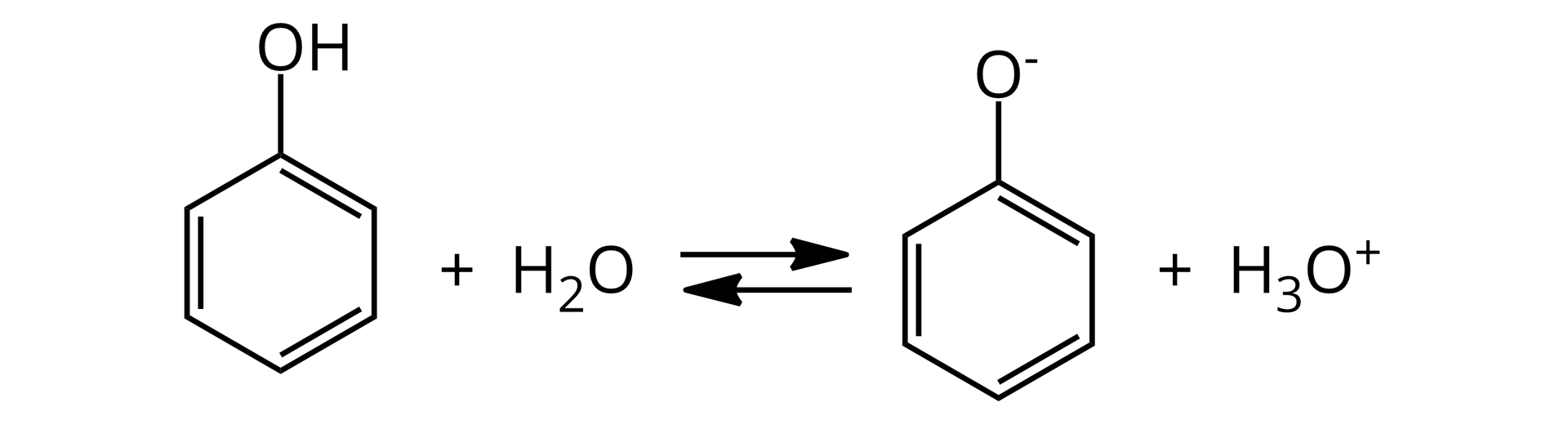
Fenole
Kwasy karboksylowe

Aminy

Cząsteczki fenoli i kwasów karboksylowych mają zdolność odszczepiania protonu, ponieważ istnieje w nich atom wodoru, stanowiący biegun dodatni, czyli połączony z silnie elektroujemnym atomem tlenu. Cząsteczki amin mają z kolei zdolność przyłączania protonu, ponieważ istnieje w nich atom pierwiastka o dużej elektroujemności (stanowiący biegun ujemny), który posiada wolną parę elektronową, zdolną do przyjęcia protonu.
Do cząsteczek obojętnych, nie ulegających w roztworach wodnych ani procesowi dysocjacji, ani hydrolizy, zaliczyć możemy: węglowodory, aldehydy, ketony, estry, tłuszcze, amidy, a także cukry. Cząsteczki tych związków organicznych nie zawierają atomów wodoru, zdolnych do odszczepienia oraz wolnych par elektronowych, zdolnych do przyjęcia protonu.
Zwróćmy uwagę na trzy grupy związków organicznych: alkohole, amidy oraz aminokwasy.
Alkohole w roztworach wodnych praktycznie nie ulegają dysocjacji elektrolitycznej, a równowaga reakcji przesunięta jest w stronę substratów.
Dlatego uznajemy, że alkohole wykazują w roztworze wodnym odczyn obojętny, ale mają właściwości lekko kwasowe. W pewnych specyficznych przypadkach lub w innych rozpuszczalnikach właściwości kwasowe alkoholi mogą być jednak znacznie silniejsze.
Dlaczego roztwór wodny mocznika (jak również pozostałych amidów) charakteryzuje się obojętnym odczynem, skoro mocznik posiada wolne pary elektronowe na atomach azotu?
Odczyn wodnego roztworu mocznika jest obojętny. Wynika to z oddziaływania wolnych par elektronowych atomów azotu z elektronami atomu tlenu grupy karbonylowej, w wyniku czego maleje gęstość elektronowa na atomach azotu, które nie są zdolne do przyłączenia protonu (kationu wodoru), z czym wiąże się znaczne obniżenie zasadowości. Dlatego mocznik, jak i wszystkie pozostałe amidy w roztworach wodnych wykazują odczyn obojętny.

Jaki odczyn w roztworze wodnym wykazują aminokwasy?
Odczyn wodnych roztworów wielu aminokwasów jest zbliżony do obojętnego. Wynika to z występowania w ich cząsteczkach zarówno grupy kwasowej ), jak i zasadowej (). W roztworze wodnym pojawiają się wówczas jony obojnacze, powstałe na skutek przeniesienia protonu z grupy karboksylowej na grupę aminową.
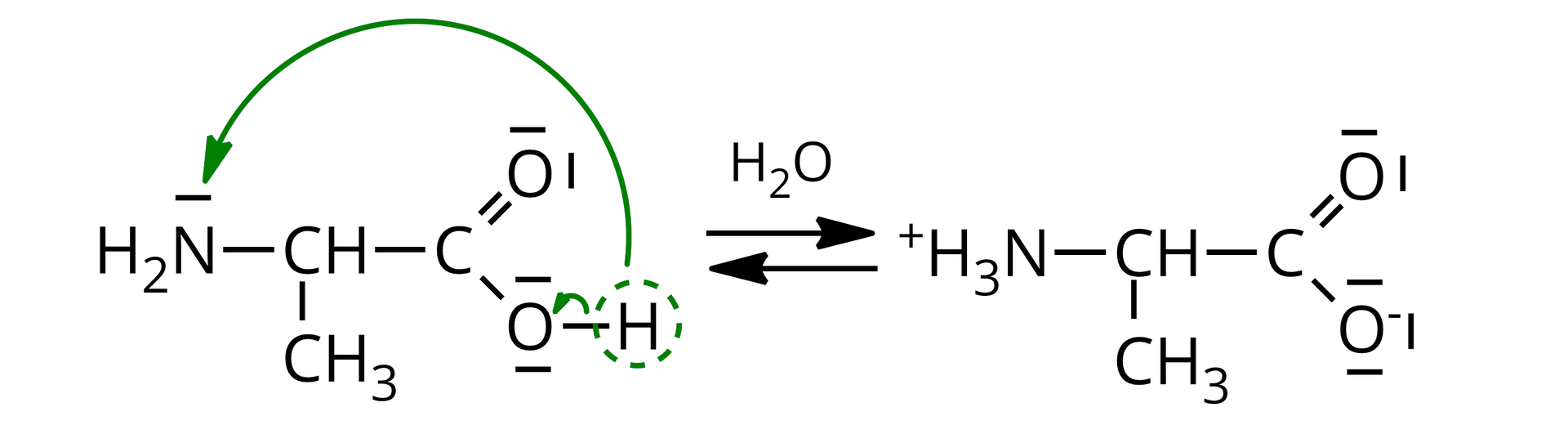
Należy jednak pamiętać, że niektóre aminokwasy zawierają więcej zasadowych grup aminowych niż kwasowych grup karboksylowych (np. lizyna) lub odwrotnie (np. kwas asparaginowy). Do głównych typów reakcji w chemii organicznej zaliczamy reakcje addycji, substytucji oraz eliminacji. Reakcje te zachodzą zgodnie z następującymi mechanizmami: wolnorodnikowym, elektrofilowym lub nukleofilowym.
Na zdolność ulegania różnym typom i mechanizmom reakcji związków organicznych ma wpływ ich budowa, a przede wszystkim rodzaje wiązań i grupy funkcyjne.
Typy i mechanizmy reakcji
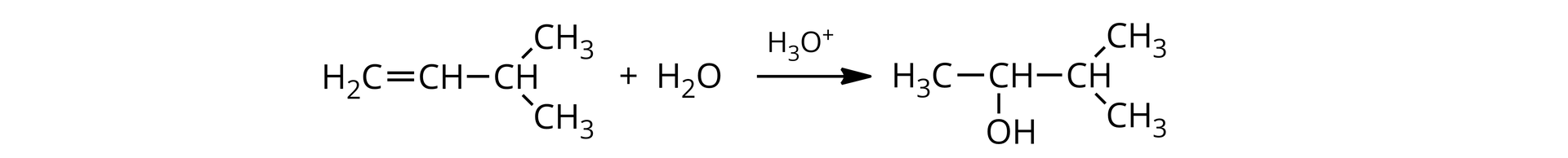
Węglowodory nienasycone, takie jak alkeny czy alkiny ulegają najczęściej reakcjom addycji elektrofilowej, ze względu na obecność wiązań wielokrotnych, które są źródłem elektronów pi (nie dotyczy to związków aromatycznych). Dzięki tym elektronom, tworzącym słabe wiązanie pi, związki te są podatne na atak elektrofilowy w reakcjach addycji, np. fluorowców, fluorowcowodorów czy wody. Skutkuje to odpowiednio podniesieniem lub obniżeniem punktu izoelektrycznego (pI - wartość pH, przy którym aminokwas występuje w roztworze wodnym w formie jonu obojnaczego), a także odpowiednim odczynem wynikającym z nadmiaru grup zasadowych lub kwasowych.

Substytucji elektrofilowej ulegają najczęściej węglowodory aromatycznewęglowodory aromatyczne, gdyż zawierają zdelokalizowaną chmurę elektronów. Zatem węglowodory aromatyczne są źródłem elektronów dla elektrofili, w reakcjach, takich jak np.: nitrowanie, sulfonowanie, chlorowanie czy alkilowanie. Benzen dąży do zachowania aromatyczności, dlatego chętniej ulega reakcjom substytucji niż addycji.


Substytucji nukleofilowej ulegają z kolei najczęściej alkohole oraz halogenki alkilowe (głównie halogenki pierwszorzędowe i niektóre halogenków drugorzędowe i trzeciorzędowe). W swojej budowie zawierają one wiązanie kowalencyjne spolaryzowane pomiędzy atomem węgla a grupą wodorotlenową () lub atomami fluorowców (). W związku z tym wokół tych atomów i grup gromadzą się cząstkowe ładunki ujemne, a wokół atomu węgla – cząstkowy ładunek dodatni. Zatem dodatnio naładowany atom węgla jest podatny na atak nukleofilowy.
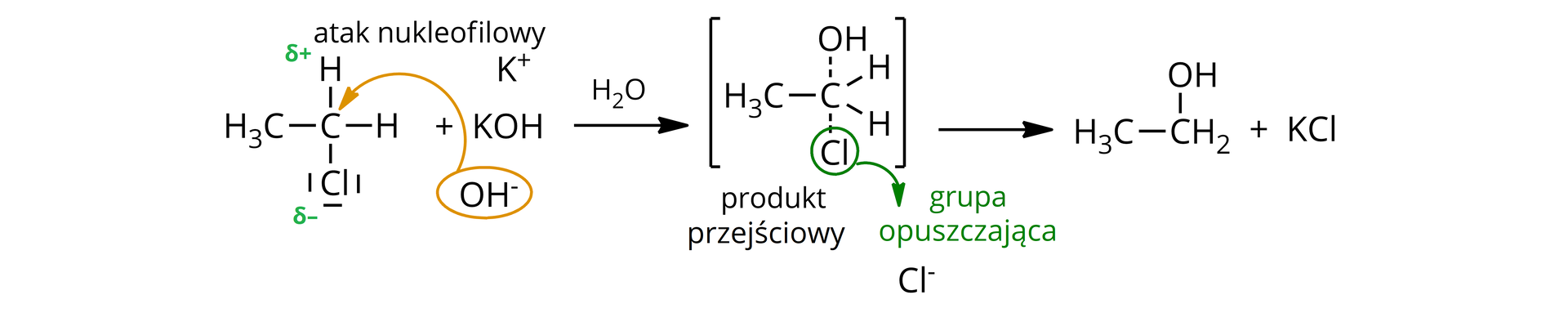
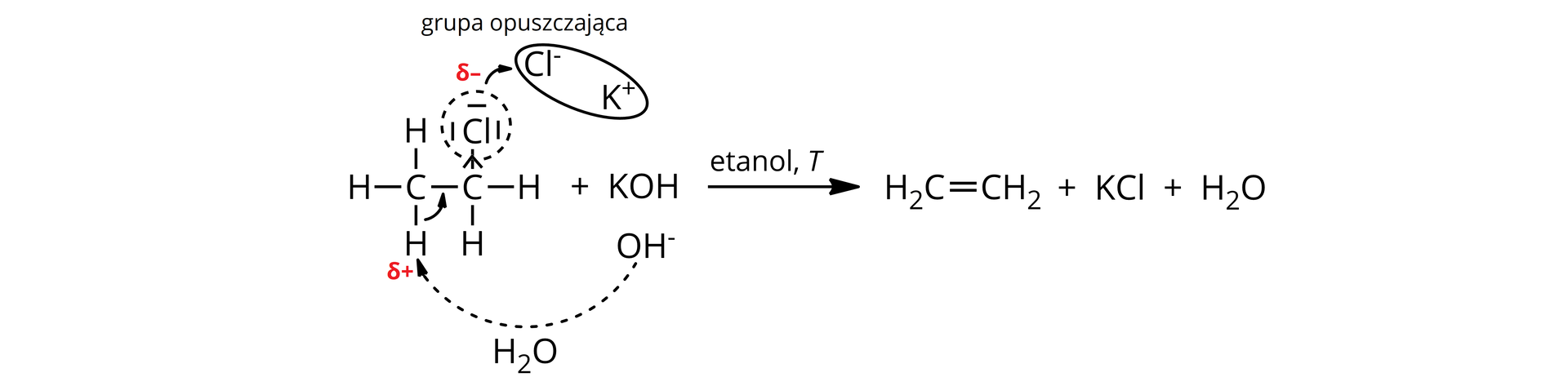
Eliminacja zachodzi głównie w reakcjach usuwania cząsteczek typu z alkoholi pierwszorzędowych, drugorzędowych i trzeciorzędowych halogenków alkilowych i wymaga dużego stężenia zasady. Należy pamiętać, że eliminacja jest reakcją konkurencyjną do reakcji substytucji nukleofilowej. Dlatego, aby otrzymać produkty eliminacji, a nie substytucji, należy reakcje prowadzić w warunkach bezwodnych.
Podobnie jak w przypadku substytucji nukleofilowej, związki chemiczne, ulegające eliminacji, zawierają wiązania kowalencyjne spolaryzowane pomiędzy atomem węgla a atomami fluorowców lub grupą wodorotlenową. Dzięki gromadzącym się wokół atomów cząstkowym ładunkom – dodatnim i ujemnym, możliwy jest atak nukleofilowy i odejście atomu fluorowca lub grupy wodorotlenowej jako grupy opuszczającej.
Słownik
węglowodory o cząsteczkach, w których atomy węgla tworzą otwarte łańcuchy (proste lub rozgałęzione); nasycone — alkany; nienasycone — alkeny i alkiny
węglowodory cykliczne o charakterze aromatycznym, zawierające w swojej budowie pierścień aromatyczny, czyli pierścień ze zdelokalizowaną chmurą elektronów (sekstetem elektronowym)
są to pochodne węglowodorów, zawierające jeden rodzaj grupy funkcyjnej, na przykład: alkohole, aldehydy, kwasy karboksylowe, aminy
są to pochodne węglowodorów, zawierające minimum dwie różne grupy funkcyjne, na przykład aminokwasy, cukry
ugrupowanie kilku atomów (lub pojedynczy atom), charakterystyczne dla danej grupy związków organicznych, na przykład grupy karboksylowej dla kwasów karboksylowych, grupy nitrowej dla związków nitrowych
atom lub grupa atomów zastępująca atom wodoru w cząsteczce związku organicznego
atomy węgla połączone ze sobą za pomocą wiązań
Bbliografia
Encyklopedia PWN
McMurry J., Chemia organiczna, Warszawa 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa 1985.