Przeczytaj
Kwasy karboksylowe
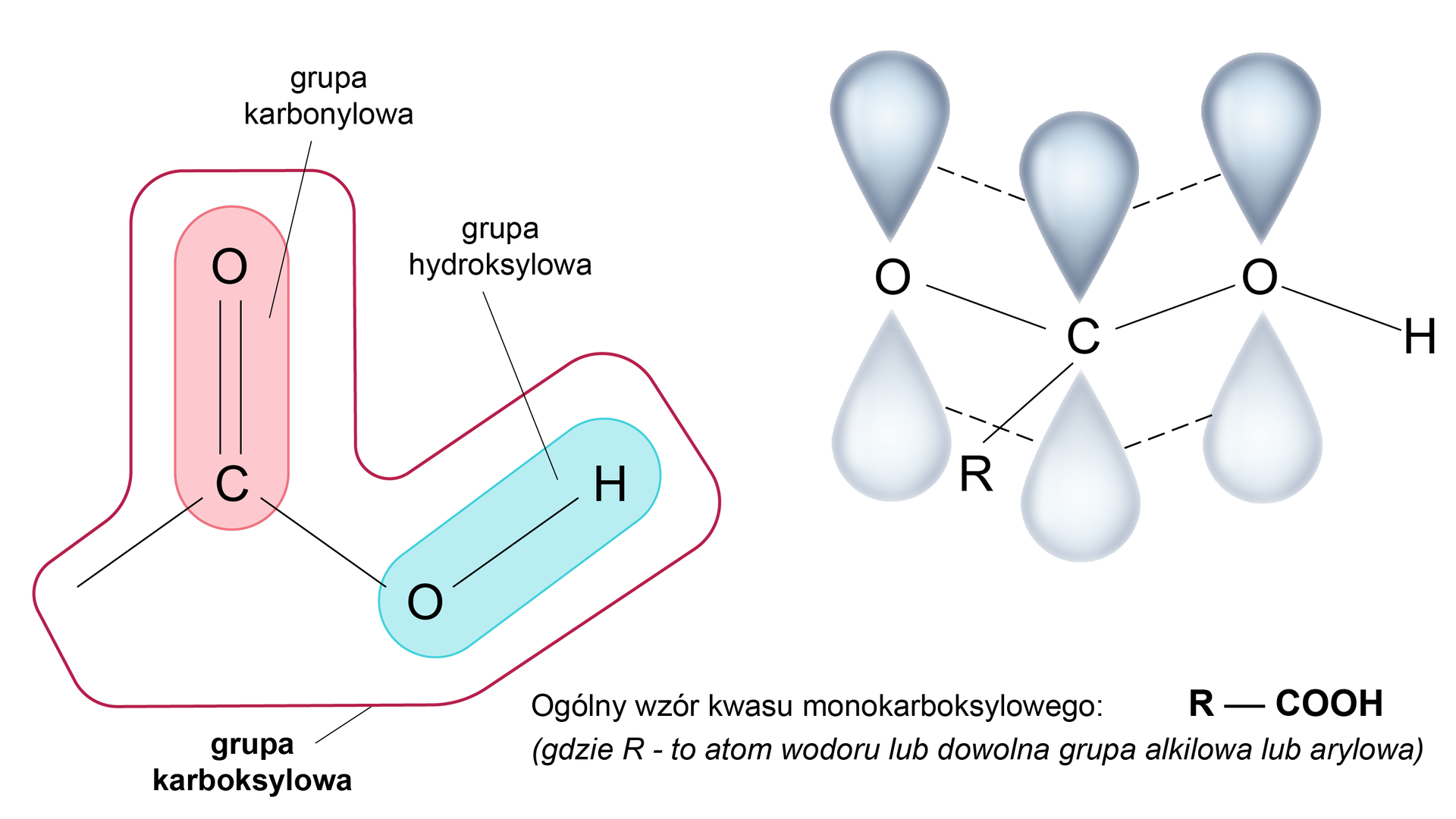
Kwasy karboksylowe to związki, w cząsteczkach których grupą funkcyjnągrupą funkcyjną jest grupa karboksylowa, czyli , składająca się z grupy karbonylowej oraz hydroksylowej. Ogólny wzór kwasu monokarboksylowego to , gdzie „R” jest atomem wodoru lub dowolną grupą alkilową lub arylową.
Podział kwasów karboksylowych
Kwasy karboksylowe to związki organiczne, które zawierają grupę funkcyjną – grupę karboksylową.
Kwasy karboksylowe o krótkich łańcuchach węglowych
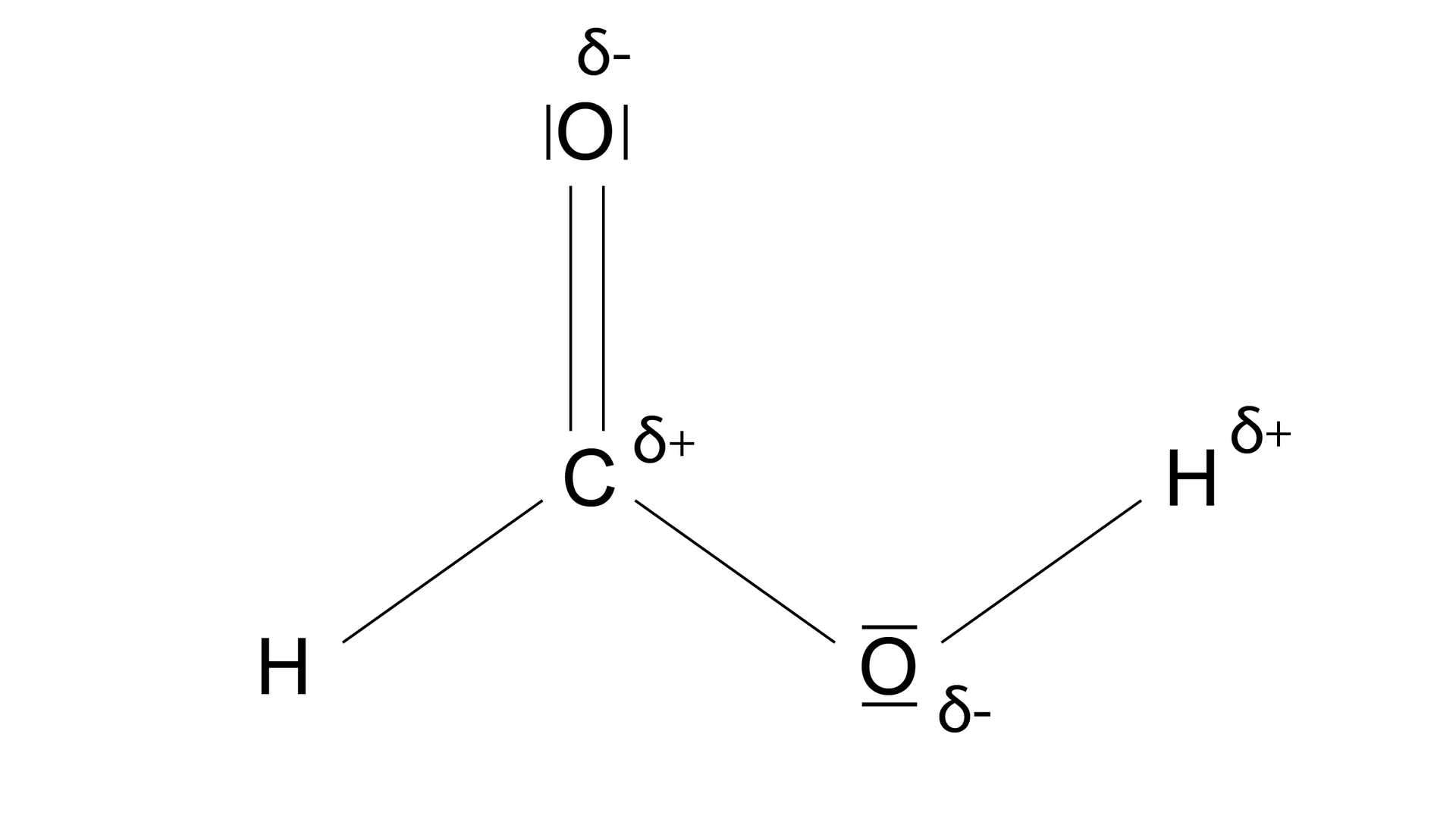
Najprostszym kwasem karboksylowym jest kwas metanowy, ale zaleca się go nazywać kwasem mrówkowym. Model kulkowy cząsteczki tego kwasu i jego wzór Lewisa przedstawiono poniżej.
Warto też przyjrzeć się długościom wiązań i wartościom kątów pomiędzy wiązaniami w cząsteczce tego kwasu, które zaznaczono na poniższym schemacie.

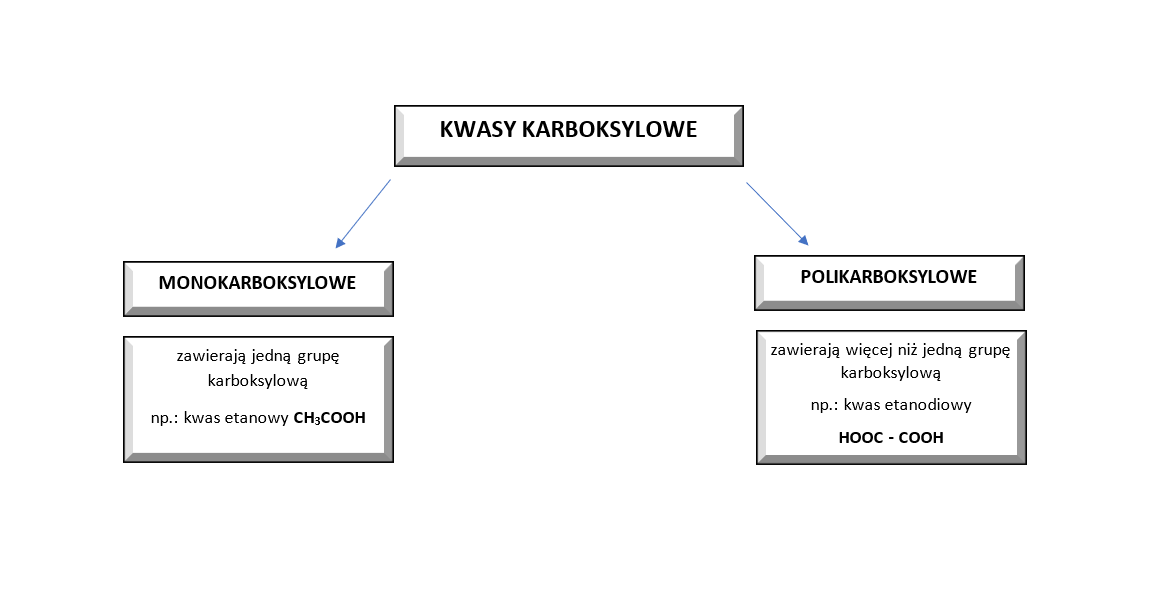
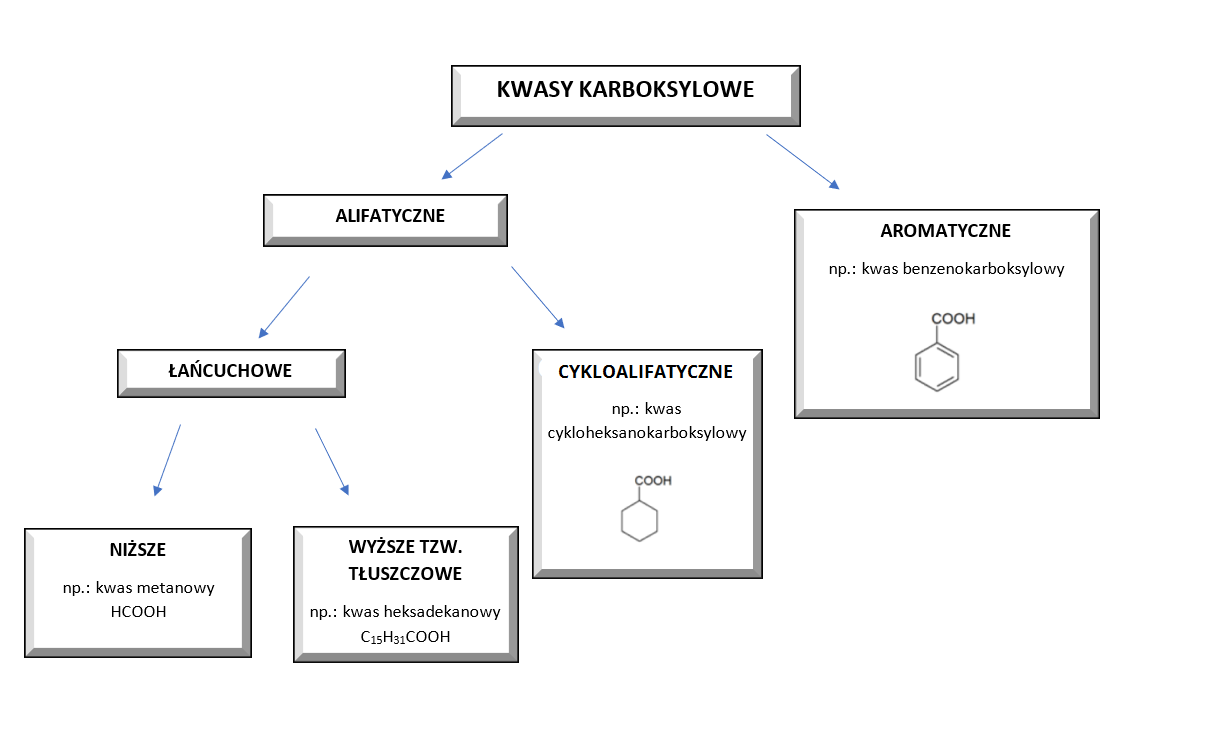
Biorąc pod uwagę liczbę grup karboksylowych oraz rodzaj reszty węglowodorowej, kwasy można podzielić w następujący sposób:
- Nazwa kategorii: Kwasy karboksylowe
- Nazwa kategorii: acykliczne (łańcuchowe)
- Nazwa kategorii: nasycone
- Nazwa kategorii: nienasycone Koniec elementów należących do kategorii acykliczne (łańcuchowe)
- Nazwa kategorii: cykliczne
- Nazwa kategorii: nasycone
- Nazwa kategorii: nienasycone
- Nazwa kategorii: aromatyczne Koniec elementów należących do kategorii cykliczne
- Elementy należące do kategorii Kwasy karboksylowe
- Elementy należące do kategorii acykliczne (łańcuchowe)
- Elementy należące do kategorii cykliczne
-
Kwasy karboksylowe
-
acykliczne (łańcuchowe)
-
nasycone
-
nienasycone
-
-
cykliczne
-
nasycone
-
nienasycone
-
aromatyczne
-
-
Poniżej zamieszczono tabelę, która przedstawia informacje na temat właściwości fizycznych wybranych nasyconych kwasów jednokarboksylowych.
Nazwa | TIndeks dolny TT [°C] | TIndeks dolny WW [°C] | Właściwości fizyczne w temperaturze pokojowej |
|---|---|---|---|
kwas mrówkowy (metanowy) | 8,30 | 100,7 | bezbarwna ciecz o charakterystycznym |
kwas octowy | 16,63 | 117,9 | bezbarwna, żrąca ciecz o charakterystycznym |
kwas butanowy | -4,30 | 163,3 | bezbarwna oleista ciecz o gorzkim |
kwas pentanowy | -33,8 | 186,3 | ciecz o nieprzyjemnym zapachu |
Poniższy schemat przedstawia zmianę właściwości fizycznych kwasów monokarboksylowych wraz ze wzrostem liczby atomów węgla w cząsteczce kwasu.
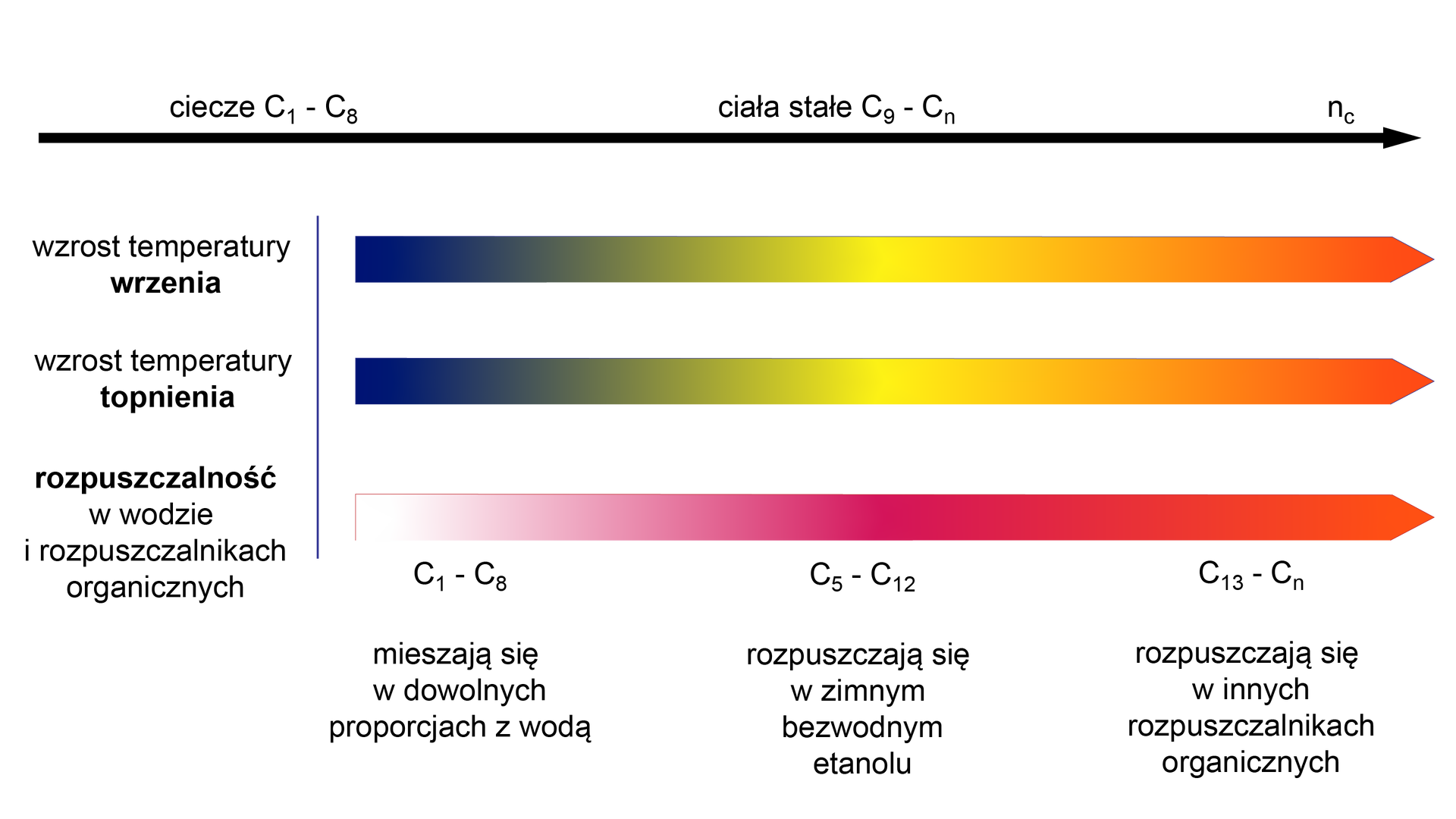
Wraz ze wzrostem długości łańcucha węglowego o charakterze hydrofobowymhydrofobowym (wiązania węgiel–wodór należą do wiązań atomowych niespolaryzowanych), maleje rozpuszczalność kwasu w wodzie. Wraz ze wzrostem liczby atomów węgla w łańcuchu węglowym, cząsteczka kwasu monokarboksylowego staje się więc coraz bardziej hydrofobowa (apolarna). Kwasy o długich łańcuchach węglowodorowych rozpuszczają się praktycznie tylko w rozpuszczalnikach organicznych niepolarnych.
Polarność
Temperatura wrzenia
Tworzenie wiązań wodorowych pomiędzy cząsteczkami kwasów jest najważniejszą przyczyną stosunkowo wysokich temperatur wrzenia tych związków. Temperatura wrzenia kwasów karboksylowych jest wyraźnie wyższa od temperatury wrzenia alkoholi o podobnych masach molowych, np. temperatury wrzenia kwasu butanowego (M = 88 ) i pentan‑1-olu (M = 88 ) wynoszą odpowiednio 164°C i 138°C. Temperatura wrzenia homologów kwasów karboksylowych rośnie w regularny sposób wraz ze zwiększaniem się długości łańcucha węglowego.
Temperatura topnienia
Temperatury topnienia nasyconych kwasów monokarboksylowych , o parzystej liczbie atomów węgla w cząsteczce, są wyższe od temperatur topnienia sąsiadujących z nimi homologów o nieparzystej liczbie atomów węgla w cząsteczce. Dla przykładu: temperatury topnienia kwasów butanowego, pentanowego i heksanowego wynoszą odpowiednio: –8ºC, –34,5ºC,–3ºC. Kształt cząsteczki kwasu może również mieć istotny wpływ na temperaturę topnienia.
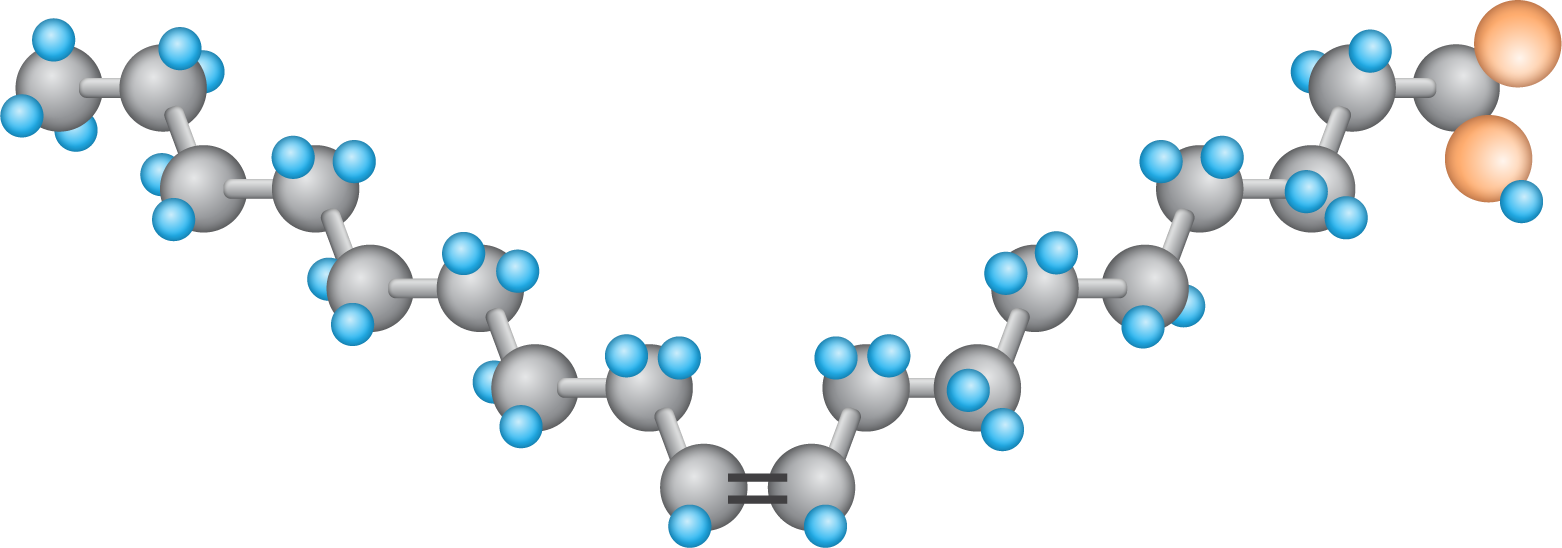 | 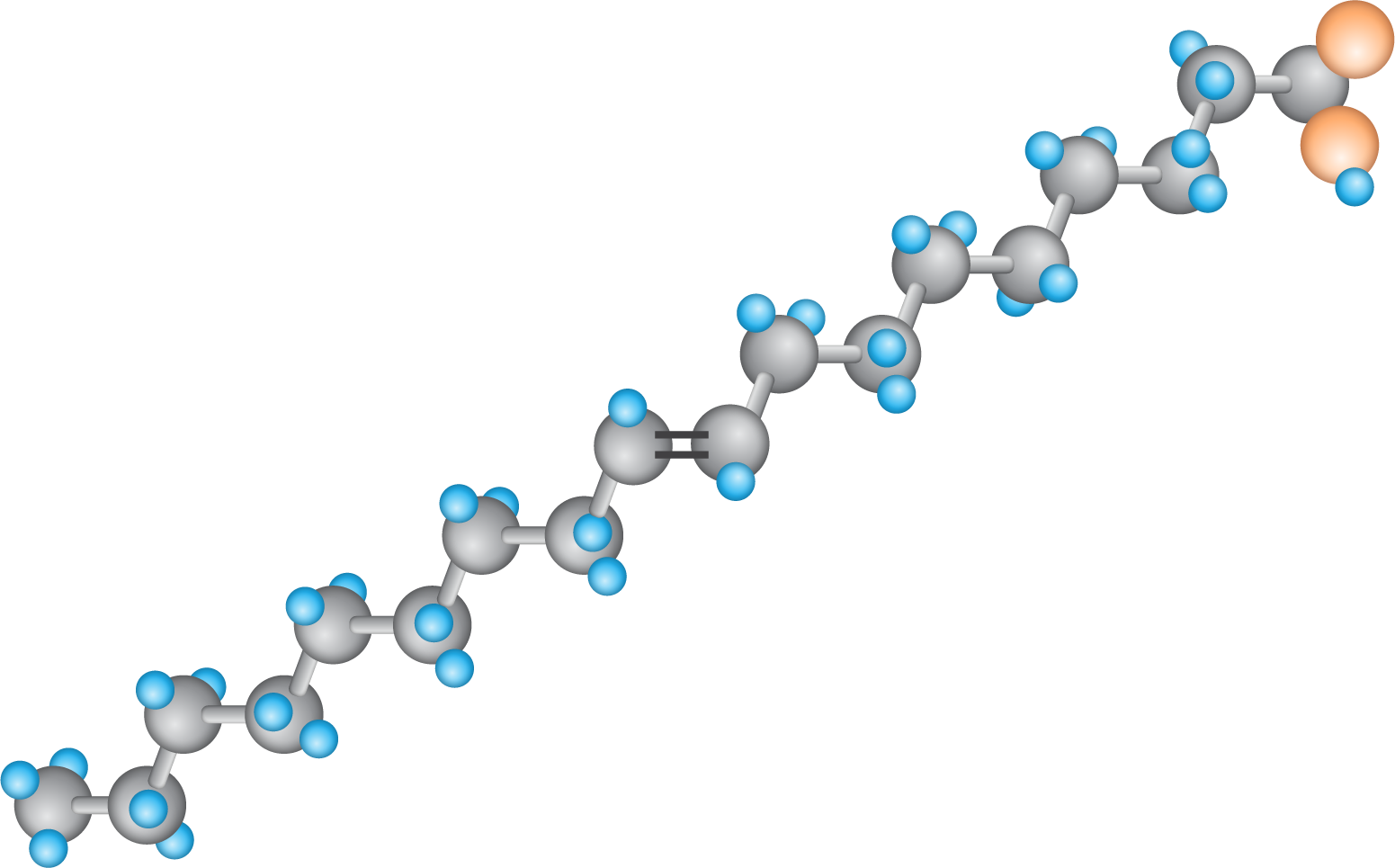 |
|---|---|
kwas oleinowy kwas 9Z-oktadecenowy T=16°C | kwas elaidynowy kwas 9E‑oktadecenowy T=51°C |
Temperatura topienia nienasyconych kwasów karboksylowych wyraźnie zmniejsza się w miarę zwiększania się liczby wiązań podwójnych w cząsteczce.
Rozpuszczalność
Kwasy karboksylowe wykazują lepszą rozpuszczalność w wodzie w porównaniu z odpowiednimi alkoholami. Wynika to z możliwości tworzenia przez cząsteczkę kwasu większej liczby wiązań wodorowychwiązań wodorowych z cząsteczkami wody niż z alkoholem. Kwasy karboksylowe (również te nierozpuszczalne w wodzie) rozpuszczają się dobrze w etanolu. Jest to skutkiem tworzenia przez etanol wiązań wodorowych z kwasem oraz oddziaływań van der Waalsa pomiędzy niepolarnymi grupami węglowodorowymi kwasu i etanolu.

Moc kwasów karboksylowych
Kwasy karboksylowe są słabymi kwasami. Proces ich dysocjacji jonowej można zapisać ogólnym równaniem:

Stała dysocjacji () tych kwasów jest rzędu wielkości . W roztworach wodnych kwasy karboksylowe ulegają dysocjacji elektrolitycznej z odszczepieniem kationu oksoniowego .
Słownik
ugrupowanie kilku atomów (lub pojedynczy atom) charakterystyczne dla danej grupy związków organicznych, np. grupa karboksylowa dla kwasów karboksylowych, grupa nitrowa dla związków nitrowych
właściwość substancji, która polega na niezdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą bądź grupami polarnymi innych cząsteczek; cecha makroskopowa materiałów, obrazująca ich brak zdolności do zwilżania przez wodę
(łac. associatio „połączenie”, „związek”) odwracalne łączenie się indywiduów chemicznych (cząsteczek, jonów, atomów) w większe układy (tzw. asocjaty), złożone z dwóch lub większej liczby cząstek
cząsteczka utworzona w wyniku połączenia się dwóch takich samych cząsteczek prostych (monomerów)
rodzaj oddziaływania międzycząsteczkowego lub wewnątrzcząsteczkowego za pośrednictwem atomu wodoru; w wiązaniu wodorowym atom wodoru tworzy mostek łączący dwa silnie elektroujemne (elektroujemność) atomy X–H...Y; z jednym z nich (X) połączony jest wiązaniem kowalencyjnym (wiązanie chemiczne), a z drugim — siłami elektrostatycznymi
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.