Przeczytaj
Co to jest szkło?
To nieorganiczny materiał, który został schłodzony do stanu stałego bez krystalizacji. Pod względem stanu skupienia jest zaliczany do ciał stałych amorficznych.
To każda substancja rentgenograficznie bezpostaciowa, wykazująca przemianę zeszklenia (witryfikacji).
Ma strukturę charakteryzującą się brakiem uporządkowania dalekiego zasięgu.uporządkowania dalekiego zasięgu.
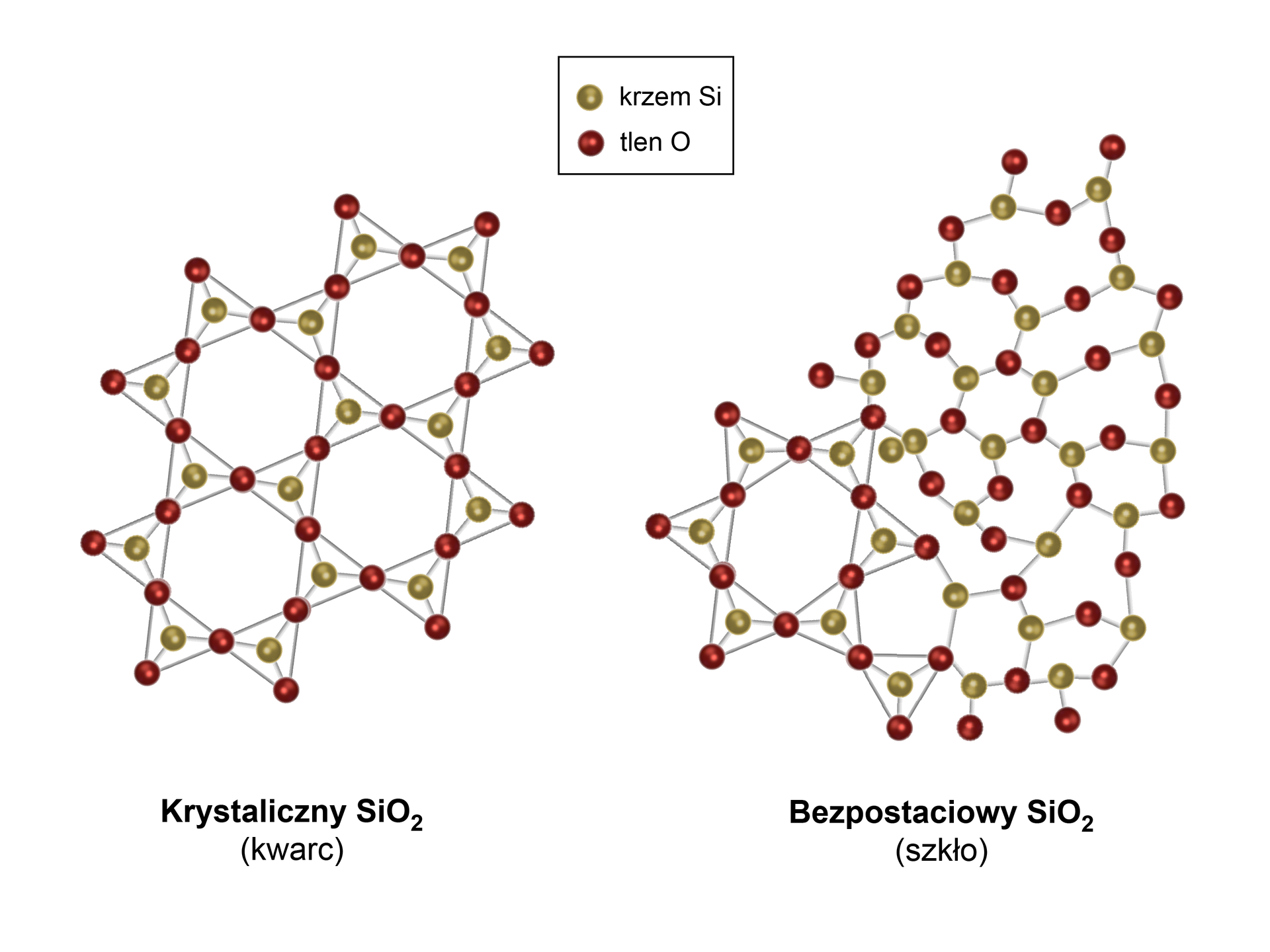
W ciałach stałych amorficznych występuje brak uporządkowania dalekiego zasięgu. Nie wykazują one właściwości siatki dyfrakcyjnej.siatki dyfrakcyjnej.

Stała siatki dyfrakcyjnej (d) to parametr charakteryzujący siatkę dyfrakcyjną. Wyraża on odległość między środkami kolejnych szczelin. Dla promieniowania rentgenowskiego:
jest stanem nietrwałym, w którym brakuje równowagi strukturalno‑teksturalnej;
jest produktem niekrystalicznym.
- Nazwa kategorii: SPOSOBY TWORZENIA SUBSTANCJI AMORFICZNYCH
- Nazwa kategorii: TECHNOLOGIE PRZEMYSŁOWE
- Nazwa kategorii: TOPIENIE
- Nazwa kategorii: PRZECHŁODZENIE STOPU
- Nazwa kategorii: FORMOWANIE
- Nazwa kategorii: WITRYFIKACJA (ZESZKLENIE)
- Nazwa kategorii: STABILIZACJA STRUKTURY (ODPRĘŻANIE) Koniec elementów należących do kategorii TECHNOLOGIE PRZEMYSŁOWE
- Nazwa kategorii: TECHNOLOGIE SPECJALNE
- Nazwa kategorii: Z FAZY GAZOWEJ
- Nazwa kategorii: METODA CVD Koniec elementów należących do kategorii Z FAZY GAZOWEJ
- Nazwa kategorii: Z FAZY CIEKŁEJ
- Nazwa kategorii: METODA ZOL-ŻEL (SYNTEZA SZKIEŁ Z ROZTWORU) Koniec elementów należących do kategorii Z FAZY CIEKŁEJ
- Elementy należące do kategorii SPOSOBY TWORZENIA SUBSTANCJI AMORFICZNYCH
- Elementy należące do kategorii TECHNOLOGIE PRZEMYSŁOWE
- Elementy należące do kategorii TECHNOLOGIE SPECJALNE
- Elementy należące do kategorii Z FAZY GAZOWEJ
- Elementy należące do kategorii Z FAZY CIEKŁEJ
-
SPOSOBY TWORZENIA SUBSTANCJI AMORFICZNYCH
-
TECHNOLOGIE PRZEMYSŁOWE
-
TOPIENIE
-
PRZECHŁODZENIE STOPU
-
FORMOWANIE
-
WITRYFIKACJA (ZESZKLENIE)
-
STABILIZACJA STRUKTURY (ODPRĘŻANIE)
-
-
TECHNOLOGIE SPECJALNE
-
Z FAZY GAZOWEJ
-
METODA CVD
-
-
Z FAZY CIEKŁEJ
-
METODA ZOL-ŻEL (SYNTEZA SZKIEŁ Z ROZTWORU)
-
-
-
Każde szkło jest ciałem amorficznym, ale nie każde ciało stałe amorficzne jest szkłem.
Szkło produkowane jest poprzez ochładzanie stopu (fazy ciekłej). Ogrzewane szkło mięknie, następnie staje się ciągliwe, aż do przekształcenia się w ruchliwą ciecz. Proces ten jest odwracalny.
CIAŁO STAŁE | STRUKTURA | OTRZYMYWANIE |
|---|---|---|
krystaliczne | uporządkowania dalekiego zasięgu | proces krystalizacji w określonej temeperaturze |
szkliste | uporządkowania bliskiego zasięgu | przeobrażenia strukturalne zachodzące w sposób ciągły |
Ciało amorficzne i szkliste wykazują brak uporządkowania dalekiego zasięgu.

Różnica między ciałem stałym krystalicznym a amorficznym dotyczy budowy struktury wewnętrznej. Kulki na rysunku symbolizują indywidua chemiczne o różnych kształtach.
Przykłady materiałów amorficznych
Źródło: Géry Parent, licencja: domena publiczna, dostępny w internecie: commons.wikimedia.org., Monacyt to rzadko występujący minerał, który jest mieszaniną soli kwasu fosforowego(), ceru i kilku lantanowców. Zdjęcie przedstawia kawałek monacytu. Brązowy minerał ma kształt wielościanu.
Źródło: Aangelo, licencja: CC BY-SA 3.0, dostępny w internecie: commons.wikimedia.org.
Szkło z punktu widzenia chemika
- Nazwa kategorii: SZKŁO
- Nazwa kategorii: SUROWCE[br] SZKŁOTWÓRCZE
- Nazwa kategorii: MODYFIKATORY
- Nazwa kategorii: TOPNIKI
- Nazwa kategorii: SUROWCE [br] POMOCNICZE Koniec elementów należących do kategorii SZKŁO
- Elementy należące do kategorii SZKŁO
Substancje szkłotwórcze:
posiadają wysoką lepkość w stanie stopionym blisko temperatury topnienia;
posiadają wysoką lepkość w stanie stopionym blisko temperatury topnienia;
charakteryzują się niską liczbą koordynacyjnąliczbą koordynacyjną.
Główne grupy substancji szkłotwórczych
Pierwiastki
S, Se, Te, As, C, B, Si, P
Tlenki
SiO2, B2O3, P4O10, GeO2,
As2O5
Polimery organiczne
Związki z grupą hydroksylową
alkohole, gliceryna (propano-1,2,3-triol)
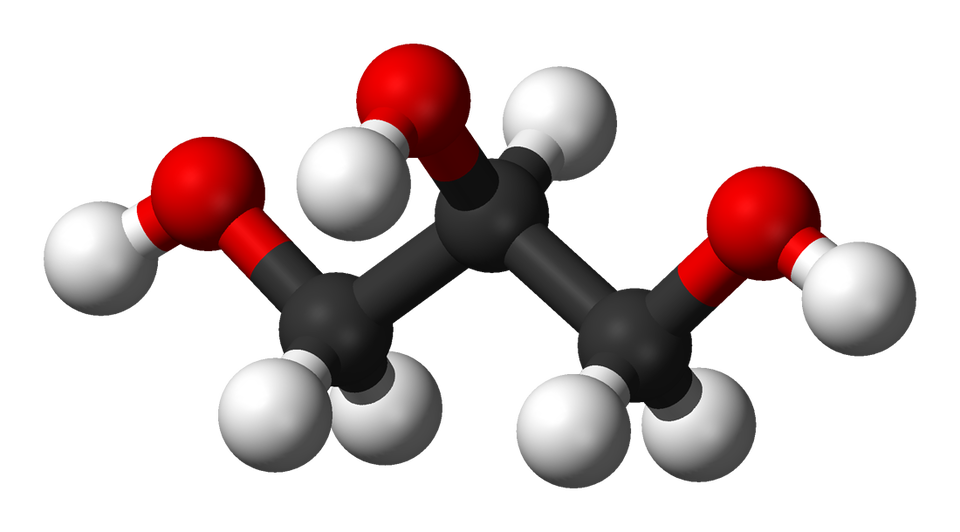
Białe kule – atomy wodoru, szare kule – atomy węgla, czerwone kule – atomy tlenu
Topniki – związki obniżające temperaturę topienia surowców szkłotwórczych.
- węglan sodu – ;
- węglan potasu – ;
- węglan wapnia – .
Surowce węglanowe
węglan sodu – Na2CO3
węglan potasu – K2CO3
węglan wapnia – CaCO3
Modyfikatory – związki modyfikujące właściwości szkła.
- węglan baru – ;
- węglan magnezu – .
- tlenki ołowiu() – ;
- tlenek cynku – ;
- tlenek glinu – .
Surowce węglanowe:
węglan baru – BaCO3
węglan magnezu – MgCO3
Tlenki
tlenki ołowiu(II) – PbO
tlenek cynku – ZnO
tlenek glinu – Al2O3
Źródło: Kluka, licencja: CC BY-SA 3.0, dostępny w internecie: commons.wikimedia.org.
Surowce pomocnicze:
- Azotan() sodu – .
- Azotan() potasu – .
- Siarczan() sodu – .
- Związki manganu i niklu, barwiące szkło na fioletowo.
- Związki kobaltu i miedzi, barwiące szkło na niebiesko.
- Związki żelaza i chromu, barwiące szkło na zielono.
- Związki siarki, żelaza z dodatkiem manganu, kadmu i srebra, barwiące szkło na żółto i brązowo.
- Związki miedzi, złota i selenu, barwiące szkło na czerwono.
- Związki kobaltu i selenu.
- Ołów.
- Nikiel.
- Selenian sodu – .
Związki wspomagające odgazowanie stopu (surowce klarujące)
azotan(V) sodu – NaNO3
azotan(V) potasu – KNO3
siarczan(VI) sodu – Na2SO4
Związki barwiące
1. Związki manganu i niklu, barwiące szkło na fioletowo.
2. Związki kobaltu i miedzi, barwiące szkło na niebiesko.
3. Związki żelaza i chromu, barwiące szkło na zielono.
4. Związki siarki, żelaza z dodatkiem manganu, kadmu i srebra, barwiące szkło na żółto i brązowo.
5. Związki miedzi, złota i selenu, barwiące szkło na czerwono.
Związki odbarwiające
1. Związki kobaltu i selenu.
2. Ołów.
3. Nikiel.
4. Selenian sodu – Na2SeO4.
Związki powodujące zmącenie
1. Związki fluoru.


Ułóż we właściwej kolejności etapy wytapiania szkła.
- Rozpuszczają się w fazie ciekłej SiO2 i krzemiany.
- Koniec procesu topienia i rozpuszczania składników: 1200-1300°C.
- Klarowanie szkła około 1450-1500°C. Proces przyspieszają dodatki klarujące, np. azotany(V), siarczany(VI).
- Odparowanie wilgoci z surowców.
- W temperaturze około 400°C zachodzi reakcja: Na2CO3 + CaCO3 ⇆ Na2Ca(CO3)2
- Studzenie masy do temperatury formowania 1100-1200°C.
- Około 785°C – faza ciekła.
- Wydzielanie CO2 następuje powyżej temperatury 600°C.
- W temperaturze 573°C ma miejsce przekształcenie 𝛼-SiO2⟶𝛽-SiO2
Współczesna produkcja szkła
Wyprodukowane szkło może zostać poddane modyfikacjom
Rodzaje szkła
Szkło znajduje zastosowanie w wielu dziedzinach życia codziennego. Wszechstronność ta wynika z dużej możliwości modyfikowania procesu produkcji i właściwości tego materiału. Na poszczególne cechy różnych rodzajów szkła wpływa jego budowa chemiczna.
1. Kwarcowe (krzemionkowe)
Główny () składnik , którym jest tlenek krzemu(), tlenek krzemu() – krzemionkakrzemionka, jest odporny na szok termiczny. Rozgrzane naczynie wyprodukowane z tego rodzaju szkła, nie pęknie nawet po włożeniu do wody. Posiada wysoką odporność na działanie wody i silnych kwasów. Szeroko stosowane w badaniach naukowych i procesach przemysłowych dzięki:
przejrzystości optycznej;
małemu przewodzeniu ciepła i prądu elektrycznego;
wysokiej przepuszczalność promieni UVpromieni UV.

2. Sodowo‑wapniowe
Najbardziej rozpowszechniony rodzaj szkła. Jest wytwarzane przez stopienie głównie: sody (wodorowęglan sodu ), węglanu wapnia (), krzemionki (tlenku krzemu() ). Dodaje się również małe ilości środków klarujących szkło. Temperatura w piecu wynosi do .
Rodzaj | ||||||
|---|---|---|---|---|---|---|
Sodowo‑wapniowe | – | |||||
Sodowo‑wapniowe | ||||||
Sodowo‑wapniowe | – | – |
Źródło: Paweł Cieśla, Małgorzata Nodzyńska, Duch chemii część 2, 2015.
Skład chemiczny szkła sodowo‑wapniowego zależy od jego przeznaczenia.
3. Ołowiowe (kryształowe)
Ołów w gotowej masie szklanej jest obecny jako jon modyfikującego . Ten rodzaj szkła jest ceniony ze względu na swoją wytrzymałość i walory estetyczne.

Rodzaj | |||||
|---|---|---|---|---|---|
Ołowiowe |
Źródło: Paweł Cieśla, Małgorzata Nodzyńska, Duch chemii część 2, 2015.
Szkłem ołowiowym nazywamy szkło, które zawiera ponad tlenku ołowiu().
4. Borowo‑krzemowe
Szkło przeznaczone do pracy z kwasami, zasadami. Odporne na niszczące działanie pary wodnej. Sprawdza się w temperaturze pracy ciągłej do .
Rodzaj | |||||||
|---|---|---|---|---|---|---|---|
Borowo‑krzemowe | – | ||||||
Borowo‑krzemowe | – | – |
Źródło: Paweł Cieśla, Małgorzata Nodzyńska, Duch chemii część 2, 2015.
Odporność na korozję i wysoką temperaturę sprawia, że ten rodzaj szkła wykorzystywany jest zarówno w kuchni, jak i laboratorium.
5. Wodne potasowe i sodowe
Szkłem wodnym nazywamy wodne roztwory krzemianów, m.in. potasu i sodu. Są ekologiczne i powszechnie stosowane w różnych gałęziach przemysłu.
Na przestrzeni wieków udoskonaliła się technologia wytwarzania szkła. Warto uświadomić sobie, że potrzeby rynku powodują ciągłe prace nad powstaniem produktu o nowych parametrach. Obniżanie kosztów produkcji jest bodźcem do badań nad nowymi rozwiązaniami technicznymi w przemyśle szklarskim. Szkło stało się materiałem ogólnodostępnym. Jego produkcja i obróbka zapewnia pracę wielu osobom. Jak podaje Rocznik Statystyczny Przemysłu w Polsce, w roku ta gałąź przemysłu zatrudniła osób.
Słownik
właściwość substancji polegająca na odpychaniu cząsteczek wody
tlenek krzemu(); najczęściej krystaliczne ciało stałe o dużej twardości; tworzy minerał o nazwie kwarc – składnik skał, piasku i wielu innych
liczba drobin o charakterze donorowym (np. anionów prostych i złożonych oraz cząsteczek elektrycznie obojętnych, zawierających co najmniej jeden atom posiadający wolne pary elektronowe) i otaczających bezpośrednio jon centralny (zwykle wynosi , , , )
metalowa rurka ze stopu żaroodpornego, służąca do wydmuchiwania szkła
promieniowanie elektromagnetyczne o długości fali od do , niewidzialne dla człowieka
przyrząd optyczny, który stanowi układ bardzo wielu, wąskich, równoległych do siebie i równych szczelin
wodorowęglan sodu o wzorze sumarycznym: ; związek chemiczny nieorganiczny, zaliczany do wodorowęglanów
regularne uporządkowanie cząsteczek, atomów lub jonów w materiałach; zwykle przyjmuje się, że uporządkowanie jest dalekozasięgowe, gdy regularne struktury w materiale występują na odległościach nie mniejszych niż - nanometrów
Bibliografia
Ogłaza L., Szkła wodne sodowe i potasowe – teraźniejszość i nowe wyzwania, Zakłady Chemiczne “Rudniki” S.A., CHEMIK 2010,64,3, 133‑136.
Nodzyńska M., CHEMIA DLA NIE‑CHEMIKÓW podręcznik, Zakład Chemii i Dydaktyki Chemii Uniwersytet Pedagogiczny im. Komisji Edukacji Narodowej, ISBN: 978‑83‑7271‑797‑9.
Pilkington L. A. B., The Float Glass Process, Review Lecture. „Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences”. 314 (1516), s. 1‑25, 1969. The Royal SocietyDOI: 10.1098/rspa.1969.0212.
Shelby J.E., Introduction to Glass Science and Technology, The Royal Society of Chemistry 2005.
Zarzycki J., Materials Science and Technology – Glasses and Amorphous Materials, Vol. 9.
Czarnecki K., Zwiększanie trwałości matryc do przemysłowej produkcji elementów szklanych, POLITECHNIKA WARSZAWSKA Wydział Budownictwa, Mechaniki i Petrochemii, Płock 2016.
www.continentaltrade.com.pl (dostęp 09.02.2021).
www.if.pwr.wroc.pl – materiałoznawstwo optyczne wykład 1 (dostęp 09.02.2021).
www.if.pwr.wroc.pl – materiałoznawstwo optyczne wykład 4 (dostęp 09.02.2021).
brasil.cel.agh.edu.pl (dostęp 09.02.2021).
www.medicaldesignbriefs.com – Draw‑Tower Gratings in Multicore Fiber: A Paradigm Shift in Curvature Sensing (dostęp 09.02.2021).
trucinska.zut.edu.pl – Szkło w budownictwie (dostęp 09.02.2021).
www.metroglass.co.nz (dostęp 09.02.2021).
www.sinograf.com –WŁÓKNO SZKLANE – PROCES TWORZENIA, NOWE TECHNOLOGIE I ŚWIATOWY RYNEK (dostęp 09.02.2021).













