Przeczytaj
KwasyKwasy to związki chemiczne, które, zgodnie z teorią Arrheniusa, ulegają dysocjacji elektrolitycznej w środowisku wodnym na jon wodoru (który jednak bardzo szybko łączy się z cząsteczką wody, tworząc jon oksoniowy) i anion reszty kwasowejreszty kwasowej. Potocznie kwasami nazywamy substancje, których wodne roztwory, przy odpowiednich stężeniach, charakteryzują się wartością niższą niż (im ta wartość jest niższa, tym większa jest ich kwasowość). Kwasy mogą być zarówno związkami nieorganicznymi, jak i organicznymi.
Kwasy nieorganiczne to związki o charakterze kwasowym (zgodnie z teorią Arrheniusa), które w swojej strukturze nie posiadają wiązań węgiel–węgiel ani wiązań węgiel–wodór (wyjątkiem jest wodny roztwór cyjanowodoru – cyjanowodór posiada wiązanie węgiel–wodór). Grupę tę można podzielić na kwasy beztlenowe, np. takie, które w większości są wodnymi roztworami wodorków niemetali grup oraz , np. ,, i nie zawierają w swojej reszcie kwasowej żadnego atomu tlenu, oraz kwasy tlenowekwasy tlenowe, np. oraz , które zawierają w reszcie kwasowej od do atomów tlenu, a także atom pierwiastka kwasotwórczego. Do kwasów tlenowych zalicza się również tak zwane polikwasy, czyli związki nieorganiczne o charakterze kwasowym, powstałe w wyniku kondensacji kilku cząsteczek kwasu tlenowego. Polikwasy posiadają w swojej cząsteczce więcej niż jeden atom pierwiastka kwasotwórczego, np. lub .
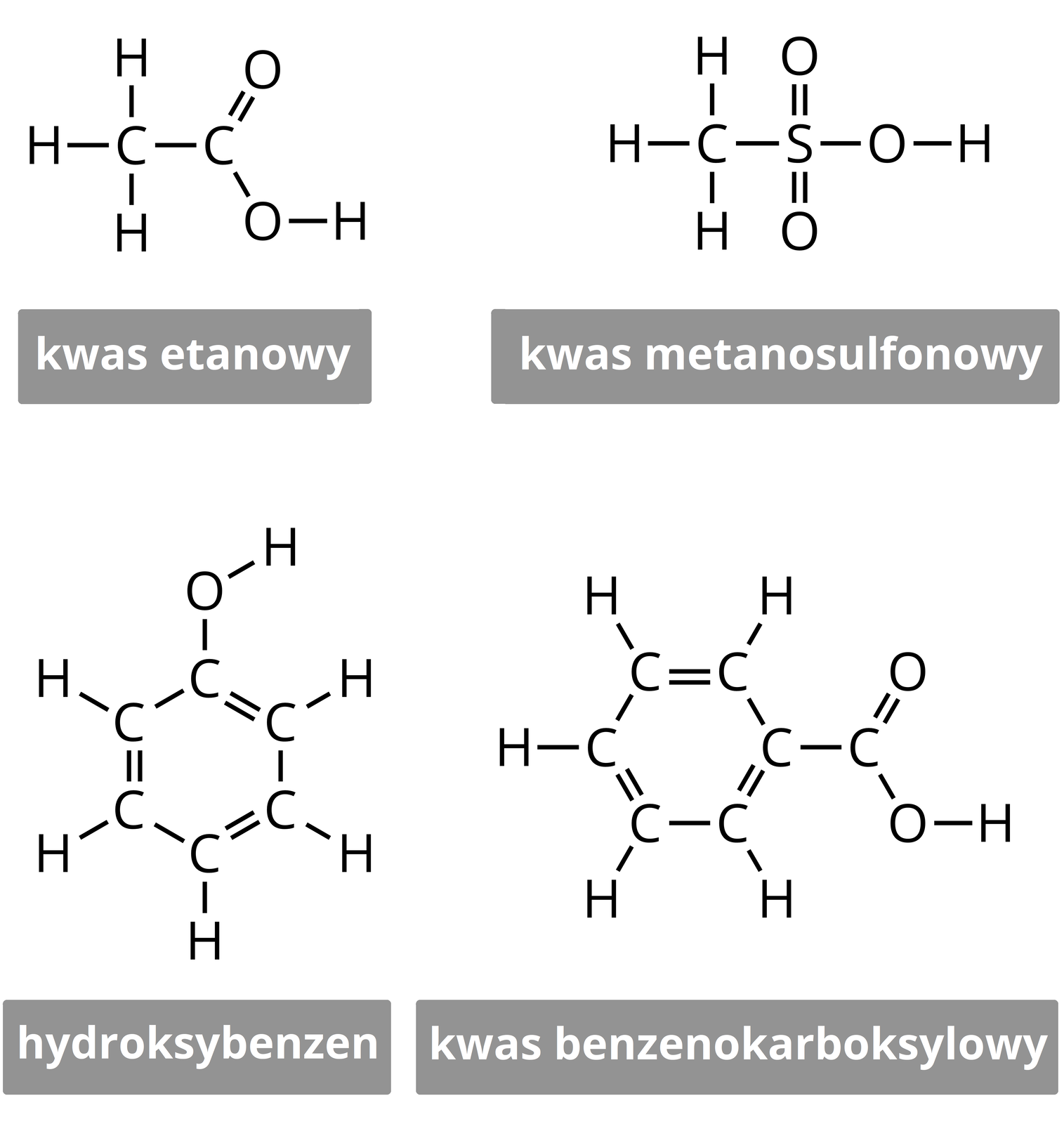
Kwasy organiczneKwasy organiczne to związki organiczne, które wykazują właściwości kwasowe (zgodnie z teorią Arrheniusa). Wszystkie kwasy organiczne są kwasami tlenowymi. Wśród nich najliczniejsze są kwasy karboksylowe (posiadające jedną lub więcej grup karboksylowych), np. lub , ale występują też kwasy sulfonowe (posiadające jedną lub więcej grup sulfonowych), np. , a także fenole. Wśród tak licznej klasy związków można znaleźć kwasy o szerokiej skali zastosowań, w zależności od właściwości danego z nich.
Poniżej wymienione zostały przykłady kwasów wraz z ich zastosowaniami.
Kwas siarkowy()
Jest to kwas nieorganiczny (o wzorze sumarycznym i masie ), który stanowi oleistą i bezbarwną ciecz o silnych właściwościach utleniających i higroskopijnych.
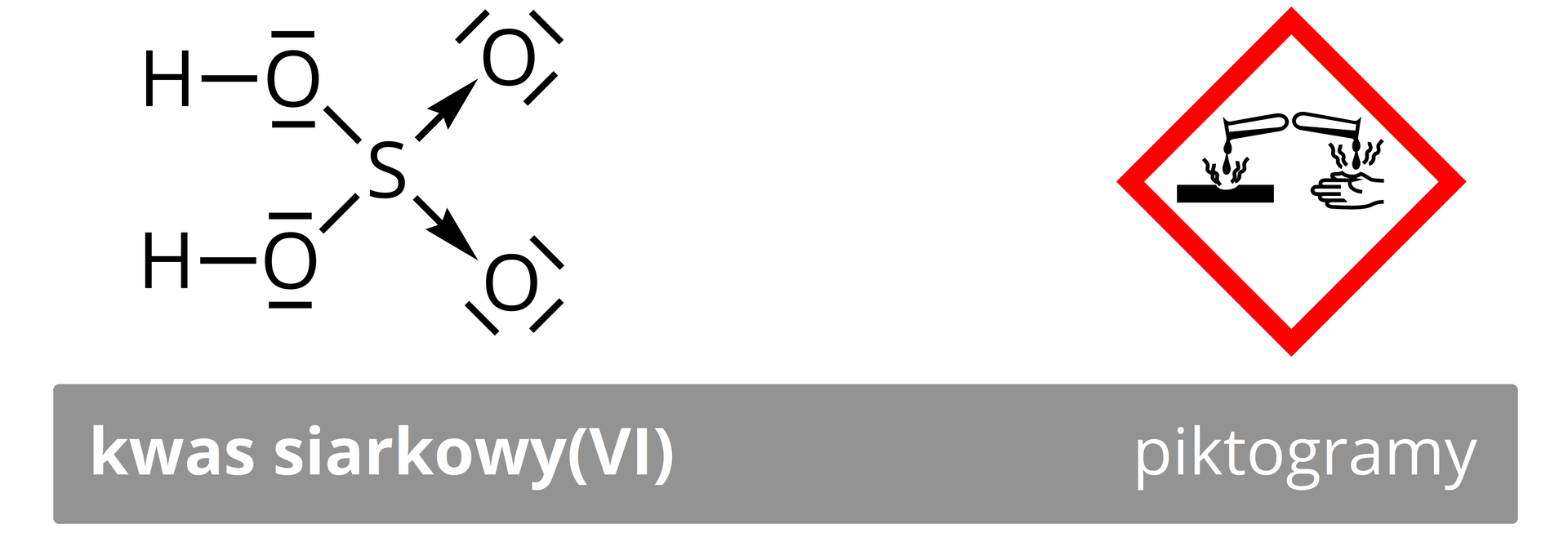
Kwas siarkowy() sprzedawany jest już jako wodny roztwór –, o gęstości (). Posiada liczne zastosowania w przeróżnych branżach przemysłowych, dlatego klasyfikuje się go jako substancję wielkotonażowąsubstancję wielkotonażową. Stosowany jest na szeroką skalę w branży chemicznej jako reagent wielu istotnych syntez (m.in.sulfonowaniesulfonowanie, nitrowanienitrowanie, utlenianie) oraz czynnik zapewniający odpowiednie warunki reakcji w produkcjach m.in. kwasów: chlorowodorowego (solnego), ortofosforowego(), azotowego(). Zastosowanie do produkcji kwasu ortofosforowego(), superfosfatówsuperfosfatów, fosforanu() i siarczanu() amonu sprawia, że jest on kluczowy w przemyśle nawozów sztucznych oraz detergentów (m.in. w produkcji laurylosiarczanu sodu). Ponadto stosuje się go w produkcji materiałów wybuchowych, ściślej do wyrobu trotylu (TNT). Ze względu na swoje właściwości higroskopijne, wykorzystywany jest w przemyśle petrochemicznym do osuszania nafty, parafiny i olejów, w przemyśle paliwowym jako katalizator w reakcji otrzymywania izooktanu, natomiast w górnictwie stosuje się go w procesach wzbogacania rud miedzi. Dodatkowo jest elektrolitem w akumulatorach kwasowo–ołowiowych, a także używa się go w produkcji leków (np. aspiryny), włókien sztucznych (np. jedwabiu). Ze względu na wymienione powyżej aspekty i fakt, że przeprowadzenie wielu procesów byłoby bez niego niemożliwe, określany jest mianem „krwi przemysłu chemicznego”.
Najczęstsze zastosowania kwasu siarkowego()
Poniżej przedstawiono galerię zdjęć z krótkimi informacjami dotyczącymi najczęstszych zastosowań kwasu siarkowego(). Na pierwszym z nich widać szkło laboratoryjne wypełnione przezroczystą cieczą. Od lewej strony stoi kolba stożkowa, dalej zlewka z bagietką, z tyłu duża kolba miarowa oraz mały cylinder miarowy, natomiast z przodu, po prawej stronie, mała kolba miarowa oraz dwie fiolki. Kolejna fotografia prezentuje zabudowę przemysłu petrochemicznego. Ostatnie zdjęcie przedstawia skrzydło samolotu, na którym znajdują się wyrzutnie z materiałami wybuchowymi.
Kwas azotowy()
Jest to jeden z najsilniejszych kwasów tlenowych, silny utleniacz. Jest bezbarwną cieczą, która powoduje żółte plamy i oparzenia w kontakcie ze skórą człowieka (reakcja ksantoproteinowareakcja ksantoproteinowa). Znajduje zastosowania w licznych branżach przemysłowych. Wodny roztwór kwasu azotowego(), , o stężeniu , ma gęstość ().
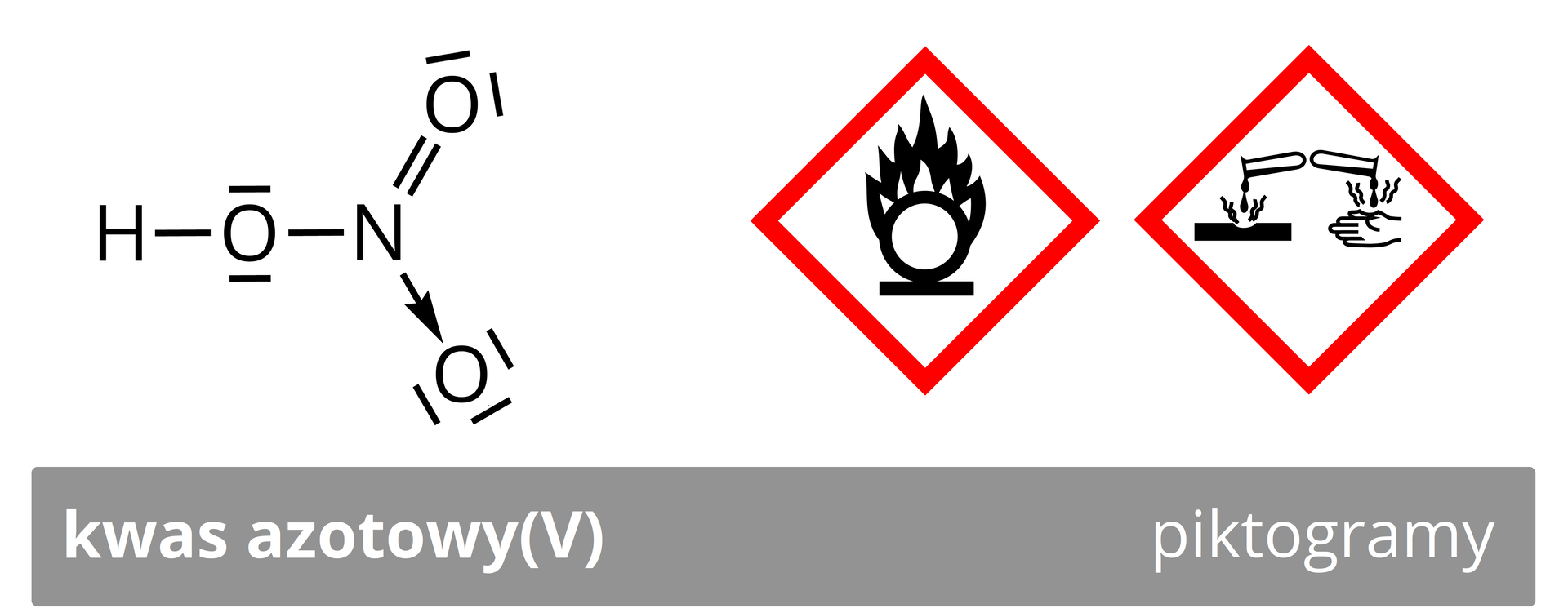
Zastosowanie kwasu azotowego()
Kwas chlorowodorowy – zastosowanie
Jest to silny kwas należący do grupy kwasów beztlenowych. Znajduje zastosowania w przeróżnych gałęziach przemysłu.
Zastosowanie innych kwasów tlenowych
Kwas ortofosforowy()
Kwas borowy
Kwas węglowy
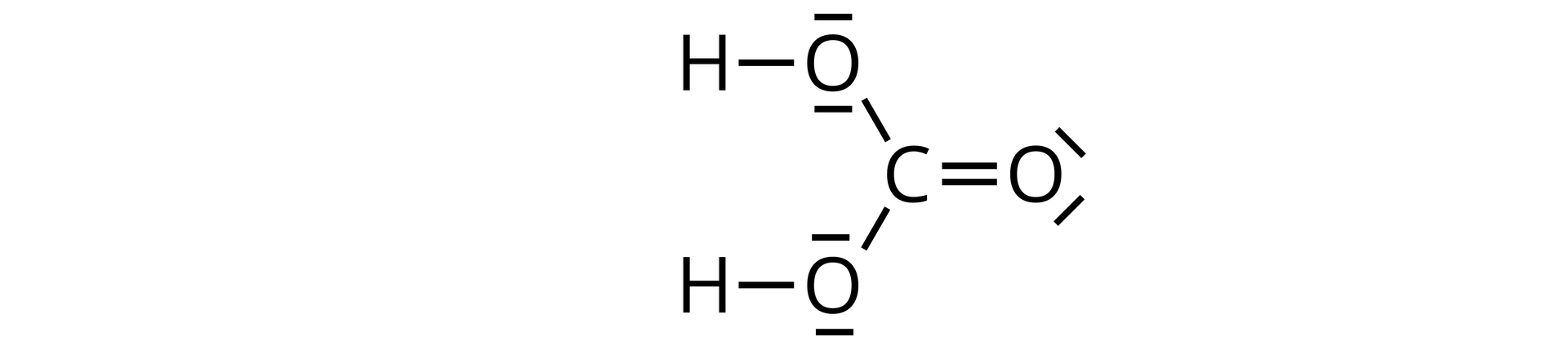

Kwas węglowy jest słabym i nietrwałym kwasem tlenowym, dlatego to sole kwasu węglowego oraz tlenek węgla() stosowane są w produkcji napojów gazowanych. Kwas węglowy przez lekko kwaśny posmak nadaje orzeźwiający smak napojom. Wykorzystywany jest w syntezie chemicznej do produkcji np. węglanów.
Zastosowanie innych kwasów beztlenowych
Zastosowanie przykładowych kwasów organicznych
Kwas octowy
Kwas benzenokarboksylowy
Kwas askorbinowy

Czy wiesz, że napój typu cola ma bardzo kwasowy odczyn? Jego kwasowość szacuje się na około w skali . Dla porównania, sok żołądkowy posiada około , a składa się głównie z kwasu chlorowodorowego. Ten popularny napój posiada aż dziesięć szkodliwych składników. A swoją kwasowość zawdzięcza kwasom: ortofosforowemu(), cytrynowemu i węglowemu. Kwas ortofosforowy() nie tylko równoważy słodki posmak napoju, ale również, jak dowodzą naukowcy, zmniejsza zawartość wapnia w kościach i podwaja ryzyko kamieni nerkowych. Natomiast kwas cytrynowy to popularny konserwant i wzmacniacz smaku.
Słownik
jest to wzór chemiczny, który podaje symbole pierwiastków oraz liczbę ich atomów tworzących dany związek chemiczny, określa skład jakościowy i ilościowy związku chemicznego
zgodnie z teorią Arrheniusa, jest to związek chemiczny ulegający w roztworze wodnym dysocjacji elektrolitycznej na jon wodoru. Ulega szybkiej reakcji z wodą, co skutkuje wytworzeniem jonu oksoniowego oraz anionu reszty kwasowej. Reakcji towarzyszy obniżenie roztworu
anion powstający w wyniku dysocjacji elektrolitycznej kwasu (zgodnie z teorią Arrheniusa) w roztworze wodnym
jest to związek chemiczny o charakterze kwasowym (zgodnie z teorią Arrheniusa), zbudowany z jednego atomu (lub atomów) wodoru i reszty kwasowej zawierającej atom (lub atomy) niemetalu i atom (lub atomy) tlenu
jest to związek chemiczny o charakterze kwasowym (zgodnie z teorią Arrheniusa), zbudowany z jednego atomu (lub atomów) wodoru i reszty kwasowej zawierającej atom (lub atomy) niemetalu
jest to organiczny związek chemiczny, który, zgodnie z teorią Arrheniusa, jest kwasem i ulega dysocjacji w środowisku wodnym z wytworzeniem jonów oksoniowych
substancja wytwarzana w ogromnych ilościach, np. setkach tysięcy lub milionach kilogramów
jest to reakcja charakterystyczna dla białek (dokładniej aminokwasów z pierścieniami aromatycznymi, tj. tryptofan, tyrozyna, fenyloalanina), które na skutek działania stężonego kwasu azotowego() przyjmują trwałe, żółte zabarwienie
jest to reakcja chemiczna, w wyniku której atom wodoru w związku organicznym ulega substytucji (wymianie) na grupę nitrową ()
jest to reakcja chemiczna, w wyniku której związek chemiczny ulega podstawieniu przez grupę sulfonową lub
jest to nawóz fosforowy, który składa się z (diwodorofosforanu wapnia)
otrzymywany w wyniku działania na fosforyty kwasem fosforowym:
Bibliografia
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.


