Przeczytaj
Stężenie ma znaczenie
Z pojęciem stężeniastężenia niejednokrotnie masz do czynienia w codziennym życiu. Stężenie procentowe oznacza stosunek masy substancji rozpuszczonej do masy całego roztworu, najczęściej wyrażony w skali procentowej. Przykładowo kupując sok, wybierasz ten z oznaczeniem stu procent danego owocu, sugerując się jego jakością.
Podobnie jest, gdy się skaleczysz, sięgasz wtedy po środek umożliwiający zdezynfekowanie rany. Najczęściej jest nim woda utleniona o stężeniu . Wielkość ta nie jest przypadkowa, ponieważ różne stężenia tej substancji mają inne zastosowania.
Idąc tym tropem, roztwór nadtlenku wodoru o stężeniach jest powszechnie używany w fryzjerstwie do rozjaśniania włosów. Znany jest również roztwór o stężeniu . Taki roztwór nadtlenku wodoru potocznie nazywany jest perhydrolem. Analogicznie do powyższych przykładów, to również jest bezbarwna oraz bezwonna ciecz, ale wykazująca żrące właściwości wobec tkanek żywych, w efekcie czego pozostawia martwicze białe plamy na skórze. Dlatego nie można jej stosować w celach dezynfekcyjnych jak wody utlenionej, lecz znajduje on zastosowanie jako silny utleniacz w przemyśle chemicznym.

Istnieją jeszcze bardziej stężone roztwory nadtlenku wodoru, o stężeniu , stosowane są jako utleniacze paliw rakietowych oraz paliw okrętów podwodnych. Pierwszy w historii rakietowy pocisk balistyczny – rakieta była napędzana na skutek reakcji roztworu nadtlenku wodoru z manganianem() potasu. Reakcja ta jest silnie egzotermiczna i powoduje wydzielanie znacznych ilości pary wodnej i tlenu. Powstałe ciśnienie tlenu napędzało turbopompę pompującą mieszaninę paliwową do komory spalania. Mieszanina paliwowa składała się z alkoholu etylowego z wodą oraz ciekłego tlenu.
Źródło: pinterest.com, licencja: domena publiczna
, roztwór nadtlenku wodoru Roztwory są zwykle stosowane jako wybielacz na bazie aktywnego tlenu w środkach chemii gospodarczej, roztwory są stosowane we fryzjerstwie do farbowania i rozjaśniania włosów. opis WCAGŹródło: pixabay.com, licencja: domena publiczna
, roztwór nadtlenku wodoru Stosowany jest jako środek wybielający oraz utleniacz. Używany jest także do oczyszczania kości z resztek tkanek miękkich (np. w celu wypreparowania trofeów myśliwskich). Występuje jako substancja czynna w produktach biobójczych i dezynfekcyjnych. opis WCAGBiałe plamy powstałe na skórze w wyniku kontaktu z perhydrolem.Źródło: he.wikipedia.org, licencja: domena publiczna, roztwór nadtlenku wodoru Roztwór ten stosowany jest jako utleniacz paliwa rakietowego i paliwa do okrętów podwodnych. opis WCAGRakieta V-2 w muzeum w Peenemünde.
Źródło: AElfwine, licencja: CC BY-SA 3.0, dostępny w internecie: uk.wikipedia.org
Morze Martwe (jezioro) w Izraelu otrzymuje wodę z kilku strumieni, ale nie ma odpływu. Z uwagi na nieprzerwane parowanie wody dochodzi do ciągłej koncentracji soli. Średnie zasolenie Morza Martwego wynosi w przybliżeniu – w porównaniu z zaledwie dla wody oceanicznej. Duże zasolenie sprawia, że woda nie nadaje się do zasiedlenia przez ryby, za to z wody pozyskuje się duże ilości soli sodowej i potasowej. Co ciekawe, duża koncentracja soli powoduje, że pływacy nie są w stanie zatopić się w morzu.
Stężenie procentowe
W celu poprawnego sporządzenia roztworu o żądanym stężeniu procentowym można skorzystać z prostych wzorów matematycznych. Dla przypomnienia:
wzór na stężenie procentowe:
wzór na przeliczanie stężeń molowych i procentowych:
Gdzie:
– masa substancji rozpuszczonej,
– masa roztworu (masa substancji rozpuszczonej + masa rozpuszczalnika),
– stężenie procentowe,
– stężenie molowe,
– gęstość roztworu,
– masa molowa.
Pamiętaj o uzgodnieniu jednostek! Jeżeli stężenie molowe wyrażone jest w molach na , to również gęstość powinna być wyrażona w jednostce masy na .
Wyprowadzenie wzoru za pomocą proporcji
Z definicji wiemy, że stężenie procentowe roztworu to masa substancji rozpuszczonej [] w rozpuszczalnika, wyrażona w procentach [].
– masa roztworu (masa substancji rozpuszczonej masa rozpuszczalnika)
Możemy więc zapisać to w następujący sposób:
Jeśli dodamy do proporcji masę substancji rozpuszczonej , to otrzymamy:
Znając zasady obliczania proporcji możemy wyprowadzić wzór:
Za pomocą metody proporcji lub wzoru w łatwy sposób można wykonać niezbędne obliczenia i na ich podstawie sporządzać roztwory o dowolnym stężeniu.
Jak w praktyce laboratoryjnej można przygotować roztworu o stężeniu . Ile gramów soli kuchennej (chlorku sodu, ) i ile wody należy użyć?
Zmiana stężenia procentowego roztworu
Istnieje kilka sposobów zmiany stężenia procentowego roztworu.
Zmiana | Efekt | Numer ćwiczenia |
|---|---|---|
Dodanie substancji rozpuszczonej | stężenie roztworu rośnie | Ćwiczenie |
Odparowanie rozpuszczalnika | stężenie roztworu rośnie | Ćwiczenie |
Dodanie rozpuszczalnika | stężenie roztworu zmniejsza się | Ćwiczenie |
Zmieszanie dwóch roztworów tej samej substancji o różnych stężeniach | stężenie jednego roztworu wzrośnie, drugiego zmaleje (ogólna wartość stężenia powstałego roztworu będzie pośrednia) | Ćwiczenie |
Jak zmieni się stężenie procentowe roztworu jeśli do roztworu o stężeniu dodano substancji?
W laboratorium chemicznym do dyspozycji uczniów było roztworu . Uczniowie mieli za zadanie otrzymać roztwór o stężeniu . Jak najłatwiej wykonać to zadanie?
Mieszanie i rozcieńczanie roztworów
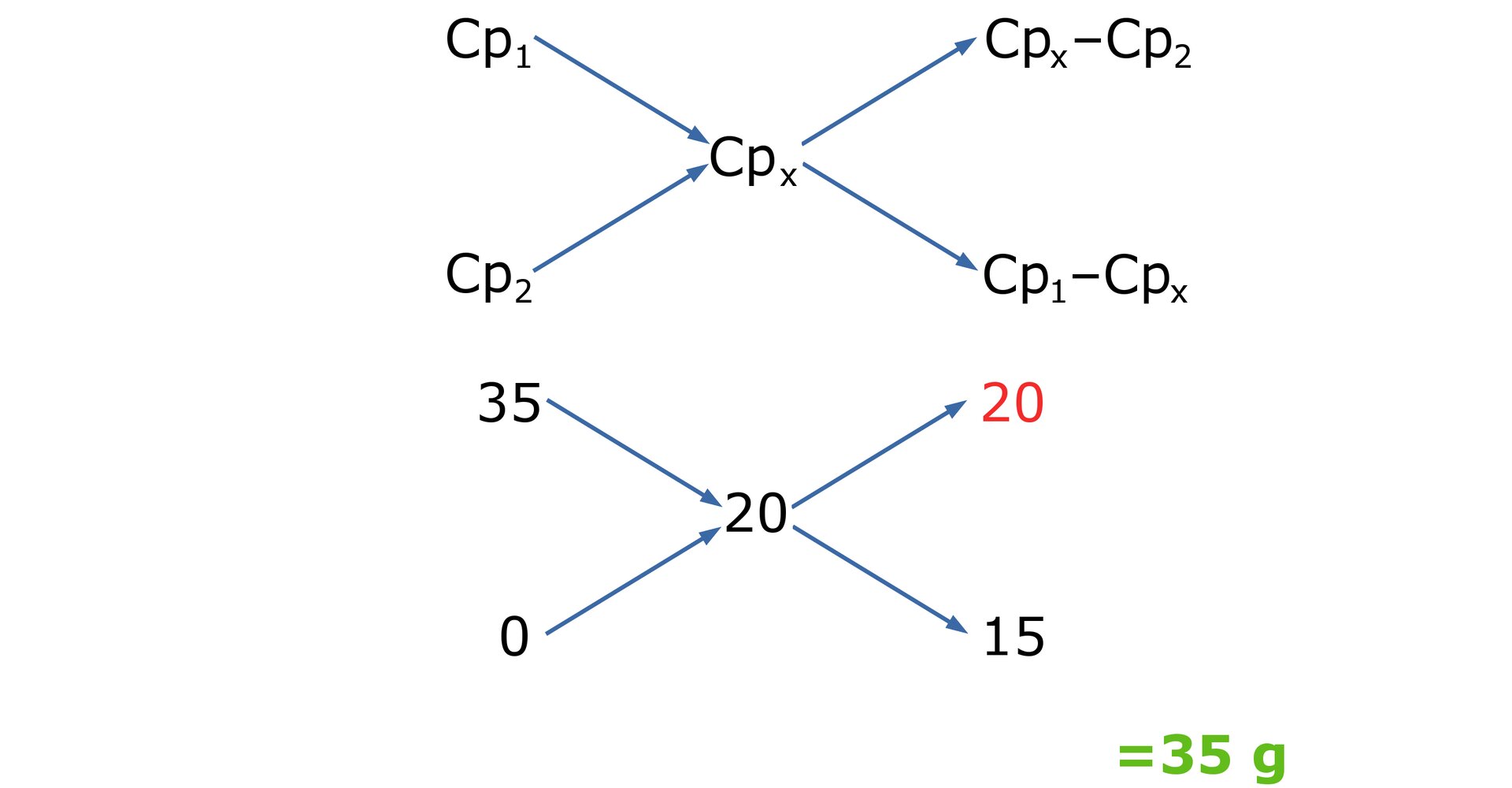
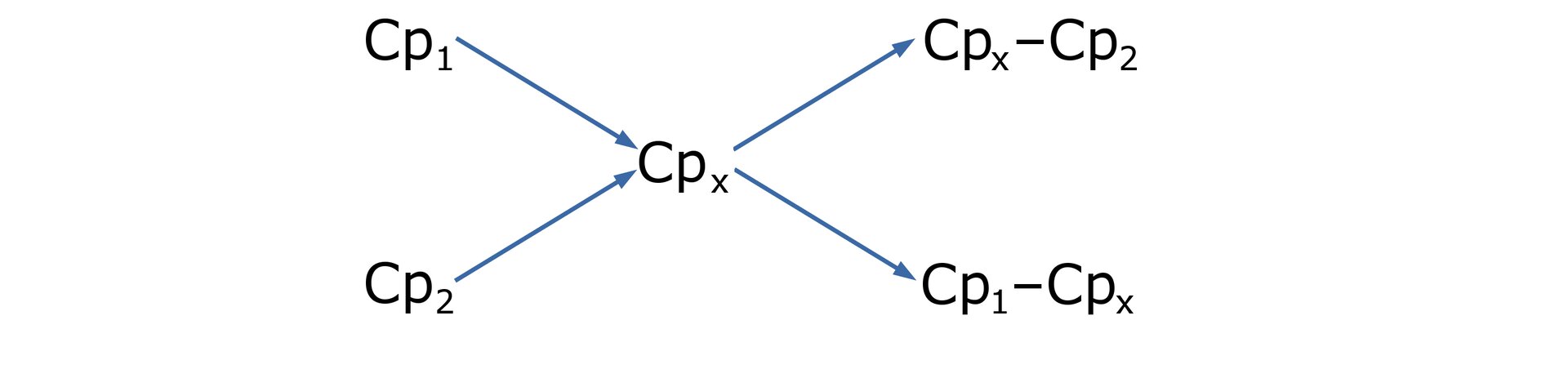
Obliczenia dotyczące mieszania lub rozcieńczania roztworów można wykonać stosując tzw. metodę krzyżową. Jeśli rozcieńczymy roztwór czystym rozpuszczalnikiem albo zmieszany dwa roztwory tej samej substancji o różnych stężeniach to otrzymamy nowy roztwór.
Opisz sposób przygotowania roztworu kwasu solnego, mając do dyspozycji butelkę kwasu solnego, którego stężenie procentowe wynosi . Na etykiecie butelki widnieją również informacje takie jak: , .
W jakim stosunku masowym należy zmieszać roztwór z roztworem tej samej substancji, aby otrzymać roztwór ?
Słownik
zmniejszać objętość roztworu przez odparowanie rozpuszczalnika
1. przemiana cieczy w parę,
2. wydzielać wodę w postaci pary
miara ilości substancji (indywiduum chemicznego) zawarta w mieszaninie
zmniejszać stężenie roztworu przez dodawanie rozpuszczalnika
rodzaj szklanego sprzętu laboratoryjnego, o kształcie okrągłego fragmentu sfery
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, Warszawa .
Galus Z., Ćwiczenia rachunkowe z chemii analitycznej, praca zbiorowa pod red. Z. Galusa , Warszawa .
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa .
Waller M., Królowe Anglii, tłum. E. Jaczewska, R. Januszewski, Warszawa .