Przeczytaj
I jak jeszcze mogę otrzymać sól?
Sole posiadają budowę jonową. Składają się z kationu (najczęściej metalu lub innych kationów, np. amonu , uranylu lub kationów organicznych typu , gdzie to np. , , a to dowolna grupa organiczna) i anionu reszty kwasowejreszty kwasowej. Aby otrzymać sól, potrzebujesz obu jonów. Zastanów się, z jakich związków możesz je pozyskać? W naszych rozważaniach pozostaniemy przy najbardziej typowych solach, w których kationem jest jon metalu.
Zapisując równanie reakcji, w której chcemy otrzymać sól zawierającą kation metalu, musimy się zastanowić, jakich substancji możemy użyć, aby w układzie reakcyjnym był obecny pożądany kation. Poniżej podano przykłady typów substancji chemicznych, jakich możemy ku temu użyć:
- Nazwa kategorii: kation metalu{id=1}{value=32}
- Nazwa kategorii: wodorotlenek{links=1}{value=20}
- Nazwa kategorii: NaOH{value=8}
- Nazwa kategorii: Ca(OH)[subscript]2[/]{value=8}
- Nazwa kategorii: KOH{value=8}
- Nazwa kategorii: Cu(OH)[subscript]2[/]{value=8}
- Nazwa kategorii: Mg(OH)[subscript]2[/]{value=8}
- Nazwa kategorii: Fe(OH)[subscript]2[/]{value=8}
- Nazwa kategorii: LiOH{value=8}
- Nazwa kategorii: Ba(OH)[subscript]2[/]{value=8}
- Nazwa kategorii: Zn(OH)[subscript]2[/]{value=8} Koniec elementów należących do kategorii wodorotlenek{links=1}{value=20}
- Nazwa kategorii: sól{links=1}{value=20}
- Nazwa kategorii: Na[subscript]2[/]SO[subscript]4[/]{value=8}
- Nazwa kategorii: AgNO[subscript]3[/]{value=8}
- Nazwa kategorii: CuSO[subscript]4[/]{value=8}
- Nazwa kategorii: BaCl[subscript]2[/]{value=8}
- Nazwa kategorii: CaCO[subscript]3[/]{value=8}
- Nazwa kategorii: K[subscript]2[/]CO[subscript]3[/]{value=8}
- Nazwa kategorii: NaCl{value=8}
- Nazwa kategorii: Na[subscript]2[/]S{value=8}
- Nazwa kategorii: CuCl[subscript]2[/]{value=8} Koniec elementów należących do kategorii sól{links=1}{value=20}
- Nazwa kategorii: tlenek metalu{links=1}{value=20}{color=#66CC99}
- Nazwa kategorii: K[subscript]2[/]O{value=8}
- Nazwa kategorii: MgO{value=8}
- Nazwa kategorii: CuO{value=8}
- Nazwa kategorii: Fe[subscript]2[/]O[subscript]3[/]{value=8}
- Nazwa kategorii: CaO{value=8}
- Nazwa kategorii: Li[subscript]2[/]O{value=8}
- Nazwa kategorii: Na[subscript]2[/]O{value=8} Koniec elementów należących do kategorii tlenek metalu{links=1}{value=20}{color=#66CC99}
- Nazwa kategorii: metal{links=1}{value=20}{color=#66CCCC}
- Nazwa kategorii: Mg{value=8}
- Nazwa kategorii: Zn{value=8}
- Nazwa kategorii: Al{value=8}
- Nazwa kategorii: Fe{value=8}
- Nazwa kategorii: Cu{value=8}
- Nazwa kategorii: Cr{value=8}
- Nazwa kategorii: Pb{value=8} Koniec elementów należących do kategorii metal{links=1}{value=20}{color=#66CCCC}
- Elementy należące do kategorii kation metalu{id=1}{value=32}
- Elementy należące do kategorii wodorotlenek{links=1}{value=20}
- Elementy należące do kategorii sól{links=1}{value=20}
- Elementy należące do kategorii tlenek metalu{links=1}{value=20}{color=#66CC99}
- Elementy należące do kategorii metal{links=1}{value=20}{color=#66CCCC}
Analogicznie, aby wprowadzić konkretny anion, możemy wybierać spośród substancji zebranych poniżej:
- Nazwa kategorii: anion reszty kwasowej
- Nazwa kategorii: niemetal
- Nazwa kategorii: S
- Nazwa kategorii: Cl
- Nazwa kategorii: I Koniec elementów należących do kategorii niemetal
- Nazwa kategorii: sól
- Nazwa kategorii: Na[baseline‑shift: sub; font‑size: smaller;]2[/]SO[baseline‑shift: sub; font‑size: smaller;]4[/]
- Nazwa kategorii: AgNO[baseline‑shift: sub; font‑size: smaller;]3[/]
- Nazwa kategorii: CuSO[baseline‑shift: sub; font‑size: smaller;]4[/]
- Nazwa kategorii: BaCl[baseline‑shift: sub; font‑size: smaller;]2[/]
- Nazwa kategorii: CaCO[baseline‑shift: sub; font‑size: smaller;]3[/]
- Nazwa kategorii: K[baseline‑shift: sub; font‑size: smaller;]2[/]CO[baseline‑shift: sub; font‑size: smaller;]3[/]
- Nazwa kategorii: NaCl
- Nazwa kategorii: Na[baseline‑shift: sub; font‑size: smaller;]2[/]S
- Nazwa kategorii: CuCl[baseline‑shift: sub; font‑size: smaller;]2[/] Koniec elementów należących do kategorii sól
- Nazwa kategorii: tlenek niemetalu
- Nazwa kategorii: CO[baseline‑shift: sub; font‑size: smaller;]2[/]
- Nazwa kategorii: SO[baseline‑shift: sub; font‑size: smaller;]2[/]
- Nazwa kategorii: Mn[baseline‑shift: sub; font‑size: smaller;]2[/]O[baseline‑shift: sub; font‑size: smaller;]7[/]
- Nazwa kategorii: P[baseline‑shift: sub; font‑size: smaller;]4[/]O[baseline‑shift: sub; font‑size: smaller;]10[/]
- Nazwa kategorii: Cl[baseline‑shift: sub; font‑size: smaller;]2[/]O[baseline‑shift: sub; font‑size: smaller;]5[/]
- Nazwa kategorii: N[baseline‑shift: sub; font‑size: smaller;]2[/]O[baseline‑shift: sub; font‑size: smaller;]5[/] Koniec elementów należących do kategorii tlenek niemetalu
- Nazwa kategorii: kwas
- Nazwa kategorii: HCl
- Nazwa kategorii: H[baseline‑shift: sub; font‑size: smaller;]2[/]SO[baseline‑shift: sub; font‑size: smaller;]4[/]
- Nazwa kategorii: HNO[baseline‑shift: sub; font‑size: smaller;]3[/]
- Nazwa kategorii: CH[baseline‑shift: sub; font‑size: smaller;]3[/]COOH Koniec elementów należących do kategorii kwas
- Elementy należące do kategorii anion reszty kwasowej
- Elementy należące do kategorii niemetal
- Elementy należące do kategorii sól
- Elementy należące do kategorii tlenek niemetalu
- Elementy należące do kategorii kwas
Przykłady kationów metali i anionów reszt kwasowych wchodzących w skład związków, jakimi są sole
Jeżeli połączysz 2 poprzednie mapy, otrzymasz 10 metod otrzymywania soli – ale pamiętaj, metody te mają swoje ograniczenia! Nie każdą z nich można otrzymać każdą z soli.
Reakcja z – w wyniku tej reakcji otrzymasz sól i wodór. Wodór opuszcza środowisko reakcji. Przykładowe równania reakcji:
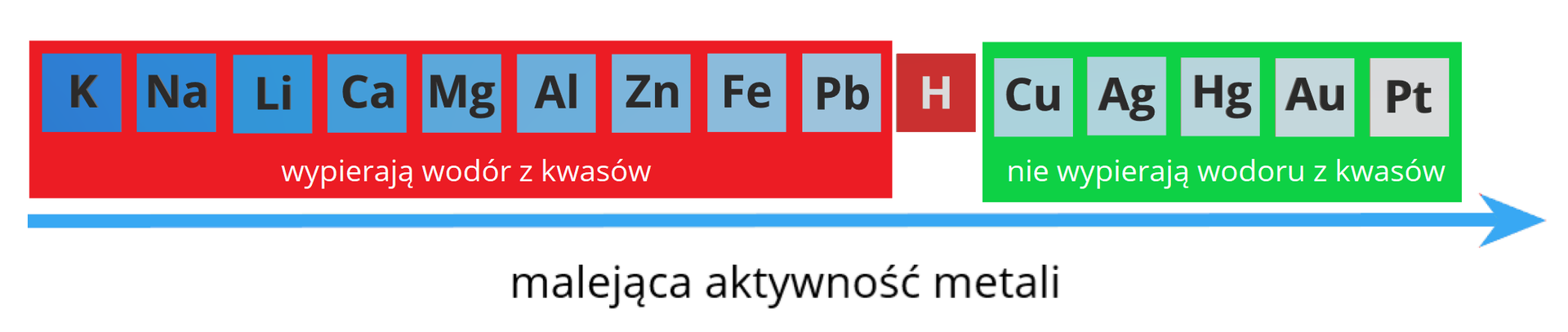
Reakcji z wydzieleniem wodoru będą ulegały tylko metale o ujemnych wartościach potencjału. Pozostałe metale nie wypierają wodoru z kwasów. , , i mogą jednak reagować ze stężonym, gorącym kwasem siarkowym(VI) oraz z rozcieńczonym i stężonym kwasem azotowym(V). W reakcjach tych nie powstaje jednak wodór, ale odpowiednie tlenki
Inne metale, takie jak np. żelazo, również mogą reagować z kwasami silnie utleniającymi bez wydzielenia wodoru, np.:
Reakcje te przebiegają w dwóch etapach:
Etap 1: metal utlenia się do swojego tlenku;
Etap 2: tlenek metalu reaguje z kwasem, dając odpowiednią sól. Dlatego też metale ulegające pasywacjipasywacji, nie roztwarzająroztwarzają się w stężonym kwasie azotowym. Do takich przypadków należą: glin, chrom, żelazo oraz kobalt, nikiel i molibden. W rozcieńczonym roztworze pasywacja zachodzi w dużo mniejszym stopniu i roztworzenie metalu staje się bardziej prawdopodobne.

Reakcja z bądź z – w wyniku reakcji powstaje sól i woda. Przykładowe równania reakcji:
Skutecznym produktem usuwającym rdzę jest... Cola! Wystarczy zanurzyć w niej przedmiot ze śladami rdzy na kilka minut, a następnie dokładnie wyszorować, umyć i osuszyć. Dzieje się tak za sprawą obecnego w niej kwasu ortofosforowego, który reaguje z rdzą (tlenkami żelaza).
Reakcja z – w jej wyniku powstaje sól i woda. Jest to najbardziej uniwersalna metoda otrzymywania soli. Przykładowe równania reakcji:
Reakcja z . W reakcji tej otrzymać można tylko sole kwasów tlenowychkwasów tlenowych. Przykładowe równania reakcji:
Reakcja z . W wyniku reakcji powstaje sól – tylko otrzymywanie soli kwasów tlenowych. Przykładowe równania reakcji:
Reakcja z , w wyniku której powstaje sól – tylko otrzymywanie soli kwasów beztlenowychkwasów beztlenowych. Przykładowe równania reakcji:
Kolejne reakcje typu 7‑12 zachodzą tylko w specyficznych warunkach.
Reakcja i rozpuszczalnej w wodzie mniej aktywnego metalu. Powstaje inna sól i inny metal (mówimy wtedy o wypieraniu metalu z roztworu jego soli). Przykładowe równania reakcji:
Reakcja z , podczas której powstaje inna sól i inny kwas. Zachodzi, gdy powstała sól jest solą trudno rozpuszczalną w wodzie lub gdy sól biorąca udział w reakcji jest solą słabego kwasusłabego kwasu i reaguje z mocnym kwasemmocnym kwasem. Przykładowe równania reakcji:
Reakcja i , podczas której powstają inna sól i inny wodorotlenek. Reakcja zachodzi w przypadku, gdy wszystkie substraty są rozpuszczalne, natomiast jeden z produktów – sól lub wodorotlenek – jest trudno rozpuszczalny. Przykładowe równania reakcji:
Reakcje między dwiema solami – zachodzą one wówczas, gdy powstają sole trudniej rozpuszczalne od soli stanowiących substraty tych reakcji. Ponadto, substratami mogą być jedynie dobrze rozpuszczalne sole. Przykładowe równania reakcji:
Jak nazywamy metale, które nie wypierają wodoru z kwasów?
Umiejętność pisania równań reakcji typu 7 wymaga umiejętności korzystania z szeregu aktywności metali:
Umiejętność pisania równań reakcji typu 8‑10 wymaga znajomości rozpuszczalności poszczególnych związków w wodzie. W tym celu możesz wykorzystać tabelę rozpuszczalności:
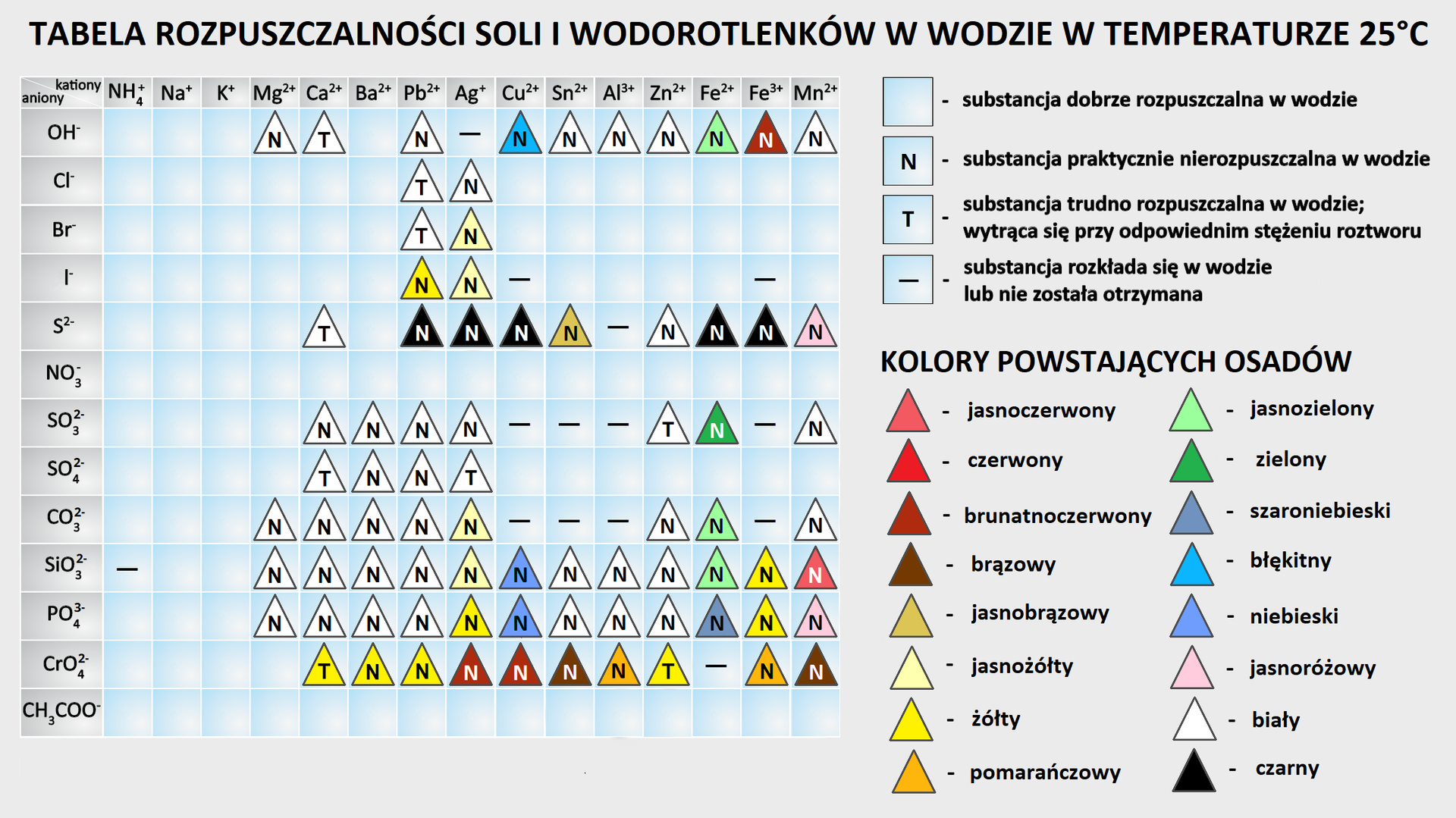
lub zapamiętać wynikające z niej reguły dla popularnych soli:
dobrze rozpuszczalne są sole litowców (sodu, potasu) i amonu;
dobrze rozpuszczalne są azotany, etaniany (octany) i chlorany;
większość siarczanów należy do dobrze rozpuszczalnych (wyjątkami są: , , );
do trudno rozpuszczalnych należą i ;
większość chlorków, bromków i jodków jest dobrze rozpuszczalna z wyjątkiem soli , i ;
większość siarczków metali jest trudno rozpuszczalna (dobrze rozpuszczalne są siarczki litowców, berylowców i amonu);
większość węglanów i ortofosforanów jest trudno rozpuszczalna, dobrze rozpuszczalne są węglany i ortofosforany litowców i amonu.
Umiejętność pisania i uzgadniania równań reakcji jest niezbędna w tzw. analizie chemicznej.
Słownik
nazwa fragmentu cząsteczki kwasu powstałego po oderwaniu się od kwasu w wyniku dysocjacji elektrolitycznej jednego lub więcej kationów wodoru
zwyczajowa nazwa metali odpornych chemicznie, do których zazwyczaj zalicza się platynowce (ruten, rod, pallad, osm, iryd i platynę) oraz dwa metale z grupy miedziowców: srebro i złoto, czasem także miedź, rtęć i ren
kwasy, które mają silne właściwości utleniające, np. rozc. i stęż. , rozc. i stęż. , stęż.
część reakcji redoks (utleniania i redukcji); podczas reakcji redukcji atom lub jon przechodzi z wyższego stopnia utlenienia na niższy
proces pokrywania powierzchni ściśle przylegającą warstwą niereaktywnego tlenku, co zabezpiecza warstwy niżej położone przed kontaktem z substancją reagującą
reakcja chemiczna polegająca na przechodzeniu substancji stałej do roztworu
tlenki, które reagują z kwasami, ale nie reagują z zasadami
tlenki, które reagują z zasadami, ale nie reagują z kwasami
zawierają w swojej reszcie kwasowej tlen
nie zawierają w swojej reszcie kwasowej tlenu
w warunkach normalnych wypiera wodór z wody (litowce i berylowce poza berylem)
ulegają dysocjacji w mniejszym stopniu niż mocne kwasy; do kwasów słabych zaliczamy np: , ,
całkowicie lub prawie całkowicie zdysocjowane w wodnym roztworze, np.: , , , , , ,
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2002, wyd. 5.
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2020.
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.