Przeczytaj
Właściwości redukujące monosacharydów
Monosacharydy mogą występować w formie łańcuchowej lub cyklicznej (pierścieniowej). Forma pierścieniowa może powstawać dzięki wewnętrznej cyklizacji, prowadzącej do utworzenia hemiacetalu. W warunkach próby Tollensapróby Tollensa i TrommeraTrommera dominującą formą jest forma łańcuchowa monosacharydu. Ze względu na obecność grupy aldehydowej lub karbonylowej w cząsteczce monosacharydu, monosacharydy wykazują właściwości redukującewłaściwości redukujące, czyli w odpowiednich warunkach utleniają się, redukując inny związek chemiczny.
Aldozy, podobnie jak inne aldehydy, redukują odczynnik Tollensa i Trommera, co przedstawiono na przykładzie glukozy.
- zapis cząsteczkowy przebiegającej reakcji chemicznej: Ilustracja przedstawiająca schemat reakcji zachodzącej podczas próby Tollensa z udziałem glukozy. Cząsteczka glukozy o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe do niej linie. Po prawej stronie linii od góry kolejno podstawniki: , H, oraz . Po lewej stronie od góry podstawniki H, , H oraz H. Dodać dwie cząsteczki , dodać trzy cząsteczki wodorotlenku sodu . Strzałka w prawo, nad strzałką zapis "ogrzewanie", za strzałką produkty. Glukonian sodu o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie głównej linii od góry kolejno podstawniki: , H, oraz . Po lewej stronie od góry podstawniki H, , H oraz H. Dodać dwa atomy srebra, dodać cztery cząsteczki amoniaku , dodać dwie cząsteczki wody .
- zapis jonowy skrócony przebiegającej reakcji chemicznej: Ilustracja przedstawiająca schemat reakcji zachodzącej podczas próby Tollensa z udziałem glukozy. Cząsteczka glukozy o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie linii od góry kolejno podstawniki: , , oraz . Po lewej stronie od góry podstawniki , , oraz . Dodać dwa kationy , dodać trzy aniony hydroksylowe . Strzałka w prawo, nad strzałką zapis "ogrzewanie", za strzałką produkty. Anion kwasu glukonowego o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie linii od góry kolejno podstawniki: , , oraz . Po lewej stronie od góry podstawniki , , oraz . Dodać dwa atomy srebra, dodać cztery cząsteczki amoniaku , dodać dwie cząsteczki wody .
- uproszczony zapis cząsteczkowy przebiegającej reakcji chemicznej: Ilustracja przedstawiająca uproszczony schemat reakcji zachodzącej podczas próby Tollensa z udziałem glukozy. Cząsteczka glukozy o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie linii od góry kolejno podstawniki: , , oraz . Po lewej stronie od góry podstawniki , , oraz . Dodać . Strzałka w prawo, nad strzałką zapis "ogrzewanie", za strzałką produkty. Kwas glukonowy o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie linii od góry kolejno podstawniki: , , oraz . Po lewej stronie od góry podstawniki , , oraz . Dodać dwa atomy srebra.
W powyższej reakcji nastąpiło utlenienie atomu węgla w grupie aldehydowej glukozy (stopień utlenienia: ) do atomu węgla w zdeprotonowanej grupie karboksylowej (stopień utlenienia: ) oraz redukcja kationu srebra() z kationu diaminasrebra() (stopień utlenienia: ) do srebra (stopień utlenienia: ).
Gdy w wyniku próby Tollensa (próby lustra srebrowego) na ściankach probówki osadza się srebro w postaci lustra, mówimy o pozytywnym wyniku próby Tollensa, a badany cukier ma właściwości redukujące.
- zapis cząsteczkowy przebiegającej reakcji chemicznej: Ilustracja przedstawiająca schemat reakcji zachodzącej podczas próby Trommera dla glukozy. Cząsteczka glukozy o następującym wzorze Fischera: grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie linii od góry kolejno podstawniki: , , oraz . Po lewej stronie od góry podstawniki , , oraz . Dodać dwie cząsteczki wodorotlenku miedzi(). Strzałka w prawo, nad strzałką zapis "ogrzewanie", za strzałką cząsteczka produktu w projekcji Fischera, którą stanowi grupa połączona z pionową linią skierowaną do dołu, która symbolizuje łańcuch węglowy i na końcu łączy się z grupą . Wspomnianą linię przecinają cztery krótkie poziome, prostopadłe linie. Po prawej stronie linii od góry kolejno podstawniki: , , oraz . Po lewej stronie od góry podstawniki , , oraz . Dodać cząsteczka tlenku miedzi() przy niej strzałka w dół oznaczająca wytrącenie osadu. Dodać dwie cząsteczki wody .
W powyższej reakcji nastąpiło utlenienie atomu węgla w grupie aldehydowej glukozy (stopień utlenienia: ) do atomu węgla w grupie karboksylowej (stopień utlenienia: ) oraz redukcja kationu miedzi() w wodorotlenku miedzi() (stopień utlenienia: ) do kationu miedzi() w tlenku miedzi() (stopień utlenienia: ).
Gdy w wyniku próby Trommera nastąpi zmiana zabarwienia niebieskiego, galaretowatego osadu na ceglastoczerwony osad, mówimy o pozytywnym wyniku próby Trommera, a badany cukier ma właściwości redukujące.
W przypadku negatywnego wyniku próby Trommera, powstałby czarny osad w wyniku ogrzewania osadu powstającego w reakcji:
Ketozy
Ketozy również ulegają próbie Tollensa i Trommera, dając wynik pozytywny. Świadczy to o ich właściwościach redukujących, pomimo że ketony dają negatywny wynik tych prób. Ketozy w środowisku zasadowym (jaki panuje w przypadku próby Tollensa i Trommera) przekształcają się w aldozy, ponieważ atom wodoru może migrować od pierwszego do drugiego atomu węgla – tautomeria keto–enolowa (poprzez nietrwałą formę enolową):

Przykładowo, w przypadku fruktozy zachodzi enolizacja, skutkiem czego powstaje forma typu enodiolenodiol, która przekształca się do mieszaniny aldoz (glukozy i mannozy):

W związku z przekształcaniem się ketoz w aldozy w środowisku próby Tollensa i Trommera, zarówno ketozy, jak i aldozy dają ich pozytywne wyniki. Zatem wszystkie monosacharydy posiadają właściwości redukujące.
Właściwości redukujące disacharydów
Maltoza
Anomeryczny atom węgla w maltozie posiada grupę hydroksylową, dzięki czemu pierścień może „otworzyć się”, tworząc grupę aldehydową, co zapewnia właściwości redukujące w warunkach próby Tollensa i Trommera. Trwalsza od formy cyklicznej jest forma łańcuchowa.

Celobioza
Celobioza ulega próbie Tollensa i Trommera, ponieważ anomeryczny atom węgla w celobiozie posiada grupę hydroksylową, dzięki czemu pierścień może „otworzyć się”, tworząc grupę aldehydową, co zapewnia właściwości redukujące w warunkach próby Tollensa i Trommera. Trwalsza od formy cyklicznej jest forma łańcuchowa.

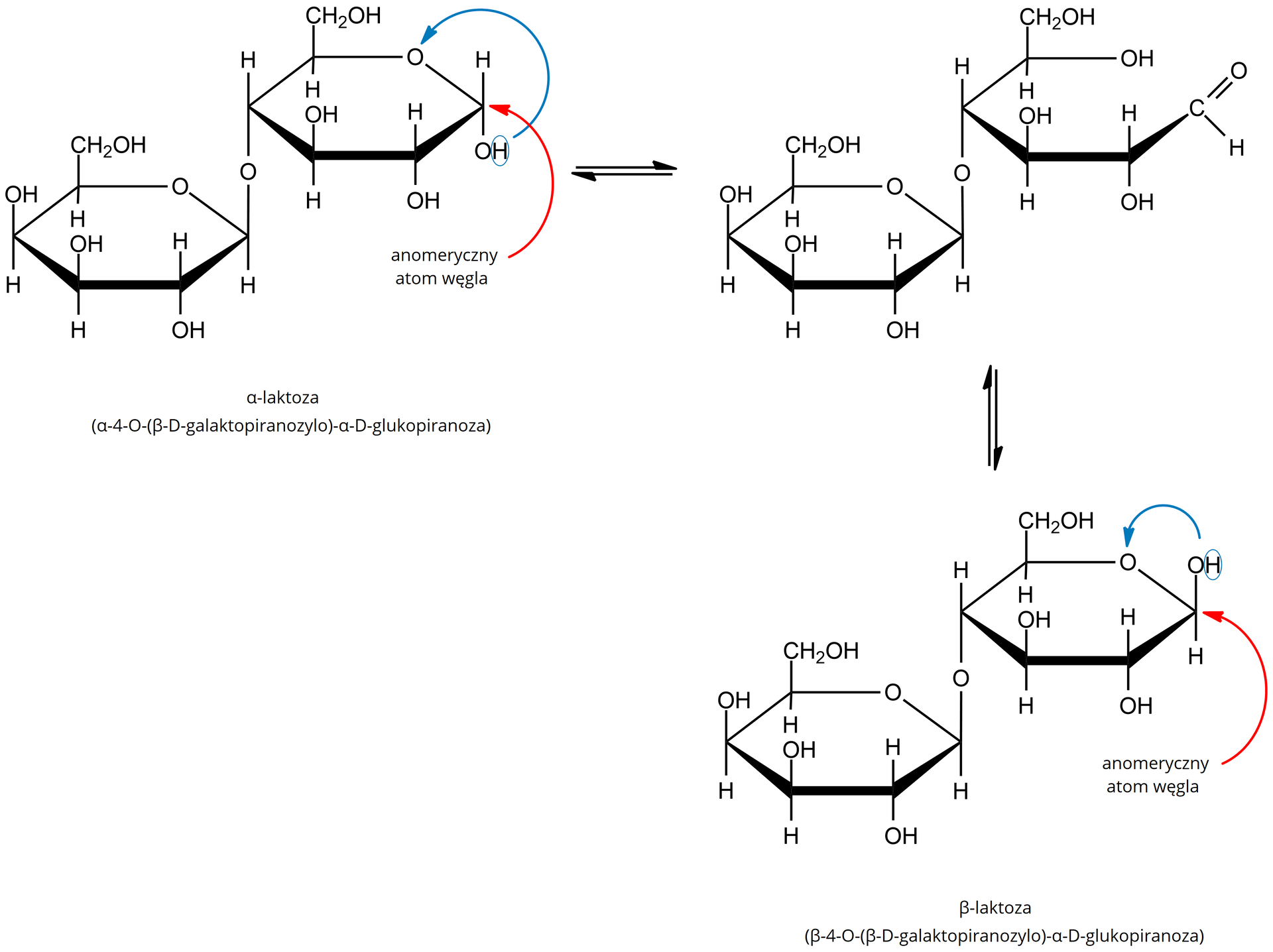
Laktoza
Laktoza ulega próbie Tollensa i Trommera, ponieważ anomeryczny atom węgla w laktozie posiada grupę hydroksylową, dzięki czemu pierścień może „otworzyć się”, tworząc grupę aldehydową, co zapewnia właściwości redukujące w warunkach próby Tollensa i Trommera. Trwalsza od formy cyklicznej jest forma łańcuchowa.
Sacharoza
Sacharoza nie ulega próbie Tollensa i Trommera, ponieważ nie posiada grupy hydroksylowej przy żadnym z anomerycznych atomów węgla, co uniemożliwia w warunkach tych prób „otwarcie” pierścienia i utworzenie grupy aldehydowej. Obie grupy hydroksylowe przy anomerycznych atomach węgla zostały wykorzystane do utworzenia wiązania –glikozydowego. W związku z powyższym, sacharoza nie posiada właściwości redukujących.

W środowisku kwasowym lub pod wpływem enzymów wynik próby Trommera jest jednak pozytywny. W środowisku kwasowym następuje hydroliza wiązania glikozydowego i powstaje równomolowa mieszanina ––glukozy i ––fruktozy (cukier inwertowany).
Właściwości redukujące polisacharydów
Skrobia i celuloza to polimery składające się z ogromnej liczby pierścieni glukozowych, połączonych ze sobą wiązaniami O-glikozydowymi. Anomeryczny atom węgla z grupą hydroksylową znajduje się tylko na jednym końcu łańcucha, co wobec jego długości nie ma wpływu na właściwości policząsteczki. W związku z tym skrobia i celuloza nie posiadają właściwości redukujących.
Słownik
właściwość substancji polegająca na możliwości utlenienia się w odpowiednich warunkach
cząsteczka zawierająca dwie grupy hydroksylowe przyłączone do atomów węgla, połączonych wiązaniem podwójnym
reakcja z wykorzystaniem świeżo strąconego wodorotlenku miedzi(); cukry redukujące dają pozytywny wynik próby Trommera – po ogrzaniu pojawia się ceglastoczerwony osad ; cukry nieredukujące dają wynik negatywny – po ogrzaniu pojawia się czarny osad , będący wynikiem rozkładu
reakcja lustra srebrnego; reakcja z wykorzystaniem świeżo sporządzonego roztworu z wodą amoniakalną („srebro amoniakalne“), gdzie srebro występuje w postaci wodorotlenku diaminasrebra(), ; cukry redukujące dają po ogrzaniu srebrną powłokę na ściankach naczynia
Odczynnik Tollensa należy przechowywać w szczelnie zamkniętych opakowaniach, w chłodnym i suchym miejscu. Pomieszczenie, w którym przechowywany jest odczynnik Tollensa, powinno być dobrze wentylowane i wyposażone w instalacje elektryczną i wentylację przeciwwybuchową, ponieważ rozkłada się on z upływem czasu, dając związki o właściwościach wybuchowych.
Bibliografia
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura. Vademecum, Warszawa 2015.
Kaznowski K., Chemia Vademecum maturalne, Warszawa 2016.
Litwin M., Styka‑Wlazło S., Szymońska J., To jest chemia 2, Warszawa 2016.
McMurry J., Chemia organiczna, t. 4, tłum. Henryk Koroniak i in., Warszawa 2018.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, tłum. Wiesław Antkowiak i in., Warszawa 1985.