Przeczytaj
Indeks dolny Źródło: domena publiczna, [online], dostępny w internecie: www.pixabay.com Indeks dolny koniecŹródło: domena publiczna, [online], dostępny w internecie: www.pixabay.com
Czym jest grawimetria?
GrawimetriaGrawimetria (analiza wagowa) jest metodą analityczną, polegającą na przekształceniu oznaczanej substancji (analituanalitu) w postać o ściśle określonym składzie chemicznym.
Metoda ta pozwala odpowiedzieć na pytania:
Jakie jest stężenie lub masa oznaczanego składnika (analitu) w próbce?
Jaka jest czystość próbki?
Podział metod grawimetrycznych
Z uwagi na sposób postępowania z badaną próbką, wyróżnia się dwa rodzaje analizy grawimetrycznej:
Jons Jacob Berzelius (1779‑1848), uważany za wiodącego chemika swoich czasów, opracował wiele aparatów i wiele technik XIX‑wiecznej chemii analitycznej. Przykłady obejmują m.in. zastosowanie bezpopiołowej bibuły filtracyjnej w grawimetrii.

Mnożnik analityczny
Istotnym pojęciem w analizie wagowej jest mnożnik analitycznymnożnik analityczny (oznaczany symbolem , co z niemieckiego oznacza „faktor”).
Mnożnik analityczny wyraża się stosunkiem wagowym masy molowej oznaczanego składnika do masy molowej związku, w postaci którego składnik został wagowo oznaczony.
Aby obliczyć masę oznaczanego składnika , należy pomnożyć masę otrzymanego osadu przez mnożnik analityczny .
– masa osadu
– mnożnik analityczny
Często zawartość oznaczanego składnika wyraża się w procentach:
– masa oznaczanego osadu w gramach
– masa odważki analizowanej substancji w gramach
Na przykład, chcąc obliczyć masę siarczanu(VI) wapnia w próbce dihydratu siarczanu(VI) wapnia, obliczamy mnożnik analityczny w następujący sposób:
Mnożniki analityczne dla konkretnych substancji są zgromadzone w tabelach i pozwalają na szybkie obliczenie masy składnika w zważonym osadzie.
Grawimetria strąceniowa
Aby wyznaczyć zawartość jonów niklu(II) w roztworze, można wykorzystać metodą grawimetrii strąceniowej. Nikiel(II) tworzy czerwony osad kompleksu chelatowego z dimetyloglioksymem (zwanym też odczynnikiem Czugajewa o wzorze sumarycznym ) w pH ustalonym w granicach 5 do 9 za pomocą buforu amonowego. Reakcja ta jest zilustrowana poniżej:
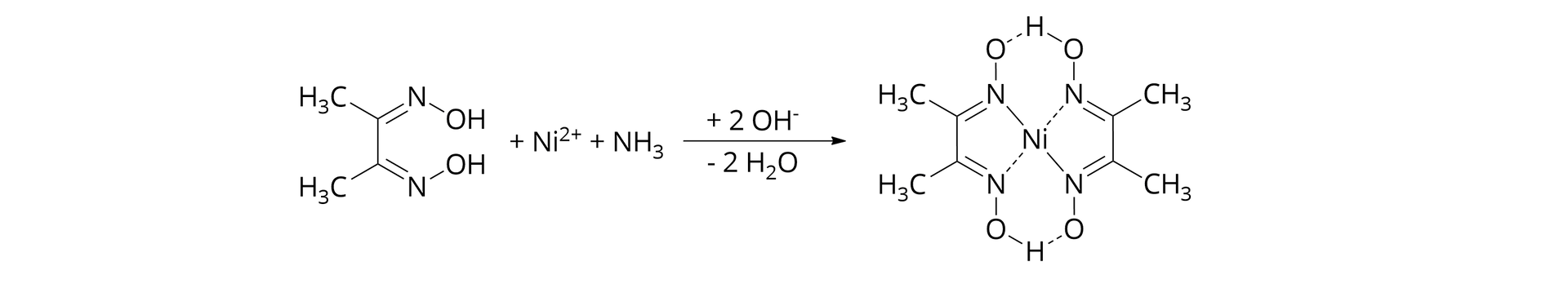

Procedura oznaczania jonów niklu(II) w roztworze w postaci dimetyloglioksymu niklu(II) :
Należy dokładnie wysuszyć w eksykatorze sączek ze spiekiem, a następnie go zważyć.
Do zlewki dodaje się rozcieńczoną próbkę, która zawiera nikiel(II) z dodatkiem niewielkiej ilości kwasu chlorowodorowego .
Następnie dodaje się alkoholowy roztwór dimetyloglioksymu.
W kolejnym etapie dolewa się wodę amoniakalną aż do tego momentu, gdy zapach amoniaku będzie wyczuwalny. Wytrąca się czerwonoróżowy osad dimetyloglioksymu niklu(II) .
Osad odsącza się na wcześniej wysuszonym sączku ze spiekiem, następnie suszy się go i waży, a następnie oblicza się masę powstałego osadu.
Oblicza się mnożnik analityczny, a następnie masę jonów niklu(II) w otrzymanym osadzie.
Mnożnik analityczny w tym wypadku wynosi:
Zatem, aby obliczyć masę niklu(II) obecnego w roztworze pierwotnym, należy pomnożyć masę otrzymanego osadu dimetyloglioksymu niklu(II) przez 0,203.
Gawimetria grawitacyjna (ulatniania)
Grawimetrię grawitacyjną można wykorzystać do określenia czystości związku. Jeśli próbka węglanu wapnia została zanieczyszczona nieznaną ilością siarczanu(VI) magnezu , możemy obliczyć pierwotną masę węglanu wapnia.
Załóżmy, że zanieczyszczona próbka ma masę 10 g. Próbkę podgrzewamy w piecu, aby węglan wapnia uległ rozkładowi zgodnie z równaniem:
Tlenek węgla(IV) ulatuje z próbki. Po ogrzaniu próbka ma masę 9,32 g.
W pierwszym kroku obliczmy ubytek masy:
Z tego równania wynika, że masa usuniętego tlenku węgla(IV) wynosi 0,68 g. Obliczmy zatem liczbę moli :
Liczba moli tlenku węgla(IV) wynosi 0,015 mola. Na podstawie zapisanego powyżej równania reakcji można wywnioskować, że z jednego mola węglanu wapnia powstaje jeden mol tlenku węgla(IV), zatem liczba moli węglanu wapnia w pierwotnej próbce wynosiła również 0,015 mola.
Obliczmy zatem masę węglanu wapnia w próbce przed ogrzaniem.
Z obliczeń wynika, że masa węglanu wapnia w zanieczyszczonej próbce wynosiła 1,50 g. Tę wartość można przedstawić również w procentach:
Zatem węglan wapnia stanowił 15% pierwotnej próbki.
Słownik
(łac. gravis „ciężki” gr. metréō „mierzę”) analiza wagowa, jedna z metod ilościowej analizy chemicznej, która polega na wyznaczeniu masy analitu w materiale po przeprowadzeniu go w związek o ściśle określonym składzie chemicznym
reakcja zachodząca pomiędzy określonymi jonami, w wyniku której wytrąca się osad
substancja, składnik oznaczany w próbce analitycznej
faktor, wyraża stosunek wagowy masy molowej oznaczanego składnika do masy molowej związku, w postaci którego składnik został wagowo oznaczony
Bibliografia
Lipiec T., Szmal Z., Chemia analityczna z elementami analizy instrumentalnej, Warszawa 1980.
Minczewski J., Marczenko Z., Chemia analityczna. T.2. Chemiczne metody analizy ilościowej, Warszawa 2011, wyd. 10.
Rubel S., Pracownia Chemiczna. Analiza ilościowa, Warszawa 1999.
