Przeczytaj
AlkoholeAlkohole i fenolefenole to związki, w których cząsteczkach występuje grupa hydroksylowa
(), przyłączona do atomu węgla. Różnica polega na tym, że w alkoholach atom węgla buduje alifatyczny łańcuch węglowy, a jego orbitalom atomowym przypisuje się stan hybrydyzacji . W fenolach natomiast, atom węgla, związany z grupą hydroksylową, buduje pierścień aromatyczny. Stan hybrydyzacji orbitali atomowych tego atomu węgla to zatem . Schematycznie alkohole i fenole oznacza się odpowiednio jako: oraz , gdzie to łańcuch węglowodorowy, a to pierścień aromatyczny. Aby odróżnić alkohole od fenoli, stosuje się szereg metod, z którymi zapoznasz się w tym materiale.
Sprawdzanie odczynu
Alkohole nie ulegają dysocjacji elektrolitycznej pod wpływem wody – odczyn ich wodnego roztworu jest więc obojętny. Z kolei fenole to słabe kwasy, które ulegają dysocjacji elektrolitycznej pod wpływem wody. Odczyn ich wodnych roztworów jest kwasowy.
Poniżej przedstawiono porównanie zachowania roztworu fenolu oraz etanolu wobec uniwersalnego papierka wskaźnikowego.
Zapoznaj się z opisem ilustracji przedstawiającej porównanie zachowania roztworu fenolu oraz etanolu wobec uniwersalnego papierka wskaźnikowego.
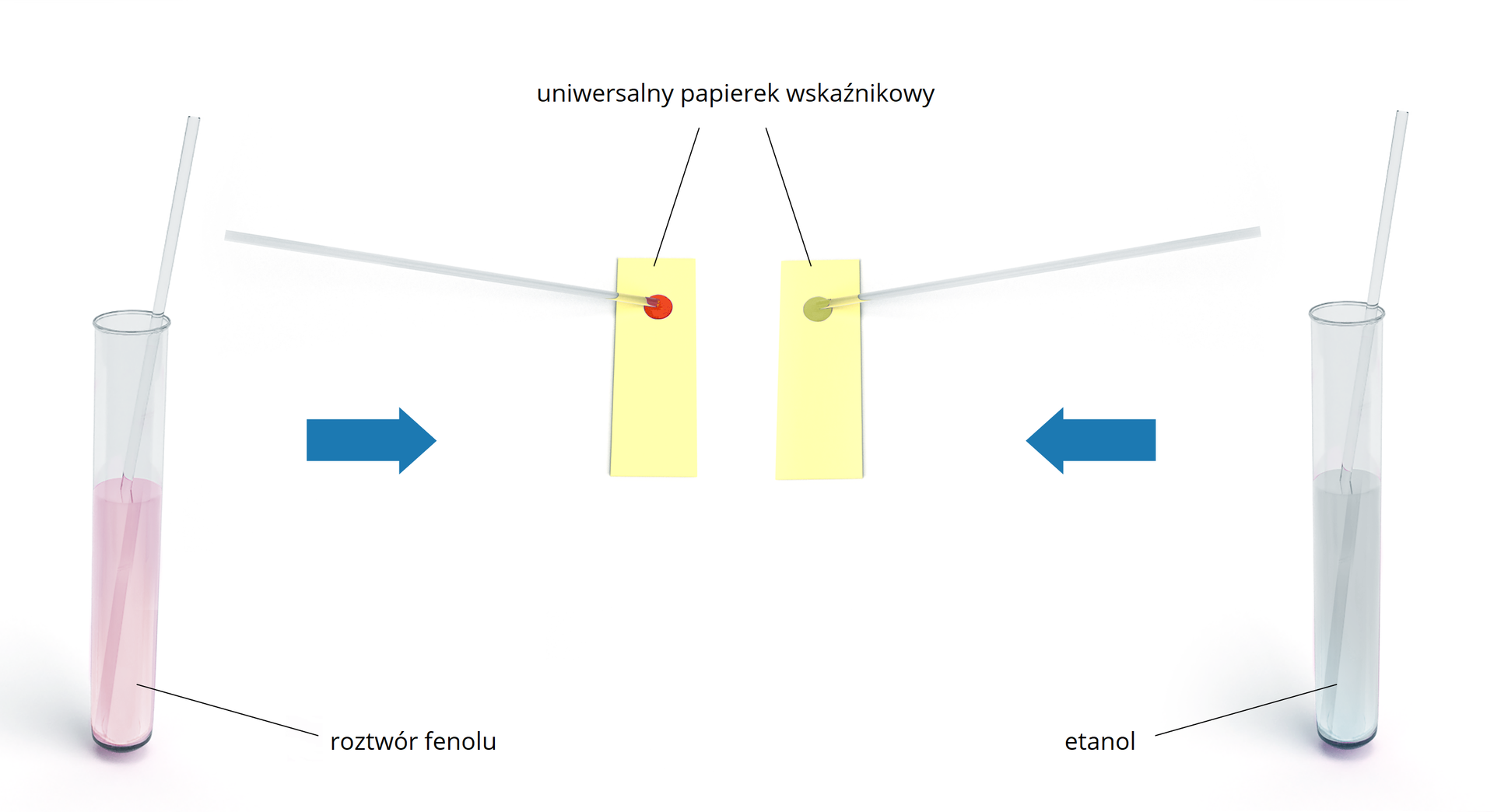
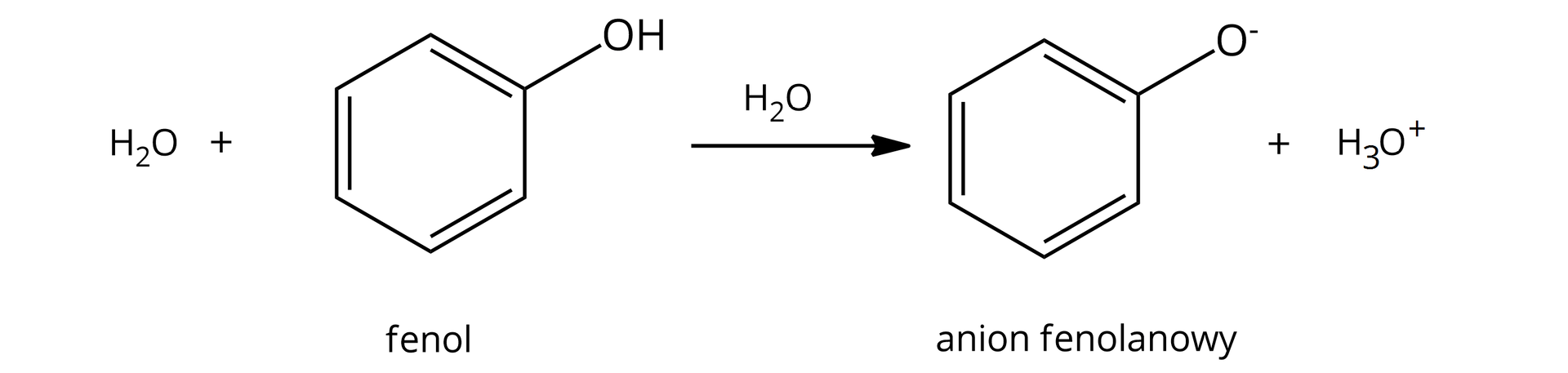
Uniwersalny papierek wskaźnikowy w roztworze fenolu barwi się na kolor jasnoczerwony, co świadczy o odczynie kwasowym. Fenol ulega dysocjacji zgodnie z poniższym równaniem:
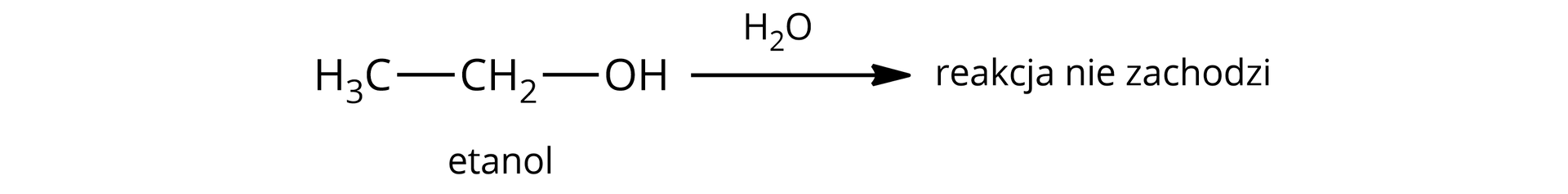
W przypadku etanolu papierek wskaźnikowy pozostaje żółty, co wskazuje na odczyn obojętny. Etanol nie dysocjuje już w wodzie, ponieważ jego stała dysocjacji kwasustała dysocjacji kwasu jest niższa niż stała dysocjacji kwasu dla wody, co oznacza, że etanol wykazuje jeszcze słabsze właściwości kwasowe niż woda.
związek | wartość w 25°C | wartość w 25°C |
fenol | 1,3 · 10Indeks górny -10-10 | 9,9 |
woda | 1,8 · 10Indeks górny -16-16 | 15,7 |
etanol | 1,3 · 10Indeks górny -16-16 | 15,9 |
Użycie wskaźnika kwasowo‑zasadowego, np. uniwersalnego papierka wskaźnikowego, oranżu metylowego czy wskaźnika uniwersalnego pozwala na odróżnienie alkoholi od fenoli. Należy jednak pamiętać, że w przypadku fenolu jego roztwór musi być stężony i przygotowany w gorącej wodzie, ponieważ rozpuszcza się on jedynie w wysokiej temperaturze. Co więcej – ani alkohole, ani związki aromatyczne, zawierające ugrupowanie fenolowe, nie mogą być związane z innymi grupami kwasowymi lub zasadowymi, które wpływają na odczyn całego związku chemicznego.
Reakcja z
Fenol, jako słaby kwas, reaguje z wodnymi roztworami mocnych zasad, np. , zgodnie z poniższym równaniem reakcji:

Produktem reakcji fenolu (benzenolu) z wodorotlenkiem sodu jest sól – fenolan sodu (benzenolan sodu).
Alkohole mają właściwości kwasowe, ale na tyle słabe, że można je wykazać jedynie w reakcji z metalami aktywnymi, ponieważ tylko te wypierają wodór z alkoholu. Alkohole więc nie reagują z zasadami, jak choćby lub .
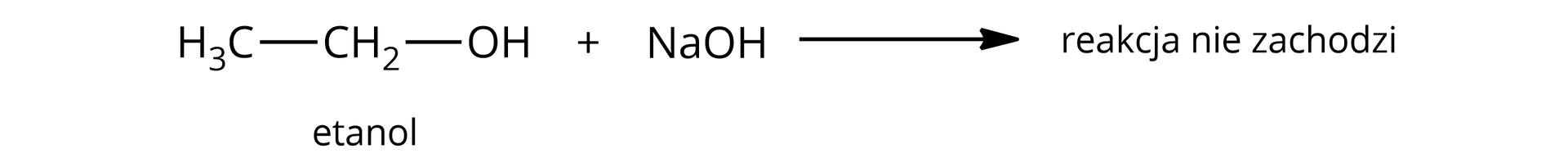
Fenol posiada zatem silniejsze właściwości kwasowe niż alkohole.
Reakcja charakterystyczna dla fenoli: zachowanie wobec
Najszybszą metodą na odróżnienie alkoholi od fenoli jest przeprowadzenie próby z wodnym roztworem chlorku żelaza(III). Jest to jakościowa metoda potwierdzająca obecność ugrupowania fenolowego w cząsteczce. Związki aromatyczne zawierające grupę , bezpośrednio związaną z pierścieniem w reakcji z , tworzą charakterystyczne związki koordynacyjnezwiązki koordynacyjne o barwie ciemnofioletowej. Zabarwienie roztworu zależy jednak od stężenia chlorku żelaza(III).
Poniżej przedstawiono wynik połączenia roztworów fenolu oraz .
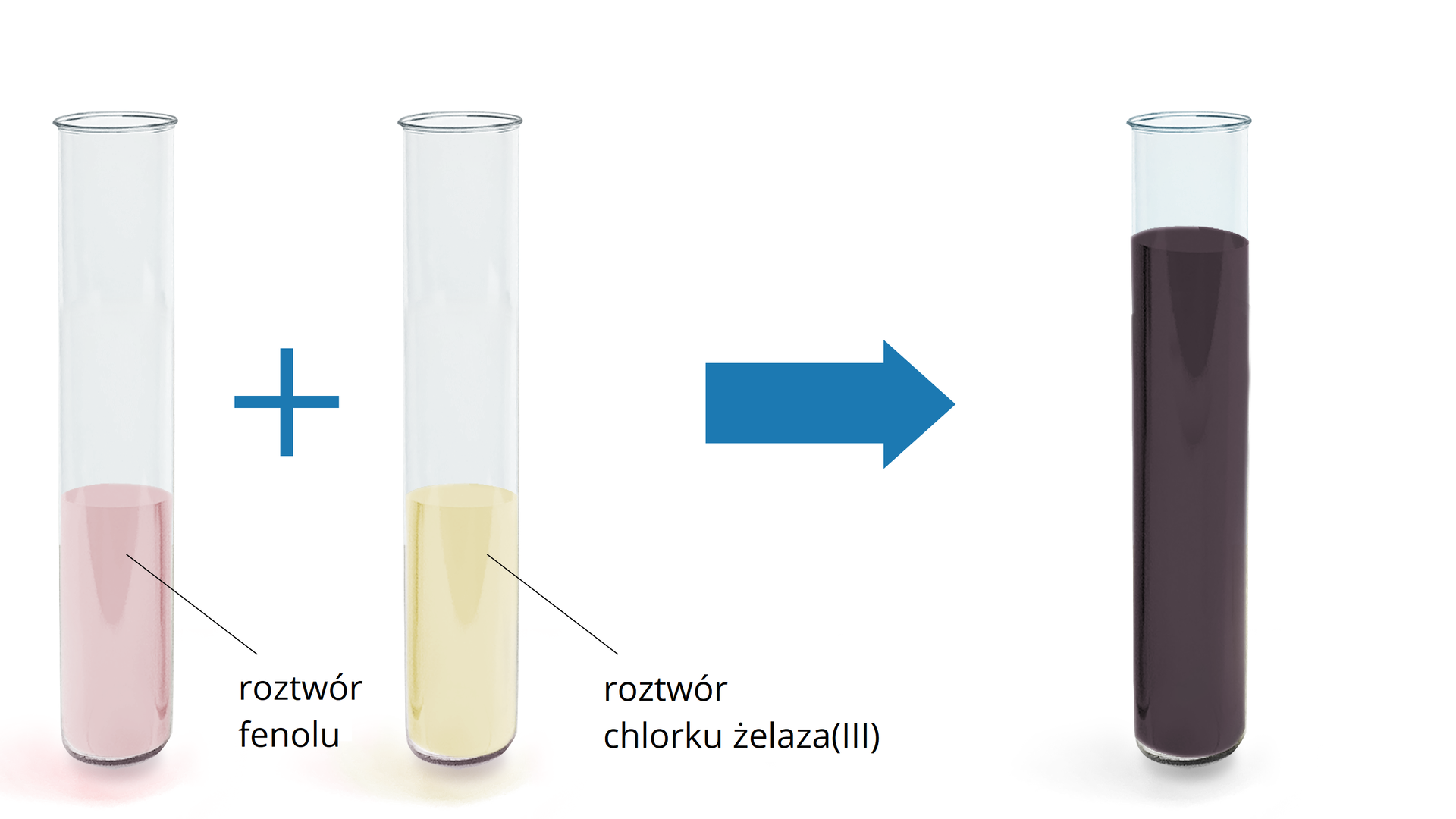
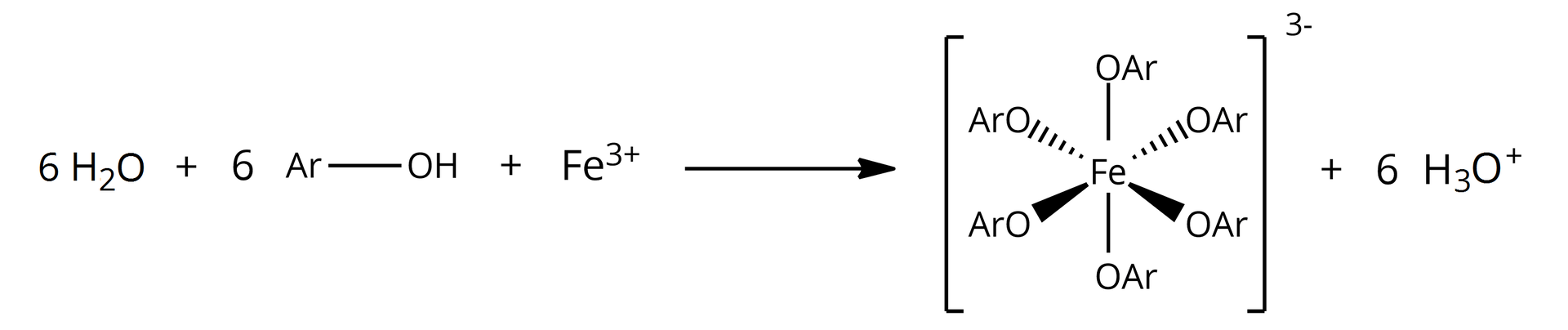
Równanie reakcji powstawania powyższego związku koordynacyjnego o barwie fioletowej można przedstawić następująco:
Słownik
(arab. al‑kuhl „delikatny proszek”) związki organiczne, pochodne węglowodorów, których cząsteczki zawierają grupę hydroksylową (wodorotlenową) zamiast atomu wodoru związanego w związku macierzystym z atomem węgla grupy alkilowej lub cykloalkilowej
związki organiczne, mono-, di- i polihydroksylowe pochodne benzenu oraz alkilobenzenów, których cząsteczki zawierają grupy hydroksylowe () związane z atomem węgla pierścienia benzenowego
(związki kompleksowe, kompleksy) złożone cząsteczki lub jony (kationy, aniony), w których atom (lub jon) zwany atomem (jonem) centralnym jest połączony za pomocą wiązania koordynacyjnego z ligandami — jonami lub cząsteczkami obojętnymi
() stała równa stosunkowi iloczynu stężeń jonów, powstających w procesie dysocjacji kwasu, do stężenia cząsteczek niezdysocjowanych
Bibliografia
Danikiewicz W., Chemia. Podręcznik do kształcenia rozszerzonego w liceach. Część III. Chemia organiczna, Warszawa 2009.
Encyklopedia PWN.
Kaznowski K., Chemia. Vademecum maturalne, Warszawa 2016.