Przeczytaj
Sacharoza
Sacharoza jest cukrem zaliczanym do disacharydówdisacharydów, ponieważ składa się z dwóch cząsteczek cukrów prostych, mianowicie: D‑fruktozy i D‑glukozy. Używana jest powszechnie jako cukier stołowy.
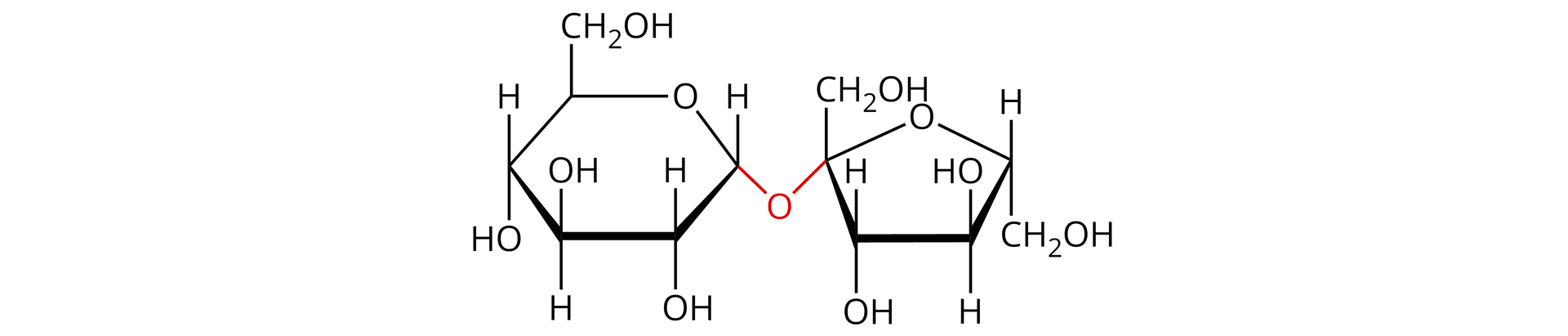
Wzór sumaryczny sacharozy to . Nazwę sacharozy powinno zapisywać się ze znakiem (+), ponieważ skręca ona płaszczyznę światła spolaryzowanegospolaryzowanego w stronę prawą.
Badanie procesu hydrolizy sacharozy
Metoda fizykochemiczna
We wcześniejszym akapicie wspomniano, że sacharoza skręca światło spolaryzowane w prawoskręca światło spolaryzowane w prawo. Możesz sobie teraz zadawać pytanie „Skąd wiadomo, że w prawo, a nie w lewo?” – w celu zbadania skręcalności związku, należy posłużyć się polarymetrem kołowym Lippicha.

Polarymetr jest urządzeniem wykorzystującym jedną z prostszych metod fizykochemicznych, nazywaną polarymetriąpolarymetrią. Za pomocą polarymetru bada się zmiany fizyczne związków chemicznych. Pozwala on wyznaczyć skręcalność właściwąskręcalność właściwą, oznaczaną symbolem . Skręcalność właściwa jest kątem mierzonym w stopniach, o jaki ulega skręceniu światło spolaryzowane, przy użyciu światła sodowego (prążka Dprążka D – stąd dolny indeks ). Zależy on od temperatury (górny indeks ), stężenia, grubości warstwy roztworu.
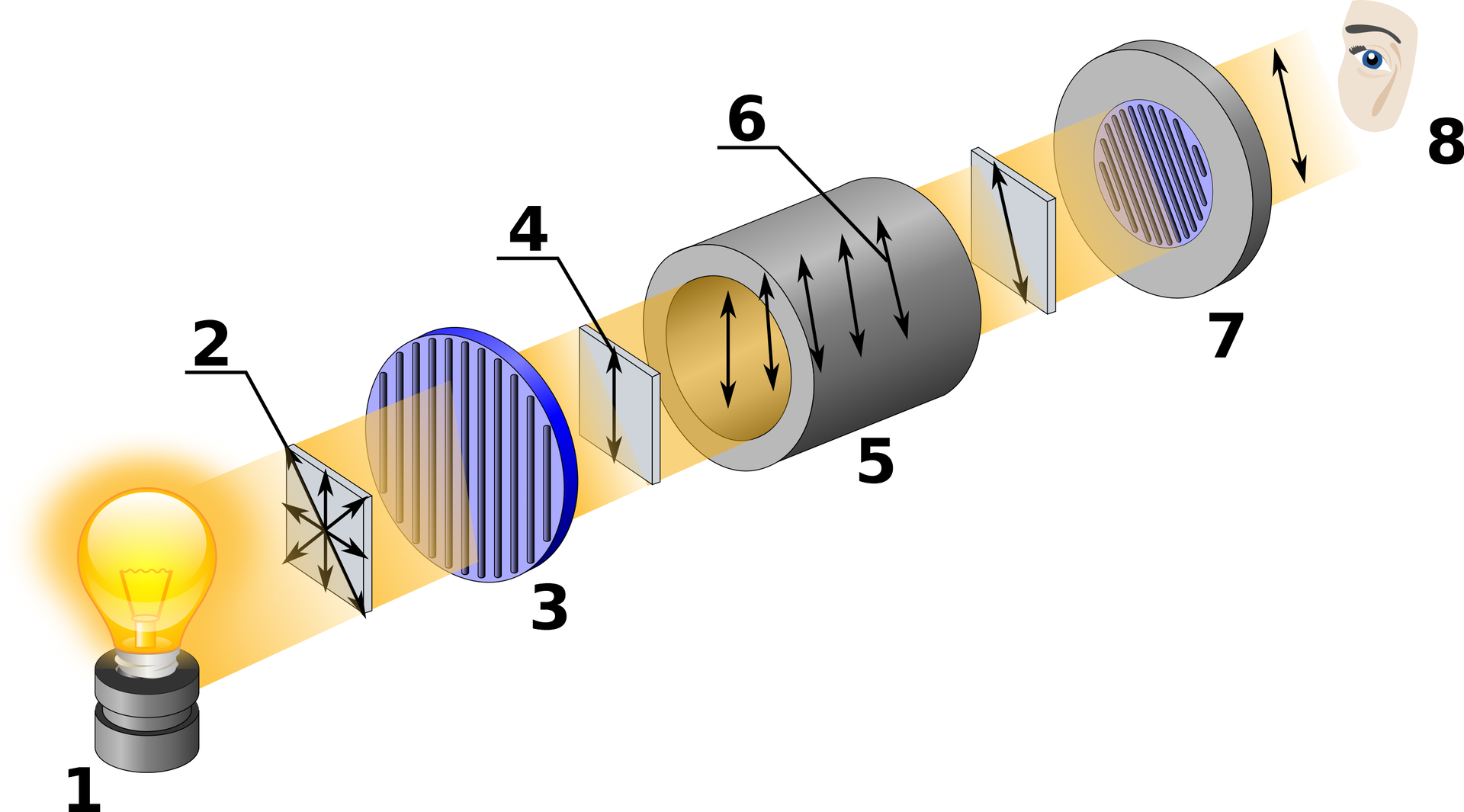
1 – źródło światła
2 – światło niespolaryzowane
3 – polaryzator
4 – światło spolaryzowane
5 – miejsce umieszczania próbki związku organicznego
6 – światło, które ulega skręceniu
7 – obrotowy filtr polaryzacyjny
8 – obserwator
W laboratorium (eksperymentalnie), za pomocą polarymetru, możemy dokonać pomiaru kąta skręcenia płaszczyzny. Przy wyznaczeniu skręcalności właściwej, należy skorzystać ze wzoru:
gdzie:
– jest to kąt skręcenia płaszczyzny polaryzacji wyrażony w stopniach;
– jest to grubość warstwy roztworu w decymetrach;
– stężenie badanej próbki w gramach na roztworu.
W poniższej tabeli przedstawione zostały skręcalności właściwe wybranych cukrów.
Nazwa cukru | Skręcalność właściwa |
|---|---|
Fruktoza | |
Glukoza | |
Sacharoza |
Proces hydrolizy sacharozy przeprowadza się w środowisku kwasowym lub przez dodanie enzymu z klasy inwertaz. Reakcję można zapisać następująco:
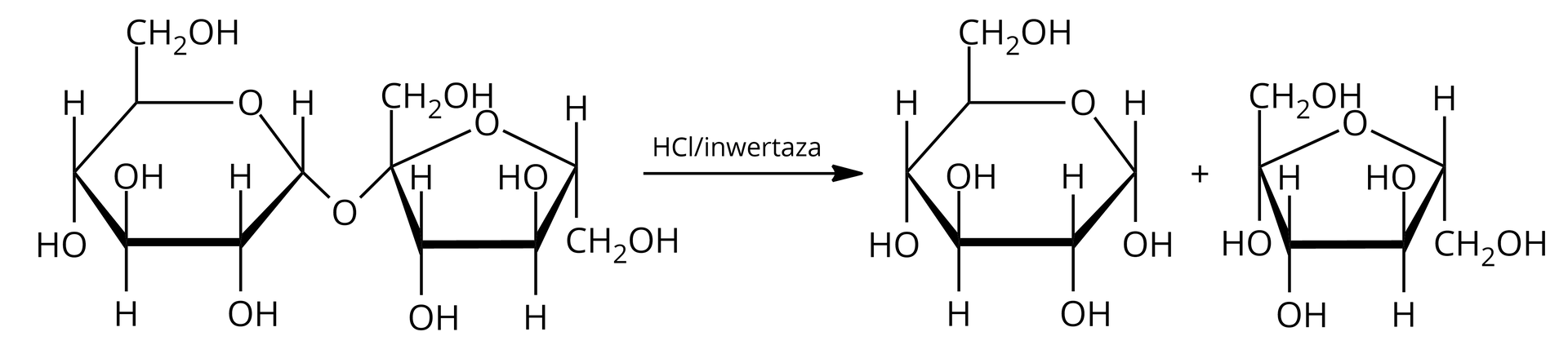
Jak możesz zauważyć, w wyniku hydrolizy powstaje glukoza o skręcalności właściwej oraz fruktoza o skręcalności właściwej . W miarę przebiegu reakcji, skręcalność maleje do wartości ujemnych. Otrzymany w ten sposób cukier nazywamy cukrem inwertowanym, a proces inwersją sacharozyinwersją sacharozy. Podczas tej reakcji ulega rozerwaniu wiązanie –--glikozydowe. Skręcalność cukru inwertowanego wynosi:
W celu zbadania procesu hydrolizy sacharozy czy innych węglowodanów złożonych, należy przygotować roztwory wzorcowe mieszaniny cukrów o dokładnie znanym stężeniu oraz wykreślić krzywą wzorcową zależności kąta skręcenia od składu mieszaniny wzorcowej. Następnie, co jakiś czas, pobierać próbkę inwertowanego cukru. Na podstawie jego skręcalności, należy oznaczyć ilość i skład mieszaniny w zależności od czasu.
Powyższa metoda znajduje zastosowanie do dokładnego wyznaczenia stężenia cukrów.
Reakcje potwierdzające hydrolizę sacharozy
Sacharoza jest dwucukrem, zaliczanym do cukrów nieredukujących, ponieważ obydwa anomeryczne atomy węgla uczestniczą w wiązaniu -glikozydowym. Oznacza to, że nie reaguje z takimi odczynnikami, jak odczynnik Tollensa czy Trommera. W wyniku hydrolizy powstaje glukoza i fruktoza, które z kolei dają pozytywny wynik powyższych prób.
Próba Tollensa polega na reakcji monosacharydu z odczynnikiem Tollensa, którym jest diaminasrebra(). W wyniku tej reakcji otrzymujemy na ścianach probówki osad metalicznego srebra.
Próba Trommera polega na reakcji monosacharydu ze świeżo wytrąconym wodorotlenkiem miedzi(), w wyniku czego obserwujemy wytrącenie się ceglastoczerwonego osadu tlenku miedzi().
Słownik
dwucukry, biozy, sacharydy zbudowane z dwóch cząsteczek monosacharydów, połączonych wiązaniem glikozydowym
całkowite lub częściowe uporządkowanie drgań fali świetlnej (polaryzacja fal)
analiza polarymetryczna, zespół metod analizy chemicznej, identyfikacja i oznaczanie substancji optycznie aktywnych, na podstawie pomiaru wartości kąta skręcenia płaszczyzny, polaryzacji światła i skręcalności optycznej (właściwej)
właściwość substancji optycznie aktywnej, polegająca na skręcaniu płaszczyzny polaryzacji światła podczas przechodzenia światła spolaryzowanego przez tę substancję
skręcenie (w stopniach) płaszczyzny polaryzacji światła monochromatycznego podczas przechodzenia przez -centymetrową warstwę roztworu związku optycznie czynnego, zawierającego tego związku w
długość fali równa , emitowana przez atomy sodu, w pewnym przybliżeniu można je klasyfikować jako światło monochromatyczne
hydrolityczny rozpad cząsteczek sacharozy na mieszaninę (w stosunku ) cząsteczek glukozy i fruktozy
Bibliografia
Encyklopedia PWN
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.