Przeczytaj
Chlor – wiadomości ogólne

Chlor w warunkach normalnych jest gazem o charakterystycznym zielonym zabarwieniu. Znajduje on szereg zastosowań. Ze względu na swoje toksyczne wobec mikroorganizmów właściwości, służy do uzdatniania wody pitnej. Wysoka reaktywność tego pierwiastka sprawia, że znalazł on również zastosowanie w syntezie organicznej – jako substrat w procesach otrzymywania chlorowocopochodnych węglowodorów oraz w syntezie nieorganicznej jako utleniacz. Zdolności utleniające chloru wykorzystuje się również w przemyśle tekstylnym do wybielania tkanin.
Metody otrzymywanie chloru
Otrzymywanie chloru w reakcji tlenku manganu() i kwasu chlorowodorowego
Pierwsza opisana synteza chloru opierała się na reakcji chemicznej pomiędzy tlenkiem manganu(), a kwasem solnym (chlorowodorowym).
Schemat tej reakcji ma postać:
Jak łatwo zauważyć, w powyższej reakcji chemicznej następuje zmiana stopni utlenienia atomów pierwiastków chemicznych. Dlatego też powyższa reakcja jest reakcją typu redoksredoks (utleniania‑redukcji). Współczynniki stechiometryczne należy więc dobrać metodą bilansu jonowo‑elektronowego:
Równanie procesu redukcji:
Równanie procesu utlenienia:
Sumaryczne równanie reakcji:
W tej reakcji chemicznej tlenek manganu() pełni funkcję utleniacza, a kwas solny (chlorowodorowy) funkcję reduktora.
Modyfikacją tej metody może być ogrzewanie roztworu solankisolanki z kwasem siarkowym() i tlenkiem manganu().
Schemat tej reakcji ma postać:
Podobnie jak w poprzednim przypadku w reakcji tej następuje zmiana stopni utlenienia indywiduów, dlatego też współczynniki stechiometryczne należy dobrać metodą bilansu jonowo‑elektronowego:
Równanie procesu redukcji:
Równanie procesu utlenienia:
Sumaryczne równanie reakcji:
Otrzymywanie chloru w wyniku utleniania chlorowodoru
Z czasem zauważono, że chlor ma właściwości wybielające, co zwiększyło zapotrzebowanie na tę gazową substancję prostą. Jedną z pierwszych metod otrzymywania chloru była reakcja spalania chlorowodoru w tlenie, z chlorkiem miedzi() pełniącym funkcję katalizatorakatalizatora.
Schemat tej reakcji ma postać:
Podobnie jak we wcześniejszych reakcjach chemicznych możemy zauważyć zmiany stopni utlenienia indywiduów, dlatego też współczynniki stechiometryczne należy dobrać metodą bilansu elektronowego:
Równanie procesu redukcji:
Równanie procesu utlenienia:
Sumaryczne równanie reakcji:
Otrzymywanie chloru w reakcji kwasów lub bezwodników kwasowych z chloranem() wapnia
W warunkach laboratoryjnych chlor można również otrzymać w wyniku reakcji kwasów (lub bezwodników kwasowych kwasów nieorganicznychbezwodników kwasowych kwasów nieorganicznych) z solami wapniowymi będącymi pochodnymi kwasu chlorowego() (kwasu podchlorawego), m.in. z chloranem() wapnia.
W wyniku działania kwasem solnym (chlorowodorowym) na chloran() wapnia otrzymuje się gazowy chlor.
Schemat analizowanej reakcji ma postać:
Aby dobrać współczynniki w powyższej reakcji chemicznej należy wykorzystać metodę bilansu jonowo‑elektronowego:
Równanie procesu redukcji:
Równanie procesu utlenienia:
Sumaryczne równanie reakcji:
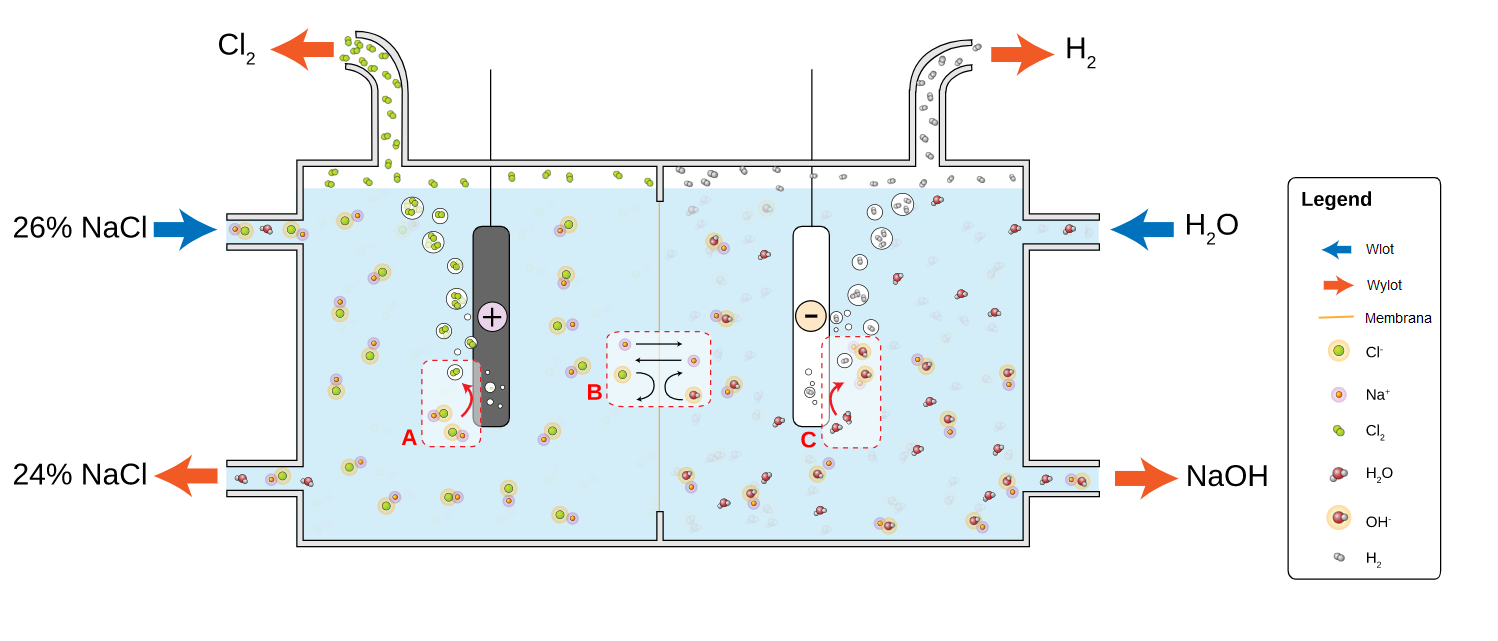
Otrzymywanie chloru metodą elektrolizy
Inną wykorzystywaną w laboratorium metodą syntezy chloru jest metoda elektrolizyelektrolizy solankisolanki. W trakcie procesu elektrolizy na elektrodach zachodzą odpowiednie procesy:
Równanie procesu katodowego:
Równanie procesu anodowego:
Sumaryczne równanie reakcji:
Produktami reakcji elektrolizy solanki są: chlor, wodór oraz wodorotlenek sodu.
Słownik
rodzaj reakcji utleniania‑redukcji, w której atomy tego samego pierwiastka ulegają zarówno procesowi utleniania, jak i redukcji
nasycony wodny roztwór chlorku sodu
reakcje, w których dochodzi do przeniesienia jednego lub więcej elektronów od atomu, jonu lub cząsteczki donora (czyli reduktora) do akceptora (czyli utleniacza)
proces polegający na zmianie składu substancji chemicznej pod wpływem przyłożonego zewnętrznego napięcia elektrycznego
substancja przyspieszająca zachodzenie reakcji chemicznych
tlenki kwasotwórcze; tlenki, które w wyniku reakcji z wodą tworzą odpowiednie kwasy nieorganiczne
Bibliografia
P.B. Saxena, I.I.T Chemistry-I, Meerut 2001.
Atkins, P., Jones, L., Laverman, L., Chemical Principles, wydanie 7, Nowy Jork 2016.
Bielański A. Podstawy chemii nieorganicznej Tom 2, Warszawa 2012.