Przeczytaj
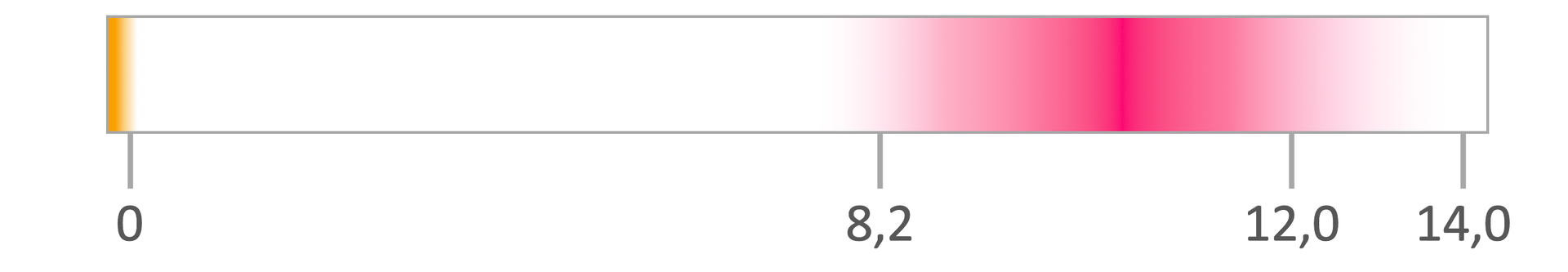
Wielkościami liczbowo charakteryzującymi odczynodczyn roztworu są oraz :
Odczyn roztworu zależy zatem od stężenia molowego jonów i od stężenia molowego jonów oraz ich wzajemnej relacji:
Przykłady wskaźników kwasowo‑zasadowych
WskaźnikiWskaźniki kwasowo–zasadowe to zwykłe związki typu słabych kwasów lub słabych zasad organicznych. Barwy, które nadają roztworom forma zdysocjowana i forma niezdysocjowana są różne. Przewaga danej formy (zdysocjowanej lub niezdysocjowanej), a więc i barwa roztworu jest zatem zależna od jego pH. Najpopularniejszym wskaźnikiem jest papierek uniwersalnypapierek uniwersalny, zwany wskaźnikowym. W roztworze o odczynie kwasowym przyjmuje on barwę czerwoną, o odczynie zasadowym przyjmuje barwę zieloną lub niebieską, a w roztworze obojętnym pozostaje zółty. Inne popularne wskaźnikiwskaźniki przedstawiono w tabeli.
Wskaźnik | Barwa wskaźnika poniżej niższej wartości | Zakres zmiany barwy | Barwa wskaźnika powyżej wyższej wartości |
|---|---|---|---|
oranż metylowy | czerwona | – | żółtopomarańczowa |
fenoloftaleina | bezbarwna | – | malinowa (różowoczerwona) |
lakmus | czerwona | – | niebieska |
Warto znać też inne wskaźniki kwasowo–zasadowe.
Wskaźnik | Barwa wskaźnika poniżej niższej wartości pH | Zakres pH zmiany barwy | Barwa wskaźnika powyżej wyższej wartości pH |
|---|---|---|---|
błękit tymolowy | czerwona | –; – | niebieska |
błękit bromofenolowy | żółta | – | niebieskofioletowa |
czerwień Kongo | niebieska | – | czerwona |
zieleń bromokrezolowa | żółta | – | niebieska |
błękit bromotymolowy | żółta | – | niebieska |
Aby zbadać odczyn roztworu, możemy nanieść kroplę roztworu na uniwersalny papierek wskaźnikowyuniwersalny papierek wskaźnikowy:
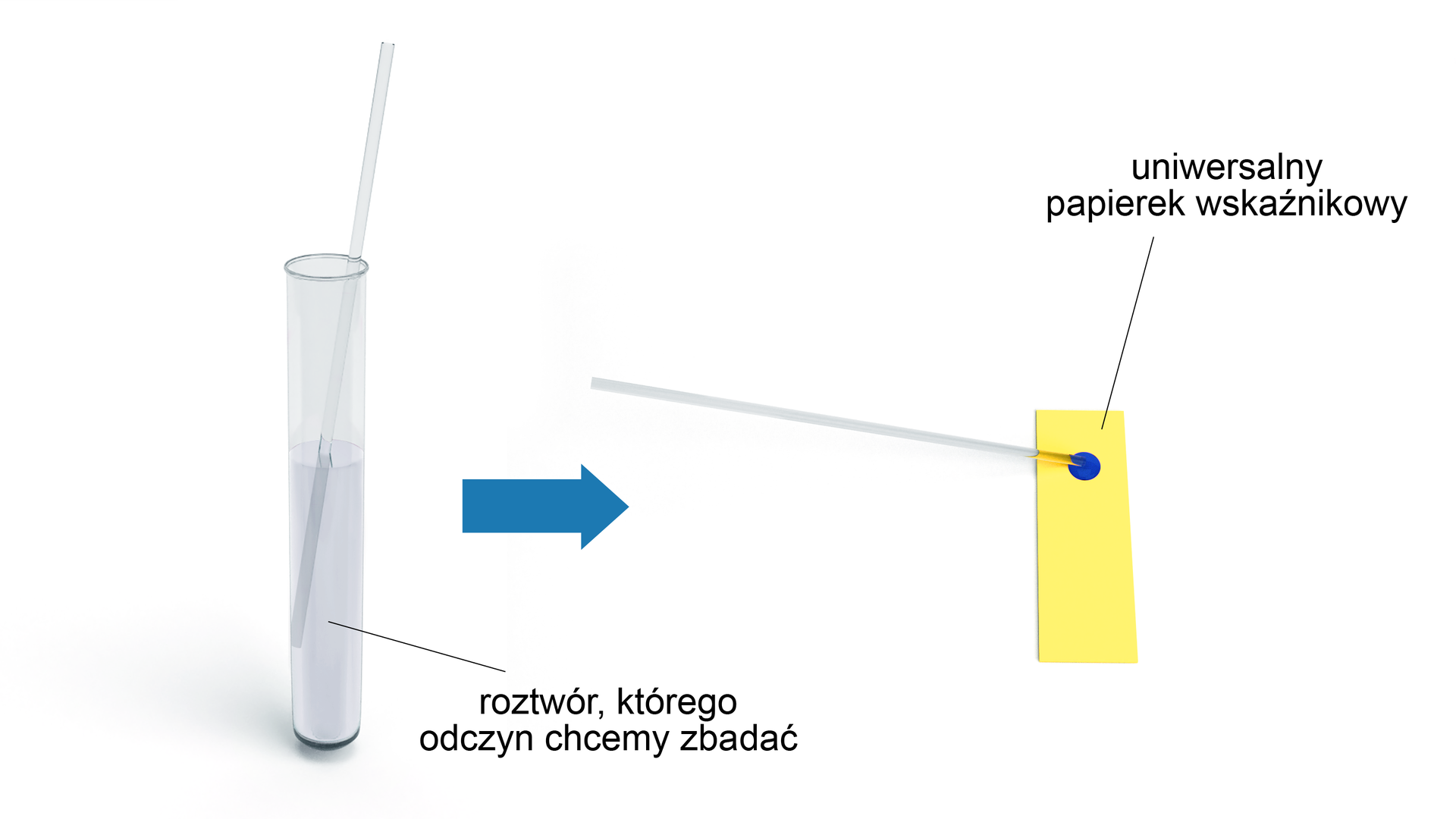
Następnie należy porównać barwę uniwersalnego papierka wskaźnikowego ze skalą barw.

Odczyn roztworu
Generalnie wodne roztwory kwasów mają odczynodczyn kwasowy, natomiast zasad – zasadowy. A jaki odczyn mają wodne roztwory soli?
Rozpuszczalne w wodzie sole nie tylko ulegają procesowi dysocjacji elektrolitycznej, ale również hydroliziehydrolizie. To reakcja odwracalna, która zachodzi między kationem lub/i anionem, pochodzącym z dysocjacji soli, a cząsteczkami wody. Hydrolizie ulegają wszystkie sole z wyjątkiem soli mocnych kwasów i mocnych zasad, np. (odczyn roztworu wodnego tej soli jest obojętny). Reakcja hydrolizy pozwala na przewidywanie odczynu roztworu. Jony powstałe podczas hydrolizy odpowiedzialne są za odczyn roztworu. Za odczyn zasadowy odpowiada obecność jonów (przewaga liczby jonów w stosunku do jonów obecnych w roztworze), natomiast za odczyn kwasowy odpowiada obecność jonów (większa liczba jonów w roztworze niż ). W przypadku odczynu obojętnego liczba jonów i jest taka sama.
Przypomnienie o hydrolizie
Słownik
cecha roztworu elektrolitu zależna od wzajemnego stosunku stężeń jonów i
pasek bibuły filtracyjnej nasycony roztworem wskaźnika, który zanurzony w badanym roztworze lub zwilżony jego kroplą, wykazuje charakterystyczną zmianę zabarwienia
indykator; chemiczna substancja, która w określonych warunkach wykazuje wyraźną zmianę właściwości fizycznych – najczęściej pojawienie się lub modyfikację zabarwienia, co pozwala na stwierdzenie odczynu badanego roztworu albo obecności określonego jonu lub cząsteczki; wskaźniki zmieniają swoją barwę przy określonym (np. fenoloftaleina)
(gr. hýdōr „woda”, lýsis „rozłożenie”) rozkład substancji pod wpływem wody, reakcja podwójnej wymiany, która zachodzi między wodą a substancją w niej rozpuszczoną oraz prowadzi do powstania cząsteczek nowych związków chemicznych
W tym materiale jako rekcje hydrolizy określono reakcje odpowiednich jonów, pochodzących z dysocjacji elektrolitycznej soli, z wodą. Przykład równań reakcji:
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa‑Bielsko‑Biała 2010.