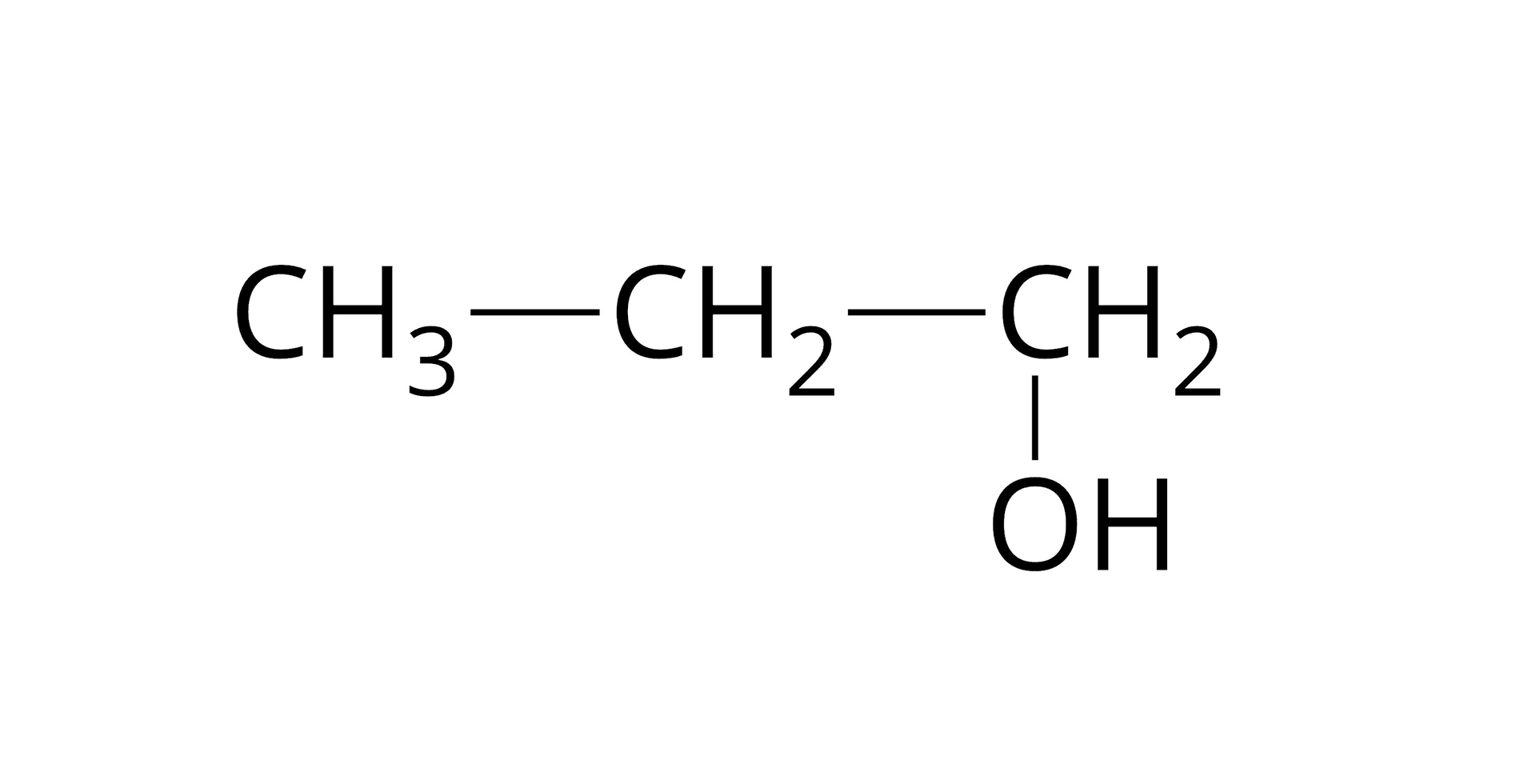Przeczytaj
Identyfikacja związków organicznych
Związki organiczne otrzymywane sztucznie to obecnie kluczowe składniki wielu produktów codziennego użytku. Różnorodność ich zastosowań uwypukla wartość, jaką niesie ze sobą dziedzina chemii organicznej, która jest bardzo szeroka i cały czas się rozwija. Tworzone są nowe związki chemiczne, które – ze względu na swoje specyficzne właściwości – zyskują ciekawe zastosowania. Istnieje szereg różnych metod syntezy nowych związków, a wybranie właściwej techniki wymaga wiedzy o właściwościach i reaktywności danych reagentów oraz szeregu prób eksperymentalnych, pozwalających osiągnąć zamierzony cel. W trakcie swojej pracy, chemicy muszą niejednokrotnie sprawdzać za pomocą dostępnych im metod badawczych, czy otrzymali związek, jaki zaplanowali, czy jednak synteza się nie powiodła. Do tego celu służą metody identyfikacji i badania struktury związków organicznych.
Metody chemiczne
Wśród metod chemicznych, a zatem takich, które wykorzystują właściwości chemiczne związków, można wyróżnić m.in. metody, takie jak:
elementarna analiza jakościowa (próba spalania, oznaczanie heteroatomów);
identyfikacja poprzez przynależność badanego związku do danej grupy rozpuszczalności;
identyfikacja grup funkcyjnych.
Ich dokładniejszy opis znajdziesz w dalszej części e‑materiału.
Postępowanie w przypadku identyfikacji związków organicznych metodami chemicznymi
1. Oznaczenie czystości związku i stałych fizycznych (np. temperatura topnienia, temperatura wrzenia)
Jeśli analizowana substancja jest cieczą, należy sprawdzić jej temperaturę wrzenia, przeprowadzając w tym celu destylację. Związek czysty destyluje się w wąskim zakresie temperatur . Ponadto można dokonać pomiaru współczynnika załamania światła i gęstości, które również pozwalają na dokonanie identyfikacji związku.
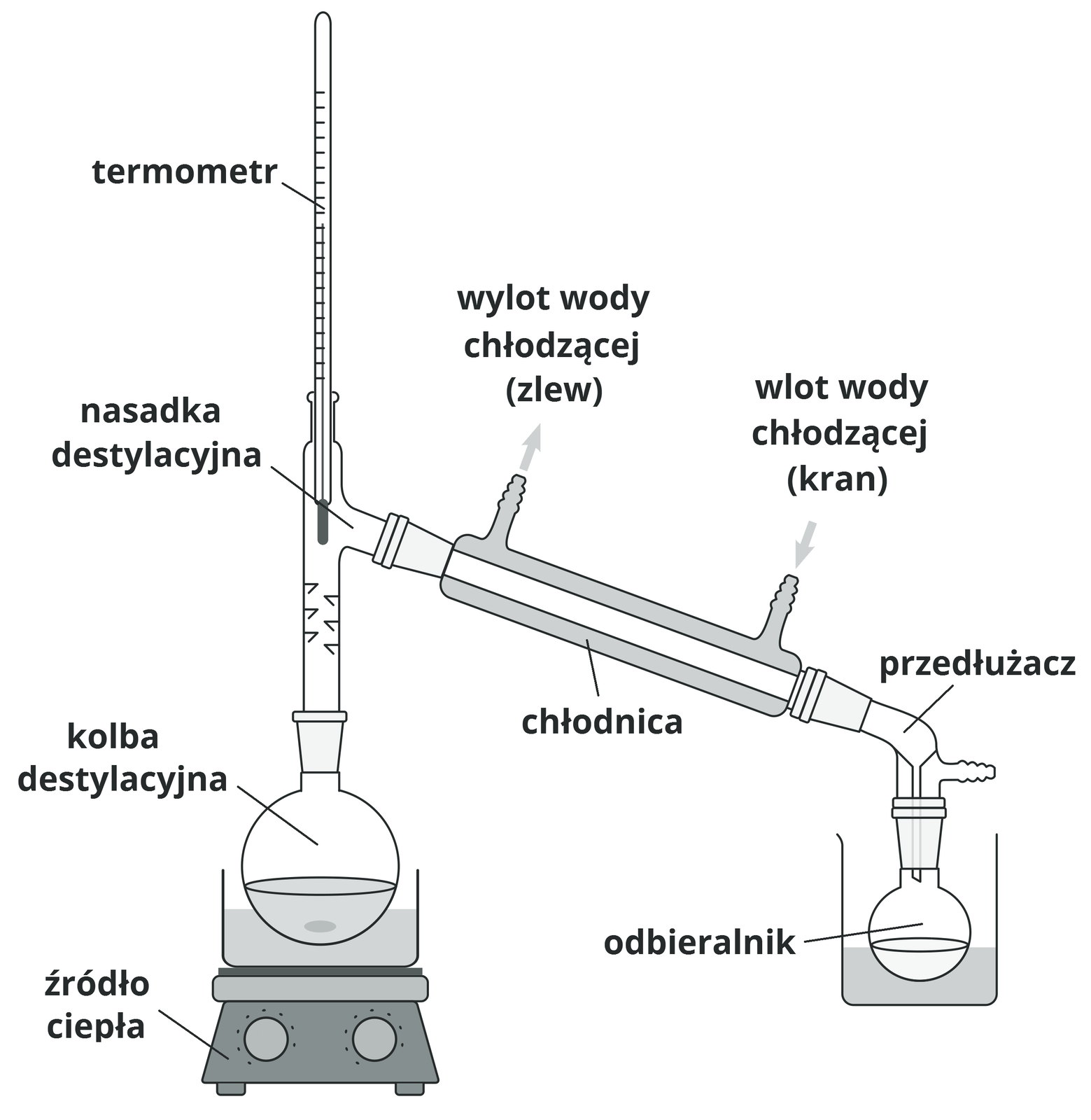
Jeśli analizowany związek jest ciałem stałym, wówczas należy sprawdzić jego temperaturę topnienia. Czysty związek, po rozpuszczeniu go w rozpuszczalniku i ponownej krystalizacji, posiada taką samą temperaturę topnienia, jak przed przeprowadzeniem procesu rozpuszczania i krystalizacji.

2. Elementarna analiza jakościowa
Elementarna analiza jakościowa (AE) związków organicznych pozwala na wykrycie rodzajów atomów pierwiastków, które wchodzą w skład danej cząsteczki, głównie: , , , , , oraz chlorowców. Pozwala ona sprawdzić stopień nasycenia związku organicznego. Związki nasycone spalają się jasnym płomieniem, nienasycone – lekko kopcącym płomieniem, a związki aromatyczne – mocno kopcącym płomieniem. Jest to tzw. próba spalania.

Wyróżnić możemy również jakościową analizę pierwiastków, która ma na celu identyfikację pierwiastków innych niż węgiel i wodór, po przekształceniu ich w jonowe związki, dobrze rozpuszczalne w wodzie. W tym celu przeprowadza się stapianie z sodem (próba Lassaigne’a). Należy pamiętać, aby stosować nadmiar sodu, ponieważ w przypadku obecności siarki i azotu, tworzenie się tiocyjanianu sodu może uniemożliwić wykrycie azotu. Efektem takiego zabiegu jest rozkład związku organicznego, a występujące w nim pierwiastki tworzą aniony.
Probówkę z tak otrzymanym stopem rozbija się, a stop alkaliczny przemywa wodą. Otrzymany roztwór poddaje się próbom analizy jakościowej nieorganicznej, która pozwala na wykrycie obecności azotu, siarki i fluorowców.
Wykrywanie azotu:
1 Wykrywanie siarki:
Jeśli po dodaniu do roztworu (otrzymanego po stapianiu z sodem) wytrąci się czarny osad siarczku żelaza(), świadczy to o zawartości siarki w analizowanej próbce. Siarczek żelaza() rozpuszcza się w rozcieńczonym kwasie siarkowym() z wydzielaniem gazowego siarkowodoru o nieprzyjemnym charakterystycznym zapachu (zgniłych jaj).
Wykrywanie fluorowców
W celu zidentyfikowania jonów fluorowców , przeprowadza się reakcję z azotanem() srebra() i rozcieńczonym kwasem azotowym(). Powstanie osadu potwierdza obecność jonu .
Biały osad, który łatwo ulega rozpuszczeniu w amoniaku, to chlorek srebra(), żółty trudno rozpuszczalny w amoniaku to bromek srebra(), żółty nierozpuszczalny w amoniaku to jodek srebra(). W celu zidentyfikowania jonu , należy użyć papierka cyrkono‑alizarynowego S – zmiana barwy z czerwonej na żółtą jest pozytywnym wynikiem na obecność jonu fluorkowego w badanej próbce.
3. Badanie rozpuszczalności
Swoje potwierdzenie znajduje tutaj zasada „podobne rozpuszcza się w podobnym”. Analizowany związek ulegnie rozpuszczaniu w rozpuszczalniku, do którego jest zbliżony budową lub charakterem. Jeśli badany związek jest polarny, rozpuści się w polarnych rozpuszczalnikach, a jeśli jest niepolarny – w niepolarnych rozpuszczalnikach. Jeśli dany związek reaguje z rozpuszczalnikiem, można określić jego chemiczny charakter – jeśli ulegnie rozpuszczeniu w rozpuszczalniku zasadowym, prawdopodobnie ma charakter kwasowy, a w wyniku reakcji tworzy rozpuszczalną sól.
Sprawdzenie rozpuszczalności pozwala na klasyfikację do grup rozpuszczalności i znacznie upraszcza dalszą identyfikację związku organicznego.
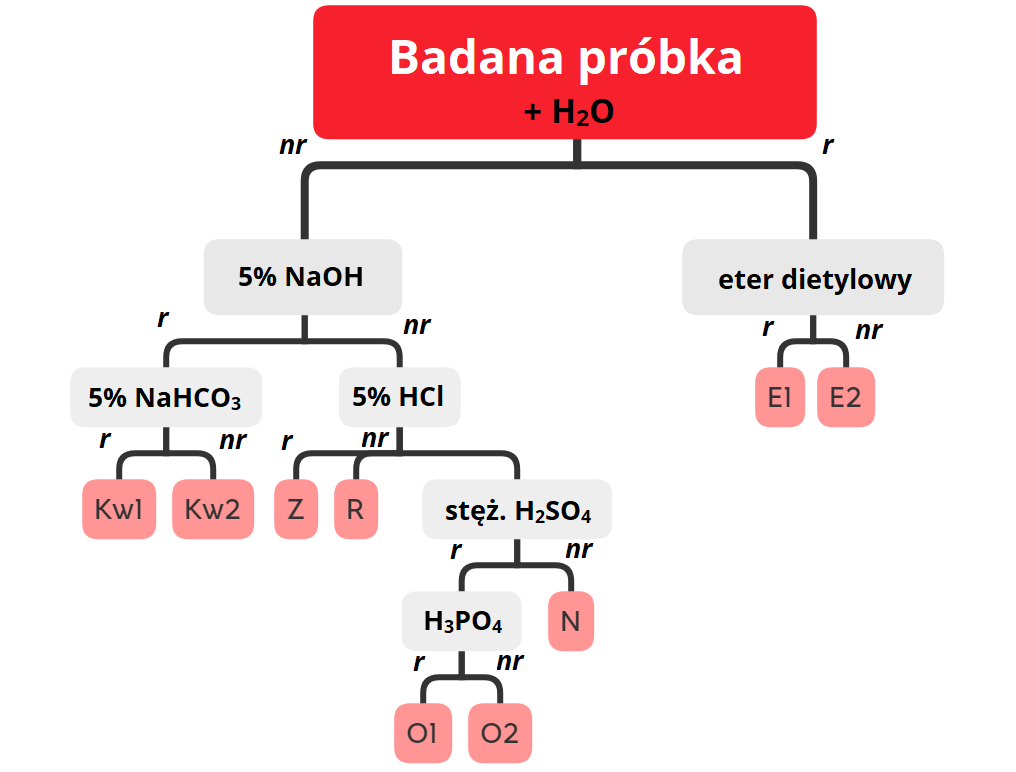
Grupa | Rozpuszczalność | Typy związków |
|---|---|---|
| Substancje rozpuszczalne w wodzie i eterze dietylowym | Związki monofunkcyjne: alkohole, aldehydy, ketony, kwasy, estry, amidy, aminy i nitryle (zawierające do pięciu atomów węgla w cząsteczce) |
| Substancje rozpuszczalne w wodzie i nierozpuszczalne w eterze | Związki polifunkcyjne: alkohole wielowodorotlenowe, cukry, kwasy wielokarboksylowe, hydroksykwasy, aminokwasy |
a | Substancje nierozpuszczalne w wodzie, a rozpuszczalne w 5% | Związki o charakterze kwasowym: kwasy o większej liczbie atomów węgla, halogenowane kwasy, nitropodstawione kwasy, halogeno- lub nitropodstawione fenole |
b | Substancje nierozpuszczalne w wodzie, a rozpuszczalne w | Związki o charakterze kwasowym: fenole, tiofenole, imidy, ‑diketony, pierwszo- i drugorzędowe nitrozwiązki alifatyczne |
| Substancje nierozpuszczalne w wodzie i , a rozpuszczalne w | Związki o charakterze zasadowym: aminy pierwszorzędowe, drugo- i trzeciorzędowe aminy alifatyczne, niektóre drugo- i trzeciorzędowe aryloalkiloamidy, hydrazyny, niektóre trzeciorzędowe amidy |
| Substancje nierozpuszczalne w wodzie, w , ani w | Związki zawierające lub : diaryloaminy, aminofenole, nitryle, amidy, aromatyczne lub trzeciorzędowe nitrozwiązki, związki karbonylowe z grupami nitrowymi, azotany, tioetery, sulfotlenki, sulfony, siarczany |
| Substancje nierozpuszczalne w wodzie, roztworach , ani , rozpuszczalne w stężonym | Obojętne związki niezawierające lub : alkohole, aldehydy, ketony, estry, etery, alkeny, alkiny, polialkilobenzeny |
| Substancje nierozpuszczalne w wodzie, roztworach , , ani w stężonym | Niereaktywne związki niezawierające lub : aromatyczne i alifatyczne węglowodory, aromatyczne i alifatyczne chlorowcopochodne, etery dwuarylowe, związki perfluorowane |
Indeks górny Tabela 1. Podział substancji organicznych na grupy rozpuszczalności Indeks górny koniecTabela 1. Podział substancji organicznych na grupy rozpuszczalności
4. Charakterystyczne reakcje grup funkcyjnych (identyfikacja grup funkcyjnych)
W tym celu przeprowadza się szereg prób ze specjalnie dobranymi odczynnikami (tzw. reakcje grupowe), a reakcje te zachodzą na ogół w wyniku reakcji substytucji elektrofilowej. Poniżej kilka przykładowych analiz dla wybranych grup funkcyjnych.
Wykrywanie arenów:
Pierwsza wskazówka o obecności pierścieni aromatycznych to kopcący płomień przy próbie spalania. Inną metodą jest wykorzystanie bezwodnego chlorku glinu (w chloroformie), który tworzy barwne związki kompleksowe z arenami. Dla jednopierścieniowych związków aromatycznych, zabarwienie będzie czerwone lub pomarańczowe, dwupierścieniowe będą mieć barwę czerwoną lub niebieską, a wielopierścieniowe zieloną.
Wykrywanie aldehydów i ketonów:
W celu wykrycia grupy aldehydowej lub ketonowej przeprowadza się reakcję z ,-dinitrofenylohydrazyną, pozwalającą na stwierdzenie obecności jednej z tych grup. Powstały w wyniku tej reakcji żółtopomarańczowy lub czerwony osad jest pozytywnym wynikiem próby.
RmGvMyoqwzGPx 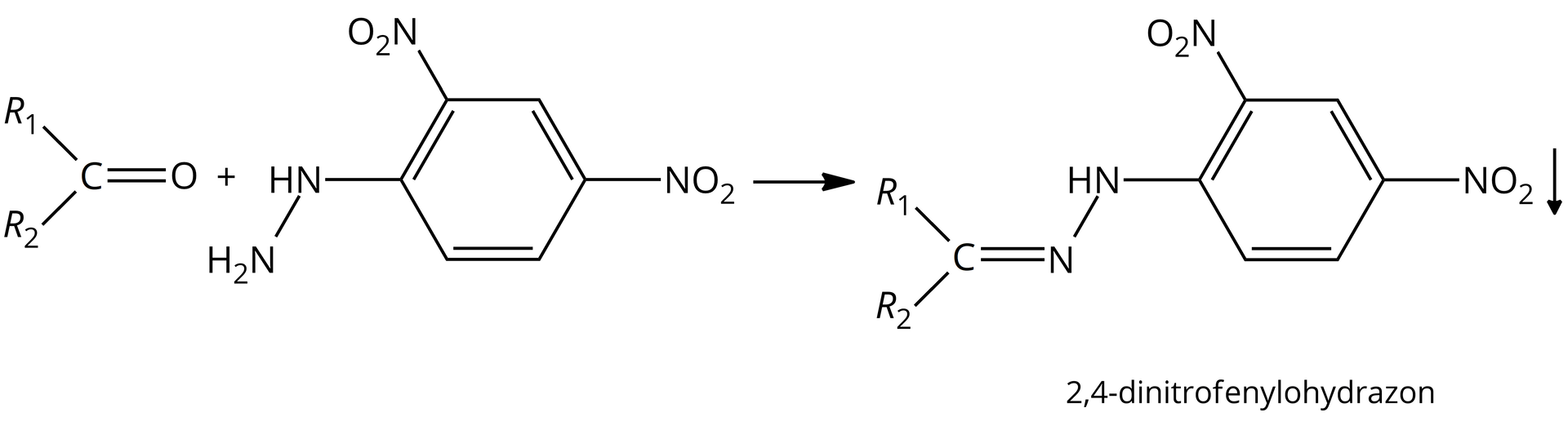 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.W celu wykrycia aldehydów można przeprowadzić np. próbę Tollensa. Polega ona na redukcji odczynnika Tollensa do metalicznego srebra („próba lustra srebrowego”), która jest możliwa dzięki właściwościom redukującym aldehydów.
W celu wykrycia ketonów można przeprowadzić próbę haloformową, w wyniku której ketony ulegają utlenieniu do kwasów karboksylowych. Jeśli do reakcji wykorzysta się jod, będzie to próba jodoformowa.
Pozytywny wynik próby daje wytrącenie się drobnego krystalicznego osadu jodoformu (trijodometanu) o specyficznym zapachu. Warto zaznaczyć, że nie każdy związek zawierający grupę ketonową ulega tej reakcji. Nie ulegają jej np. związki, w których grupą jest grupa hydroksylowa, aminowa lub halogenkowa. Ponadto reakcji tej mogą ulegać także alkohole drugorzędowe.
Wykrywanie alkoholi
Alkohole można wykryć przy zastosowaniu mieszaniny metawanadanu(V) amonu () z 8‑hydroksychinoliną, która tworzy z alkoholami kompleks o czerwonym zabarwieniu.
Inną możliwą próbą jest próba Lucasa, która pozwala określić rzędowość alkoholu. Jest to reakcja z kwasem solnym w obecności chlorku cynku. W efekcie powstaje zmętnienie, którego szybkość pojawienia się zależy od rzędowości alkoholu – dla -rzędowych jest ono natychmiastowe, dla drugorzędowych pojawia się po dłuższej chwili, z kolei dla I‑rzędowych reakcja nie zachodzi w opisanych warunkach, ponieważ mieszanina wymaga dodatkowego ogrzewania.R1MJKvgvK21tr 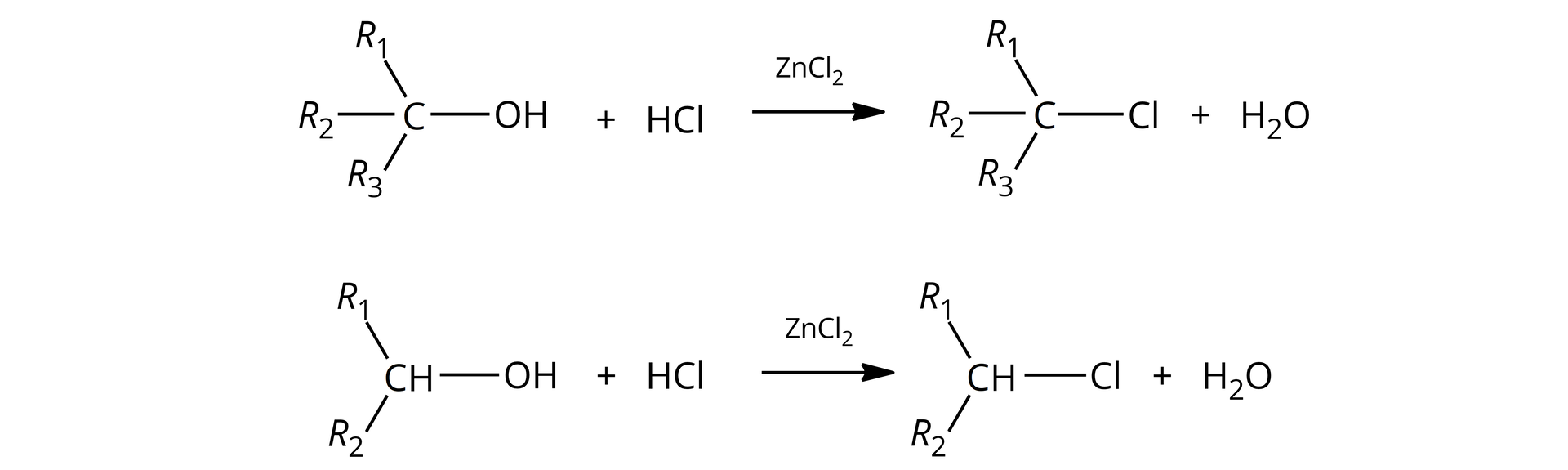 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
5. Klasyfikacja do odpowiedniej grupy związków chemicznych
Wykorzystując w laboratorium chemicznym wyżej opisane metody (punkty -), jesteśmy w stanie zaklasyfikować badaną przez nas substancję organiczną do odpowiedniej grupy związków chemicznych.
Dla zainteresowanych
Metody spektroskopowe i spektrometria mas
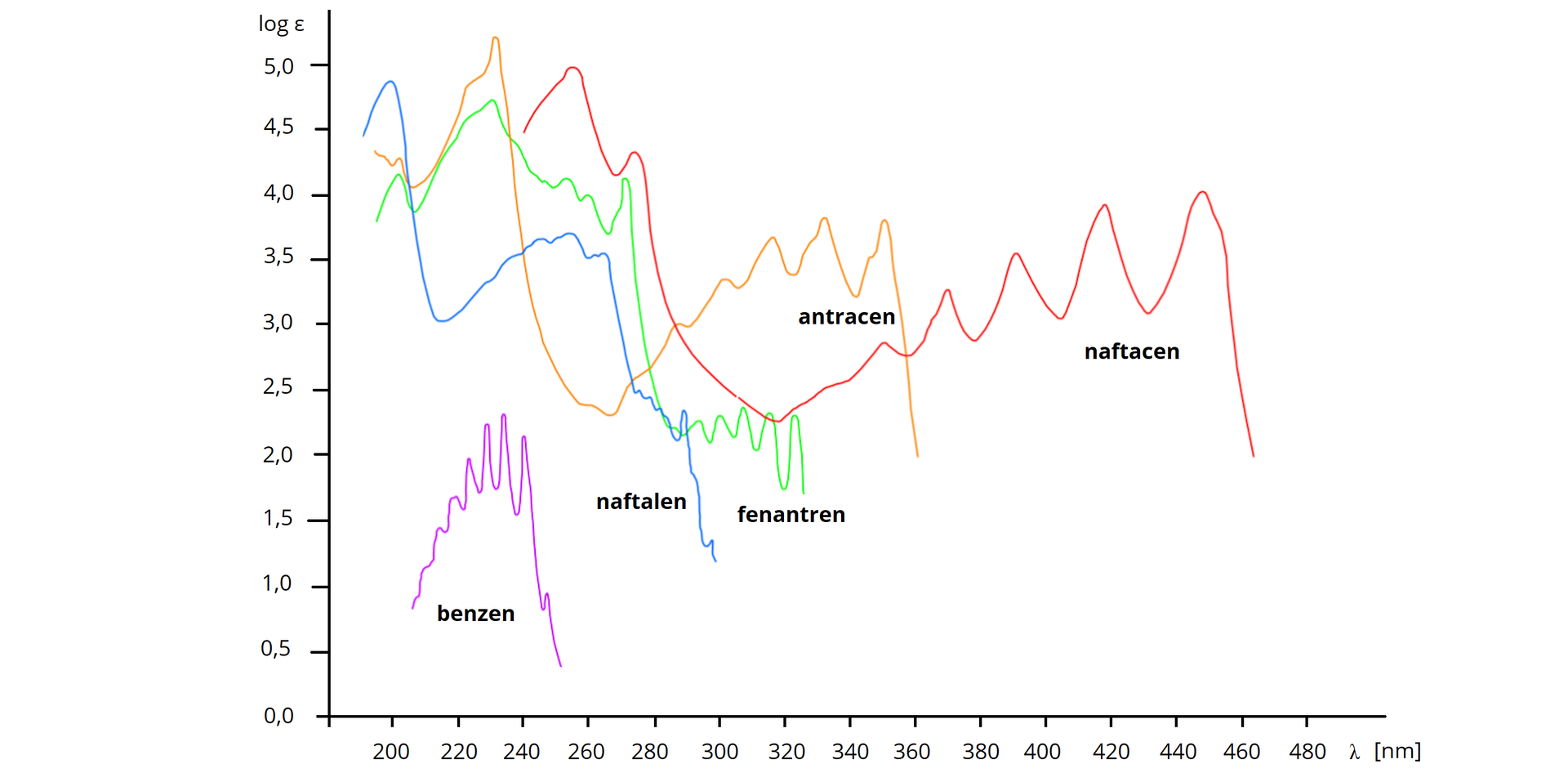
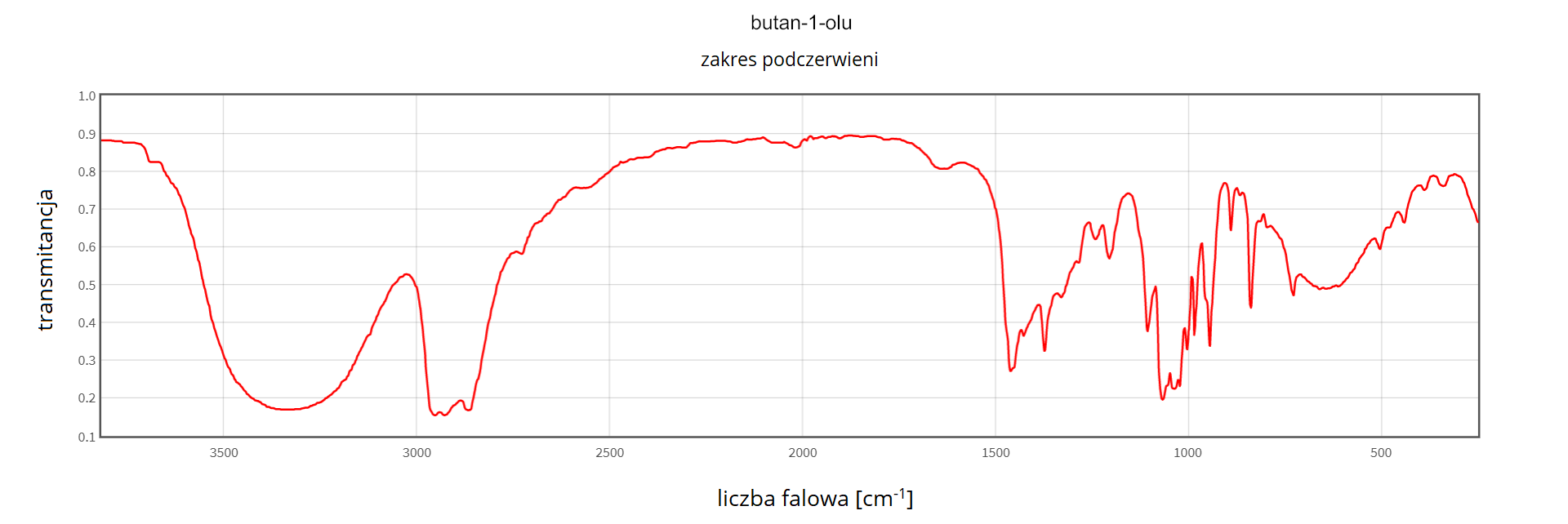
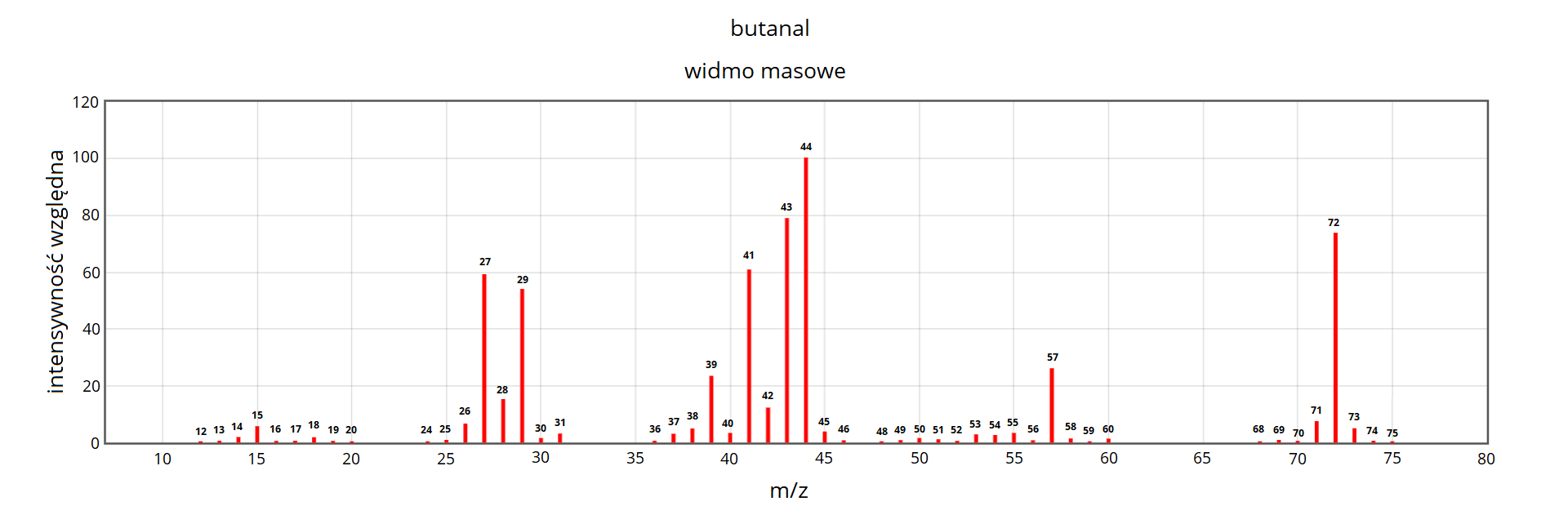
Szeroki obszar różnych technik analizy chemicznej zajmuje się badaniem oddziaływania promieniowania elektromagnetycznego z materią. Określenie składu chemicznego danej substancji możliwe jest na podstawie emitowanego lub pochłoniętego (absorbowanego) przez nią promieniowania o określonej długości fali. Spektroskopia zajmuje się więc mierzeniem i interpretowaniem widmwidm promieniowania elektromagnetycznego w różnych zakresach jego energii jako efektu oddziaływania z badaną substancją.
Poniżej opisano krótko niektóre rodzaje widm wybranych związków chemicznych. Kliknij na interesujący Cię kafelek i sprawdź, jak wygląda i jakie informacje niesie ze sobą dany rodzaj widma.
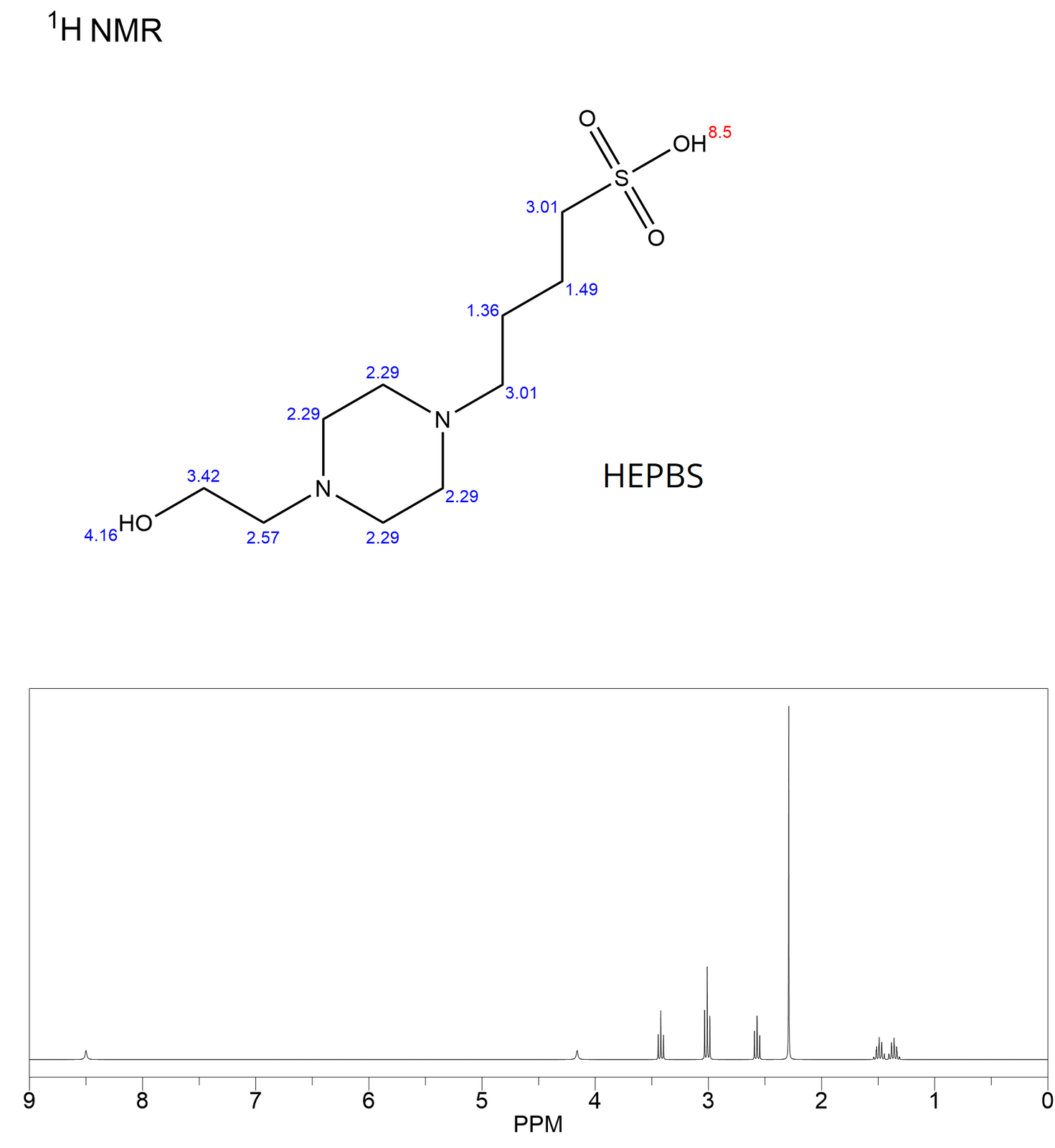
“Jedną z najważniejszych metod fizykochemicznych stosowanych do badania struktury związków organicznych jest spektroskopia magnetycznego rezonansu jądrowego,
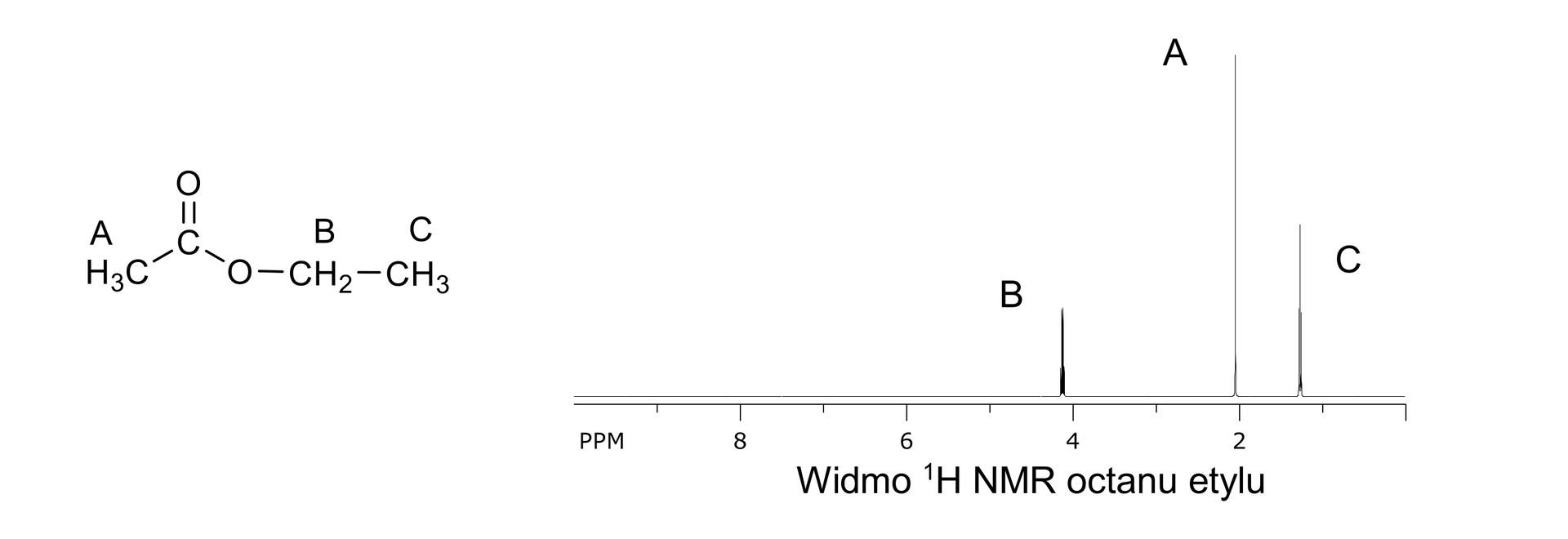
Liczba sygnałów w widmie jest równa liczbie grup równocennych atomów wodoru w cząsteczce związku. Przykładowo – w cząsteczce octanu etylu obecne są trzy grupy równocennych atomów wodoru: dwie różne grupy
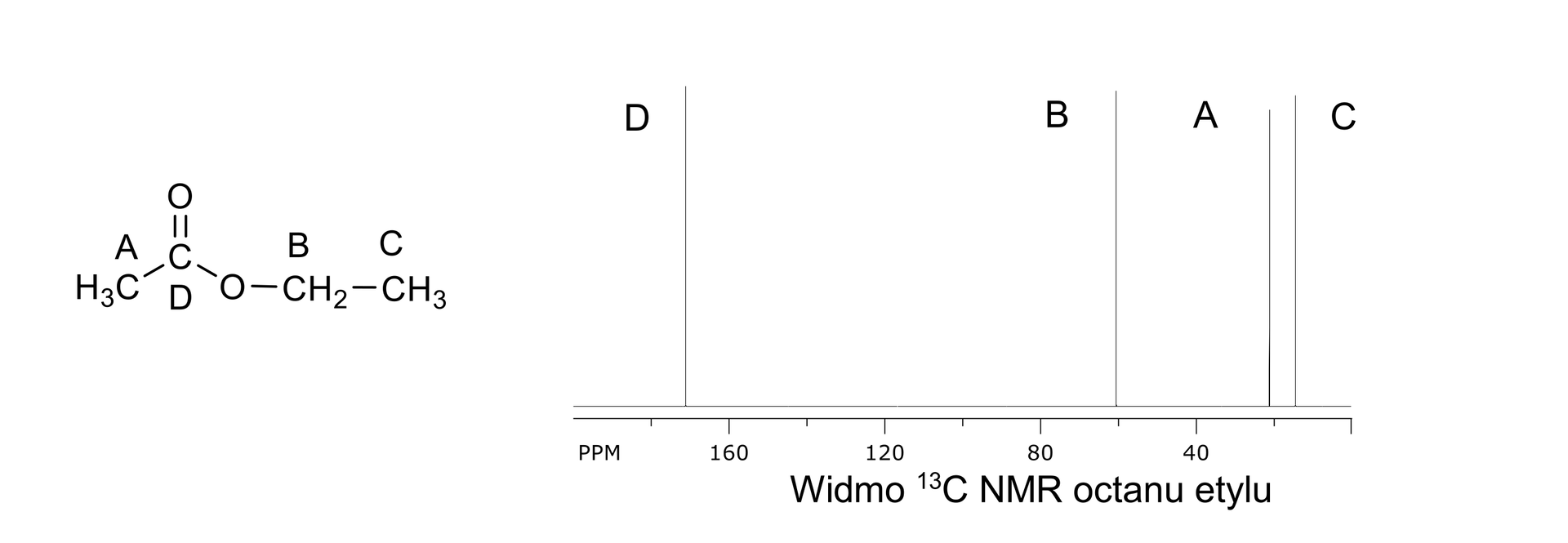
W cząsteczce octanu etylu są cztery nierównocenne atomy węgla, w związku z czym w widmie
Indeks górny Źródło: INFORMATOR o egzaminie maturalnym z chemii od roku szkolnego 2022/2023, Centralna Komisja Egzaminacyjna, Warszawa 2021, s. 87 Indeks górny koniecŹródło: INFORMATOR o egzaminie maturalnym z chemii od roku szkolnego 2022/2023, Centralna Komisja Egzaminacyjna, Warszawa 2021, s. 87
Uczeń otrzymał od nauczyciela widma
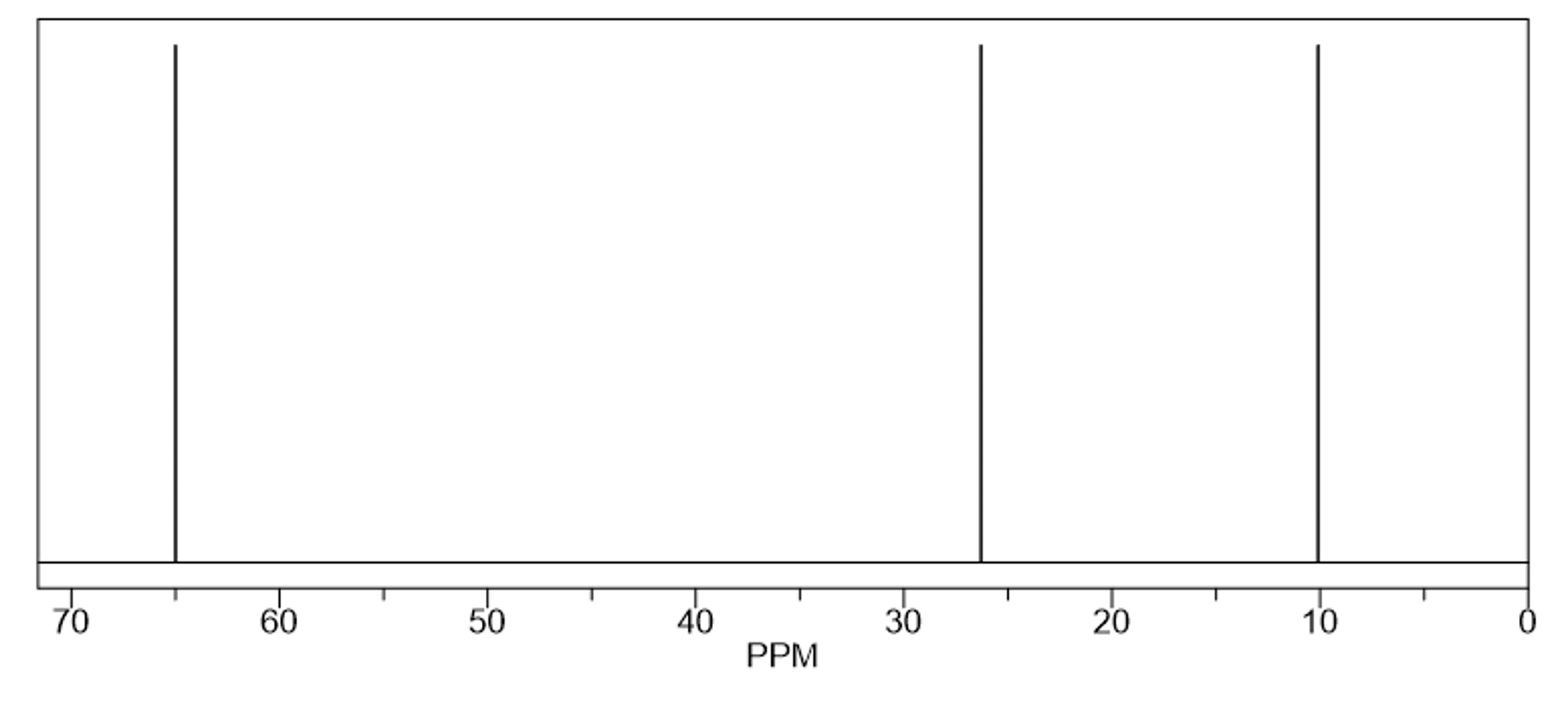
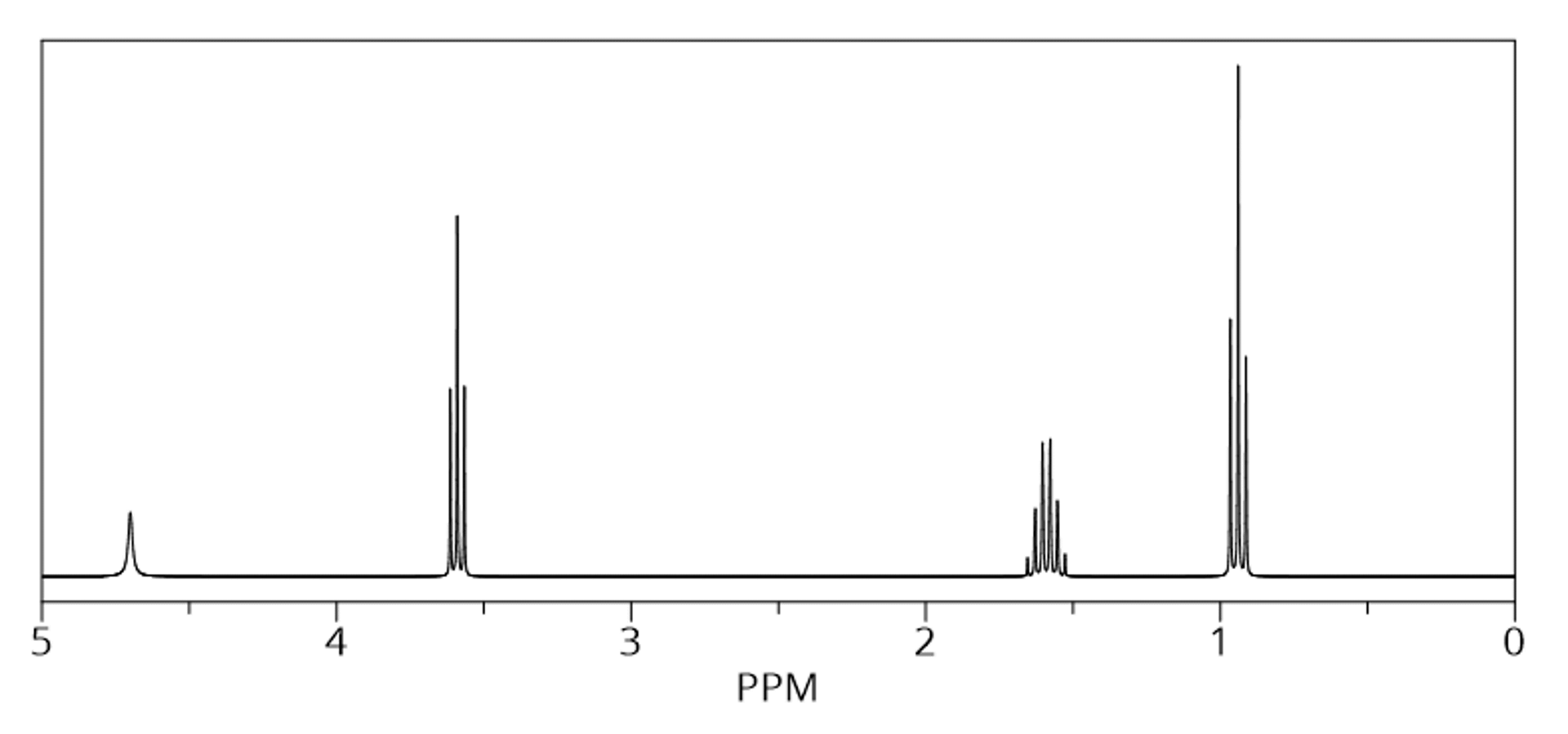
Poniżej zamieszczono nazwy czterech związków chemicznych:
A. Na podstawie analizy powyższych widm ustal, który z powyższych związków
A. Na podstawie analizy powyższych widm ustal, który z powyższych związków
B. Określ, ile sygnałów należałoby się spodziewać w widmach
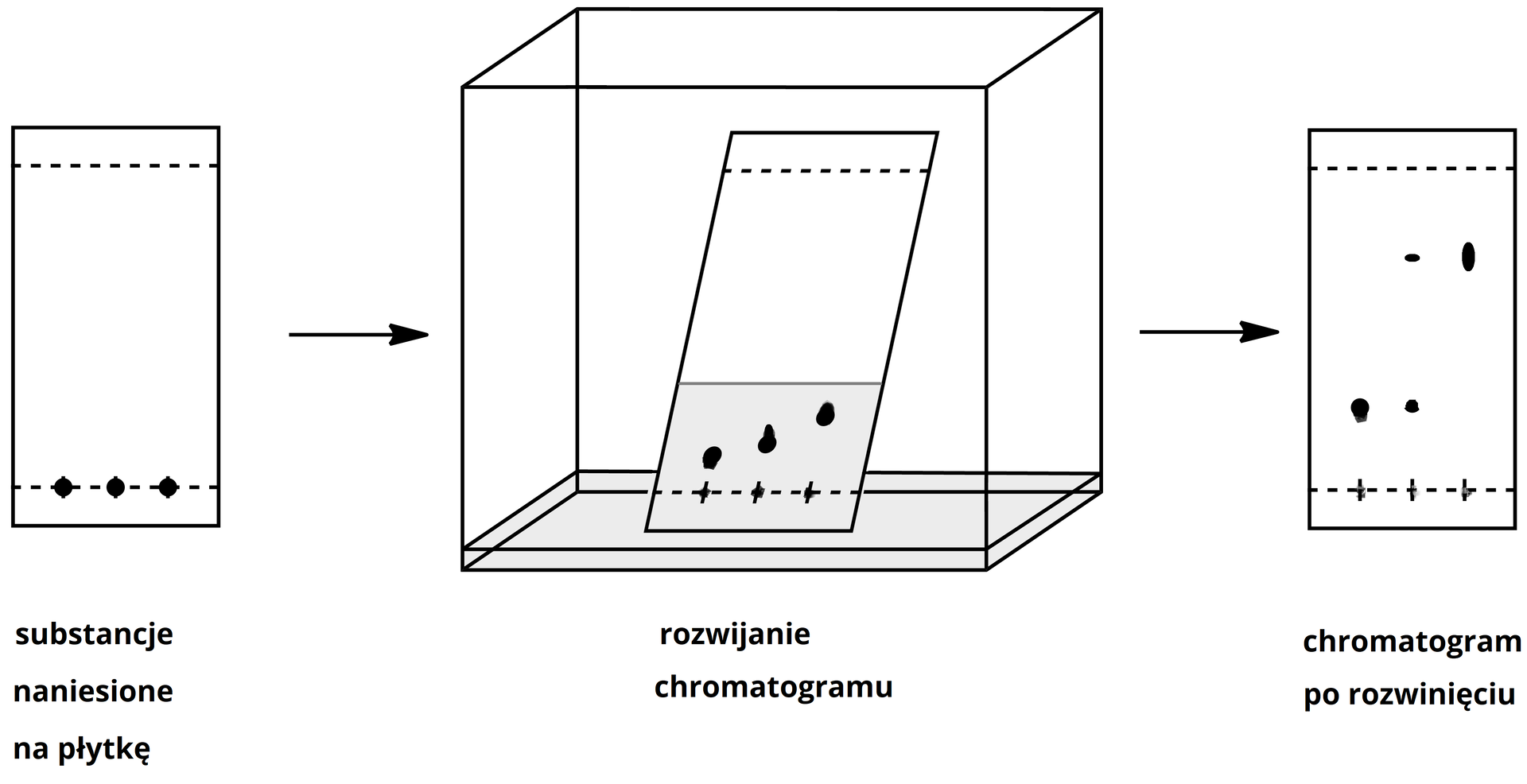
Rozdzielanie mieszanin związków organicznych przy użyciu metod chromatograficznych
Techniki chromatograficzne (chromatografia gazowa, chromatografia cieczowa (kolumnowa, HPLC), chromatografia cienkowarstwowa TLC) pozwalają na sprawdzenie, czy dana substancja jest czysta, czy może jest mieszaniną kilku różnych związków. Ponadto, stosując specyficzne techniki rozdziału chromatograficznego, można dokonać rozdziału mieszaniny substancji, co w efekcie prowadzi do oczyszczenia analizowanego związku chemicznego. Techniki te bazują na prawie podziału Nerstaprawie podziału Nersta i adsorpcji substancji na nośniku.
Rozdzielane składniki mieszaniny charakteryzuje różnica w ich oddziaływaniu z dwiema fazami przemieszczającymi się względem siebie. Poszczególne składniki migrują z różną prędkością wraz z fazą ruchomą (gaz lub ciecz), która jest w kontakcie z fazą nieruchomą (ciało stałe lub ciecz na odpowiednim nośniku), i w ten sposób następuje ich rozdział.
Słownik
przyrząd do wyznaczania temperatury topnienia i krzepnięcia związków chemicznych
w stanie równowagi dynamicznej stosunek stężeń substancji rozpuszczonej w dwóch niemieszających się rozpuszczalnikach (np. wodzie i węglowodorze) jest wielkością stałą w danej temperaturze
emisyjne i absorpcyjne widmo liniowe (np. widmo opt.) powstające w wyniku przejścia swobodnych lub słabo między sobą oddziałujących atomów z jednego poziomu energ. do drugiego
Bibliografia
Cmiel‑Szukiewicz E., Kijowska D., Zarzycka‑Niemiec I., Laboratorium chemii organicznej, Rzeszów 2010.
Encyklopedia PWN
Milart P., Ćwiczenia laboratoryjne z chemii organicznej dla studentów neurobiologii, biofizyki, bioinformatyki, zaawansowanych materiałów nanotechnologii oraz biologii. Kurs podstawowy, 2012, online: http://www2.chemia.uj.edu.pl/%7Ezcho/dydaktyka/biofiz2012.pdf (dostęp: 30.05.2021).
Siedlecka R., Mucha A., Analiza jakościowa związków organicznych, Wrocław 2018, online: http://bioorganic.ch.pwr.wroc.pl/images/0/0d/CHO_analiza.pdf (dostęp: 30.05.2021).