Przeczytaj
Polihydroksyaldehydy i polihydroksyketony
Monosacharydy (cukry proste) dzielą się na:
polihydroksyaldehydypolihydroksyaldehydy (aldozy), które w cząsteczce zawierają więcej niż jedną grupę hydroksylową (-OH) i grupę aldehydową (-CHO); przykładem jest glukoza;
polihydroksyketonypolihydroksyketony (ketozy), które w cząsteczce zawierają więcej niż jedną grupę hydroksylową (-OH) i grupę ketonową (-CO-); przykładem jest fruktoza.
Klasyfikacja monosacharydów
Podział monosacharydów, uwzględniający liczbę atomów węgla w cząsteczce, pozwala wyróżnić:
triozy – zawierają trzy atomy węgla;
tetrozy – zawierają cztery atomy węgla;
pentozy – zawierają pięć atomów węgla;
heksozy – zawierają sześć atomów węgla.
Monosacharyd, zawierający sześć atomów węgla, będący aldozą, to aldoheksoza, a taki, który zawiera pięć atomów węgla i jest ketozą, to ketopentoza.
Wzory Fischera (łańcuchowe)
Wszystkie węglowodany zawierają chiralne atomy węglachiralne atomy węgla, dlatego konieczna jest standardowa metoda opisu tych związków chemicznych, umożliwiająca przedstawienie stereochemiistereochemii. Najczęściej używana metoda to projekcja Fischera, która umożliwia przedstawienie struktury centrów stereogenicznych na płaszczyźnie. We wzorze Fischera chiralny atom węgla przedstawiony jest przez dwie skrzyżowane linie. Linia pozioma odpowiada wiązaniom wychodzącym przed płaszczyznę, a pionowa – wchodzącym za płaszczyznę.
Zapisując konfiguracje łańcuchowe monosacharydów za pomocą wzorów Fischera, należy:
pierwszy atom węgla narysować na górze (zgodnie z numeracją obowiązującą podczas nazywania związków chemicznych, tzn. aldozy: atom węgla, tworzący grupę aldehydową, jest pierwszym atomem węgla; ketozy: atom węgla, tworzący grupę ketonową, ma posiadać jak najwyższy lokant);
kolejne atomy węgla zapisywać pionowo;
ponumerować atomy węgla od góry do dołu;
podstawniki rozmieścić po obu stronach łańcucha węglowego.
Poniżej przedstawiono wzór Fischera D‑glukozy (grupa –OH znajduje się po prawej stronie przy ostatnim asymetrycznym atomie węgla) oraz jej enancjomeruenancjomeru, czyli L‑glukozy (grupa –OH znajduje się po lewej stronie przy ostatnim asymetrycznym atomie węgla).
W podobny sposób, za pomocą wzorów Fischera, można przedstawić enancjomery fruktozy, czyli D‑fruktozę i L‑fruktozę.
Wzory Hawortha (taflowe)
Aldehydy i ketony mogą ulegać szybkiej i odwracalnej reakcji addycji nukleofilowejaddycji nukleofilowej z alkoholami, w wyniku czego tworzą się hemiacetale, zgodnie ze schematem:
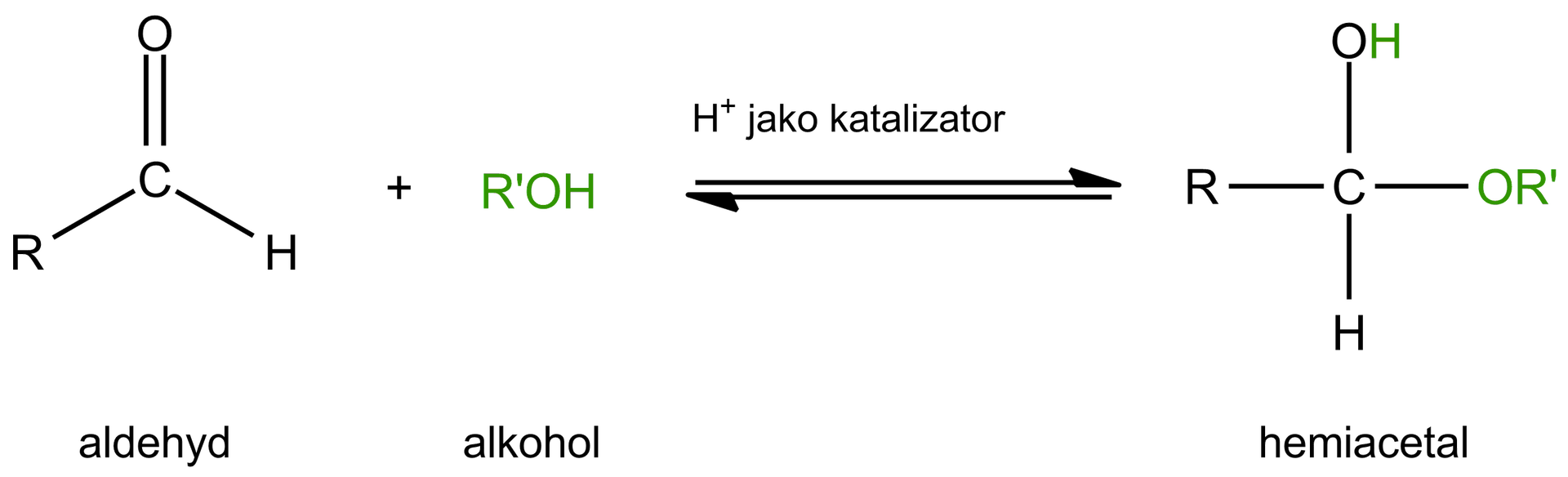
W sytuacji, gdy grupa karbonylowa i hydroksylowa znajdują się w jednej cząsteczce, może dojść do wewnątrzcząsteczkowej addycji nukleofilowej, co doprowadzi do utworzenia cyklicznego hemiacetalu. Hemiacetale cykliczne pięcio- i sześcioczłonowe są szczególnie trwałe ze względu na fakt, że przyjmują konformacje wolne od naprężeń kątowych.
Wzór Hawortha D‑glukozy
Gdy przechodzi się od projekcji Fischera do projekcji Hawortha, należy cząsteczkę cukru obrócić na bok (etap 1 i 2 na schemacie), a następnie ułożyć tak, aby pierwszy atom węgla był w prawym górnym rogu (etap 3 na schemacie). Pozostałe atomy węgla numeruje się od C1, zgodnie z ruchem wskazówek zegara, natomiast należące do nich podstawniki umieszcza się pod płaszczyzną pierścienia – jeśli we wzorze Fischera były po prawej stronie – lub nad płaszczyzną pierścienia – jeśli we wzorze Fischera były po lewej stronie. W kolejnym etapie należy dokonać obrotu wiązań wokół przedostatniego atomu węgla tak, aby umożliwić utworzenie wiązania pomiędzy grupą hydroksylową przedostatniego atomu węgla a karbonylowym atomem węgla (etap 4 na schemacie). Końcowa grupa -CHIndeks dolny 22OH jest zawsze skierowana do góry w projekcji Hawortha dla D‑cukrów, natomiast w dół dla L‑cukrów. Następnie dochodzi do nukleofilowego ataku pary elektronowej atomu tlenu grupy hydroksylowej na karbonylowy atom węgla, w wyniku czego powstaje pierścień (etap 5 na schemacie).
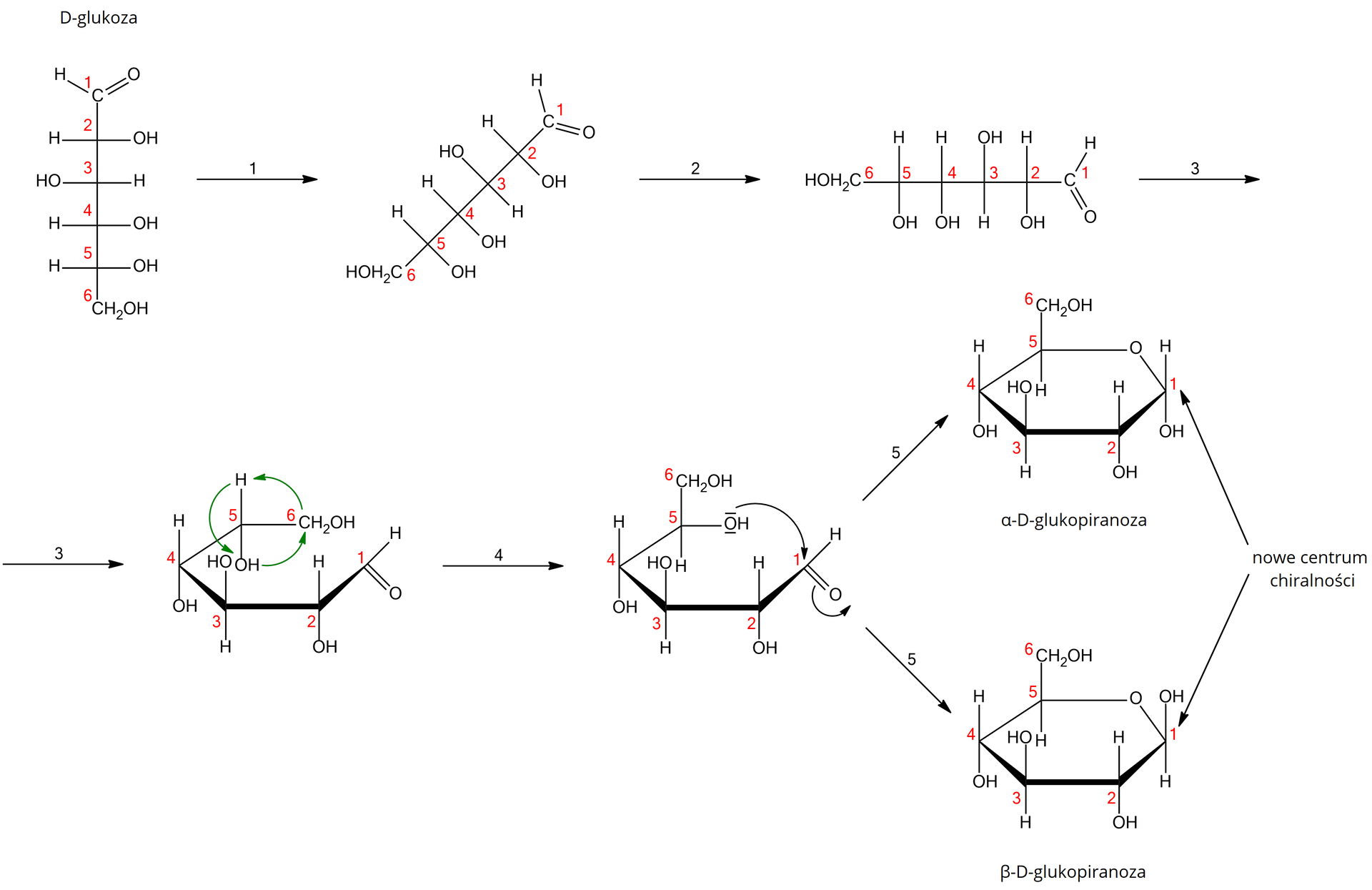
Gdy monosacharyd o otwartym łańcuchu zamyka się w formę cykliczną, powstaje nowe centrum chiralnościcentrum chiralności – atom węgla, przy którym znajdował się atom tlenu, posiada teraz dołączoną grupę hydroksylową i nazywa się anomerycznym atomem węgla. Grupa hydroksylowa, dołączona do anomerycznego atomu węgla, może być skierowana w dół (anomer alfa) lub w górę (anomer beta). W przypadku zamiany formy Fischera D‑glukozy na formę Hawortha, otrzymujemy pierścień sześcioczłonowy, nazywany piranozą. Po zamknięciu pierścienia otrzymuje się dwa anomery: alfa‑D-glukopiranozę i beta‑D-glukopiranozę.
Anomery D‑glukozy

Wzór Hawortha D‑fruktozy
Przekształcając wzór Fischera D‑fruktozy na wzór Hawortha, otrzymujemy pięcioczłonowy pierścień zwany furanozą. W zależności od położenia grupy –OH przy anomerycznym atomie węgla, możemy wyróżnić dwie formy monosacharydu: alfa‑D-fruktofuranozę (gdy grupa –OH znajduje się pod płaszczyzną pierścienia) oraz beta‑D-fruktofuranozę (gdy grupa –OH znajduje się nad płaszczyzną pierścienia).

Słownik
cukier prosty, w cząsteczce którego występuje grupa aldehydowa
cukier prosty, w cząsteczce którego występuje grupa ketonowa
atom węgla połączony z czterema różnymi podstawnikami
centrum chiralności, czyli atom węgla związany z czterema różnymi podstawnikami
dział chemii, którego zadaniem jest badanie trójwymiarowej struktury cząsteczek
stereoizomer, lustrzane odbicie cząsteczki posiadającej przynajmniej jedno centrum stereogeniczne
reakcja chemiczna typu addycji, która polega na przyłączeniu reagenta nukleofilowego (anion lub cząsteczka posiadająca nadmiar elektronów) do czynnika elektrofilowego (kation lub cząsteczka posiadająca niedomiar elektronów)
Bibliografia
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura. Vademecum, Warszawa 2015.
Litwin M., Styka‑Wlazło S., Szymońska J., To jest chemia 2, Warszawa 2016.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, tłum. Wiesław Antkowiak i in., Warszawa 1985.
McMurry J., Chemia organiczna, t. 4, tłum. Henryk Koroniak i in., Warszawa 2018.