Przeczytaj
Wskaźniki kwasowo‑zasadowe
Wskaźniki kwasowo‑zasadoweWskaźniki kwasowo‑zasadowe, inaczej nazywane wskaźnikami , to związki organiczne o złożonej budowie. W zależności od roztworu, mogą zmieniać swoją barwę. Związane jest to z tym, że formy zdysocjowane i niezdysocjowane tych substancji organicznych mają różne barwy.
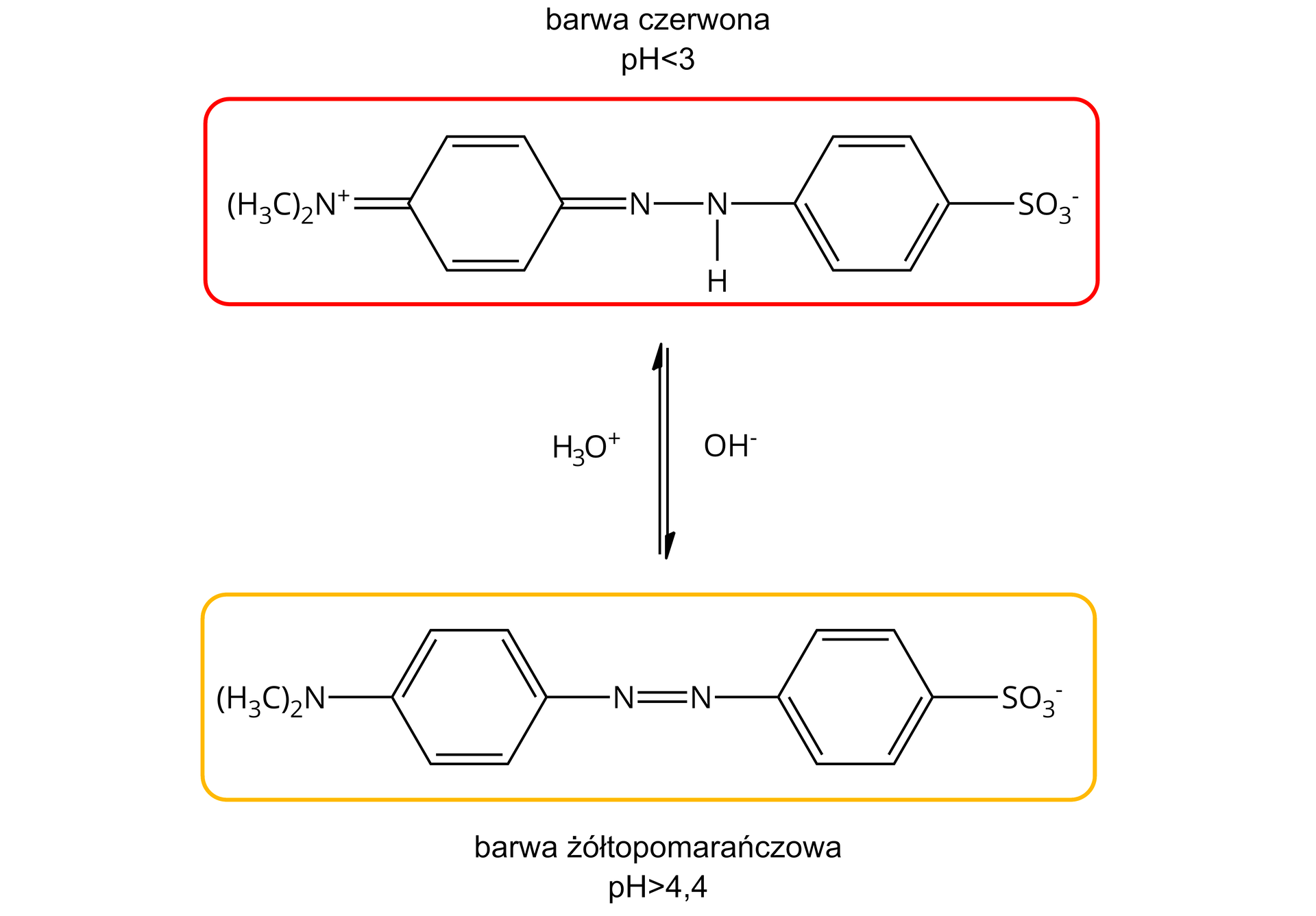
Oranż metylowy
Najczęściej stosowanym wskaźnikiem do wykrycia roztworów o odczynie kwasowym jest oranż metylowy. A to dlatego, że w roztworze o odczynie kwasowym oranż metylowy ma barwę czerwoną. W roztworach o odczynie obojętnym przyjmuje barwę pomarańczową. Wprowadzenie go do roztworu o zasadowym odczynie powoduje zmniejszenie intensywności barwy.

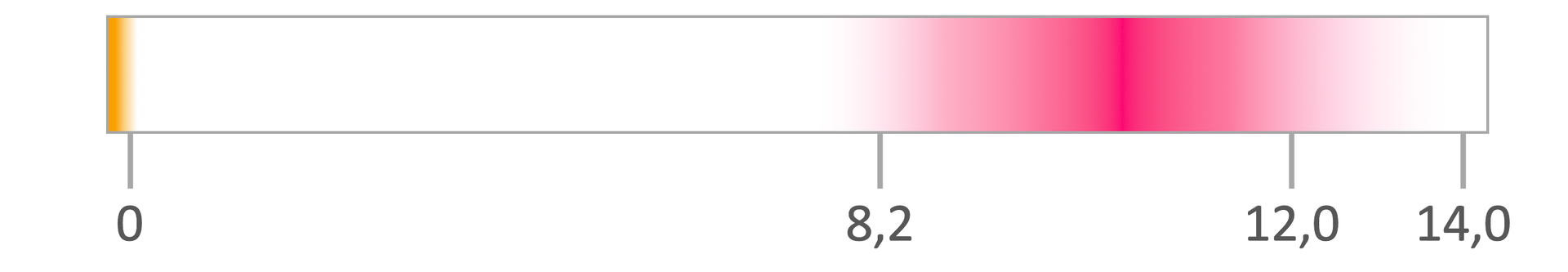
Zakres pH zmiany barwy tego wskaźnika to od około do około . Zatem poniżej około przyjmuje czerwone zabarwienie, a powyżej około – żółtopomarańczowe.

Fenoloftaleina
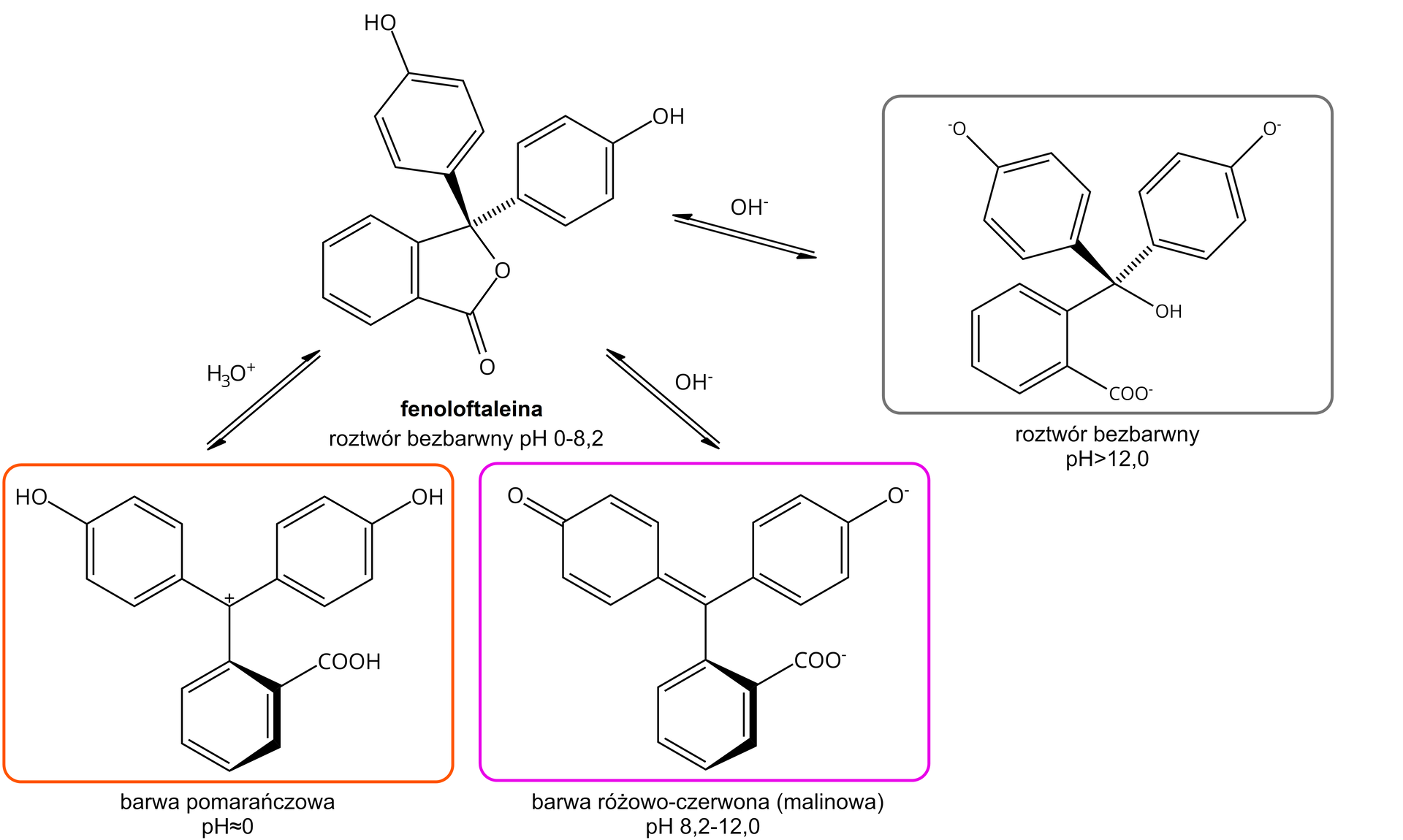
Najczęściej stosowanym wskaźnikiem do wykrywania roztworów o odczynie zasadowym jest fenoloftaleina.
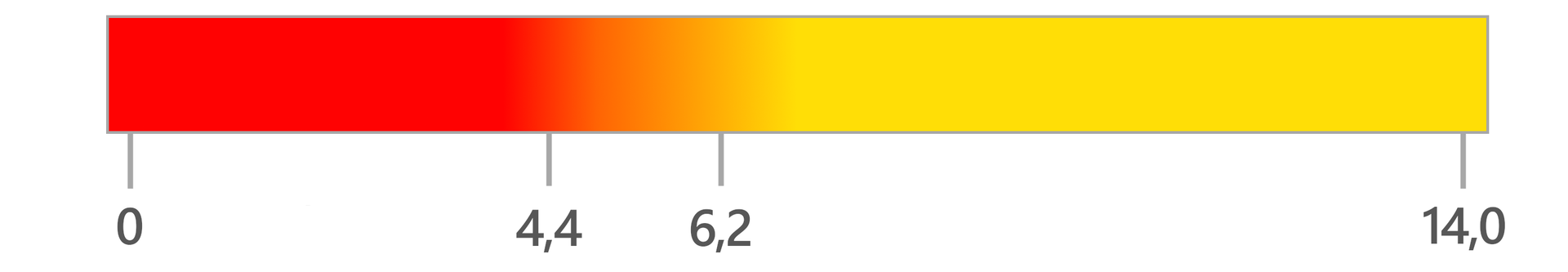
Fenoloftaleina jest bezbarwna w zakresie od około do około . W zakresie około do około (roztwór zasadowy) można zaobserwować wyraźną zmianę zabarwienia fenoloftaleiny z bezbarwnej na malinową. Najintensywniejszą barwę malinową zaobserwujemy dla około . Powyżej pH 12,0 roztwór stopniowo traci swoje zabarwienie i staje się bezbarwny w około .
Oznacza to, że gdy do roztworu o odczynie kwasowym lub obojętnym doda się fenoloftaleiny, to nie zaobserwuje się zmiany jej barwy. Wyjątkiem są jednak silnie kwasowe roztwory (np. stężonego kwasu siarkowego()), które posiadają równe lub mniejsze od . W ich przypadku fenoloftaleina zabarwia się na pomarańczowo.
Tymoloftaleina
Tymoloftaleina, podobnie jak fenoloftaleina, to wskaźnik, dzięki któremu można rozpoznać roztwór o odczynie zasadowym. Dzieje się tak, ponieważ wskaźnik ten jest bezbarwny w zakresie od około do około . Zakres zmiany barwy wskaźnika przypada na od około do około . Powyżej około przyjmuje niebieską barwę.

Błękit tymolowy
Błękit tymolowy to wskaźnik, który ma dwa zakresy zmiany barwy. Poniżej przyjmuje czerwone zabarwienie. Pierwszym zakresem zmiany barwy jest od około do około – w tym zakresie wskaźnik zmienia barwę z czerwonej na żółtą. Barwa ta utrzymuje się w od około do około . Drugim zakresem zmiany barwy jest od około do około – w tym wypadku wskaźnik zmienia barwę z żółtej na niebieską. Powyżej błękit tymolowy przyjmuje niebieską barwę.

Błękit bromotymolowy
Błękit bromotymolowy to wskaźnik będący pochodną błękitu tymolowego. Poniżej około , barwi się na kolor żółty. Między około a około występuje zmiana barwy z żółtej na niebieską – jest to zakres zmiany barwy. W tym przedziale roztwór przyjmuje zielone zabarwienie. Natomiast powyżej około roztwór przybiera barwę niebieską.

Błękit bromofenolowy
Błękit bromofenolowy to wskaźnik, który poniżej około przyjmuje barwę żółtą. Zakres zmiany barwy występuje pomiędzy około a około . Oznacza to, że powyżej około błękit bromofenolowy barwi się na kolor niebieskofioletowy.

Czerwień metylowa
Czerwień metylowa to wskaźnik, który w około ma barwę czerwoną, a powyżej około ma barwę żółtą. Zatem zmiana barwy z czerwonej na żółtą następuje w zakresie około a około .
Czerwień Kongo
Czerwień Kongo to wskaźnik, który poniżej około ma barwę niebieską. Zmiana barwy z niebieskiej na czerwoną następuje w zakresie od około do około . Oznacza to, że powyżej około wskaźnik ten barwi się na kolor czerwony.

Lakmus
Lakmus to wskaźnik, który – odwrotnie do czerwieni Kongo – zmienia barwę z niebieskiej na czerwoną. Zmiana zakresu barwy przypada na od około do około . Wynika z tego, że lakmus w roztworach o odczynie kwasowym będzie się barwił na kolor czerwony, a w roztworach zasadowych na kolor niebieski.

Tabela przedstawia zakres zmian barwy wybranych wskaźników kwasowo‑zasadowych.
Na poziomie szkolnym, do określania stosuje się głównie roztwory oranżu metylowego oraz fenoloftaleiny, dlatego ważne jest zapamiętanie zakresów , w których zachodzi zmiana barw tych wskaźników.
Nazwa wskaźnika | Zakres zmiany barwy | Barwa wskaźnika poniżej niższej wartości | Barwa wskaźnika powyżej wyższej wartości |
|---|---|---|---|
Oranż metylowy | czerwona | żółta | |
Tymoloftaleina | bezbarwna | niebieska | |
Fenoloftaleina | bezbarwna | malinowa | |
Błękit tymolowy | czerwona | żółta | |
żółta | niebieska | ||
Błękit bromotymolowy | żółta | niebieska | |
Błękit bromofenolowy | żółta | niebieskofioletowa | |
Czerwień metylowa | czerwona | żółta | |
Czerwień Kongo | niebieska | czerwona | |
Lakmus | czerwona | niebieska |
Uniwersalne papierki wskaźnikowe
Bardzo popularnym rozwiązaniem określania przybliżonej wartości roztworów jest stosowanie uniwersalnych papierków wskaźnikowych. Są to paski bibuły, nasączone mieszaniną wskaźników. Wskaźniki te mają określone barwy dla danego . Aby określić przybliżoną wartość roztworu, należy posługiwać się wzorcem barw dołączonym do pakowania.
Uniwersalne papierki wskaźnikowe są wykorzystywane przez posiadaczy akwariów w celu sprawdzania pH wody.

Naturalne wskaźniki
Najprostszym naturalnym wskaźnikiem, który znajduje się w każdej kuchni, jest napar z czarnej herbaty. W środowisku o odczynie obojętnym ma barwę jasnobrązową, a w zasadowym ciemnobrązową. Natomiast w środowisku o odczynie kwasowym barwi się na kolor jasnożółty. Zmianę barwy herbaty na jasnożółtą można zaobserwować, dodając do herbaty soku z cytryny (cytryna zakwasza herbatę).
Innym popularnym i naturalnym wskaźnikiem jest wywar z czerwonej kapusty. W silnie kwasowych roztworach wywar przyjmuje barwę czerwoną, w słabiej kwasowych – czerwonofioletową, przy wynoszącym – fioletową. W środowisku obojętnym wywar z czerwonej kapusty przyjmuje barwę niebieskofioletową, a w środowisku zasadowym – niebieskozieloną. W roztworach silnie zasadowych barwi się na żółto.

Jako wskaźniki, mogą także posłużyć: sok z czerwonego buraka, sok z czarnych jagód, kurkuma, sok z wiśni i hibiskus.
Słownik
inaczej wskaźniki ; związki organiczne o złożonej budowie; w zależności od roztworu, mogą zmieniać swoją barwę
zakres , w którym wskaźnik zmienia zabarwienie
Bibliografia
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura. Chemia. Vademecum, Warszawa 2018.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2012.
Roesky H.W., Möckel K., Pecul M., Korecki T., Kolory tęczy, oraz Barwniki roślinne jako wskaźniki uniwersalne, Niezwykły świat chemii, Warszawa 1998.