Przeczytaj
Wolne rodniki
Wolne rodniki, obecnie nazywane rodnikami, to atomy, grupy atomów lub jony, które posiadają niesparowany elektronelektron. Oznacza się je we wzorze znakiem „•”, który symbolizuje, że dane indywiduum posiada niesparowany elektron.
Przykłady rodników
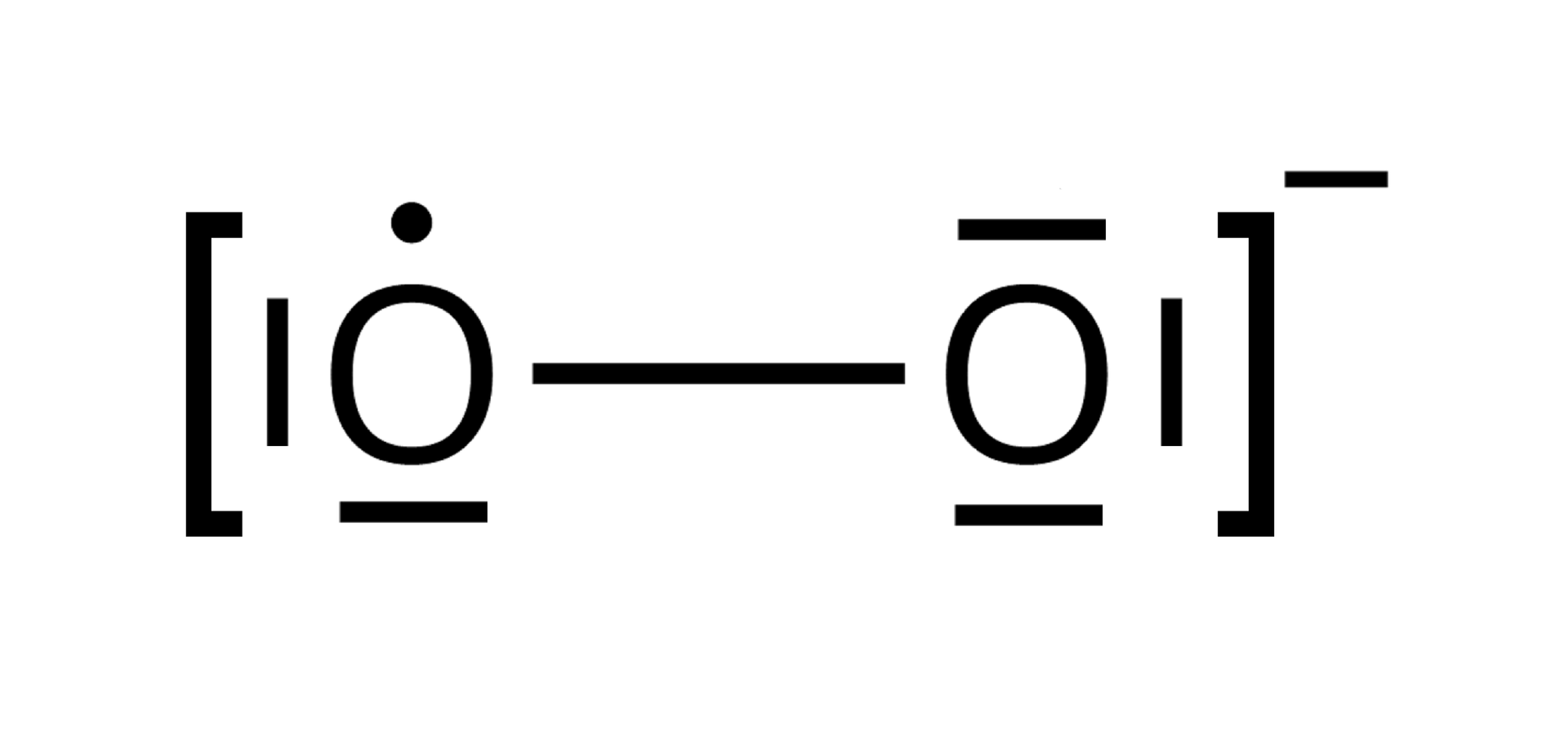
Rodnik ponadtlenkowy jest reaktywną formą tlenu. Powstaje w wyniku redukcji cząsteczki tlenu jednym elektronem. Pomijając elektrony rdzenia obu atomów tlenu, w rodniku ponadtlenkowym znajduje się elektronów. Dzięki utworzeniu pojedynczego wiązania kowalencyjnego, jeden z atomów tlenu formalnie posiada konfigurację stabilną gazu szlachetnego (neonu). Rodniki, które występują w formie jonowej, nazywane są jonorodnikami – kationorodnikami lub anionorodnikami – stąd wspomniana nazwa alternatywna tego rodnika to anionorodnik ponadtlenkowy.
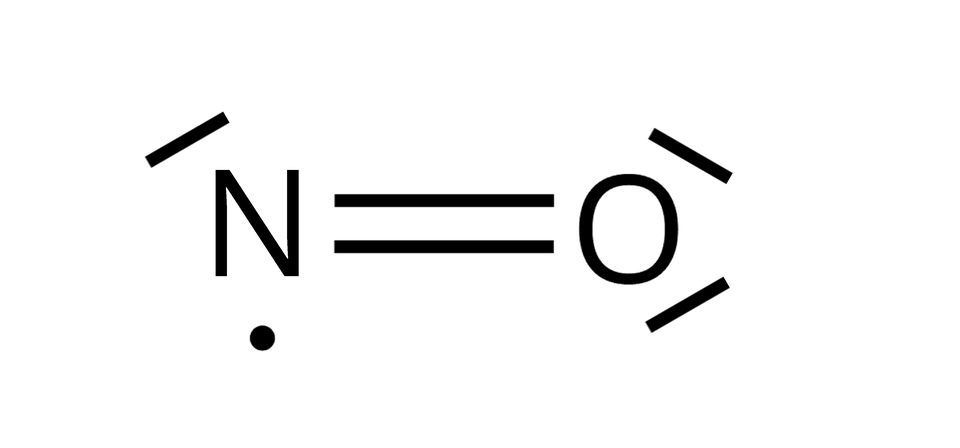
Tlenek azotu() występuje w górnej części atmosfery. Jest rodnikiem, w którym jeden elektron zawsze pozostaje niesparowany. Z tego powodu cząsteczki tlenku azotu() mają zdolność do spontanicznej dimeryzacji z wytworzeniem formy :
Tlenek azotu() to kolejny tlenek azotu, który jest rodnikiem. W cząsteczce tego związku atom azotu tworzy wiązanie podwójne kowalencyjne, spolaryzowane z jednym z atomów tlenu, z kolei z drugim atomem tlenu tworzy wiązanie koordynacyjne, gdzie atom tlenu jest akceptorem tego wiązania. Niesparowany elektron jest obecny na cząsteczce azotu, co powoduje, że cząsteczki tlenku azotu() łatwo dimeryzują, tworząc tetratlenek diazotu, w którym niesparowane elektrony tworzą wiązanie azot‑azot.
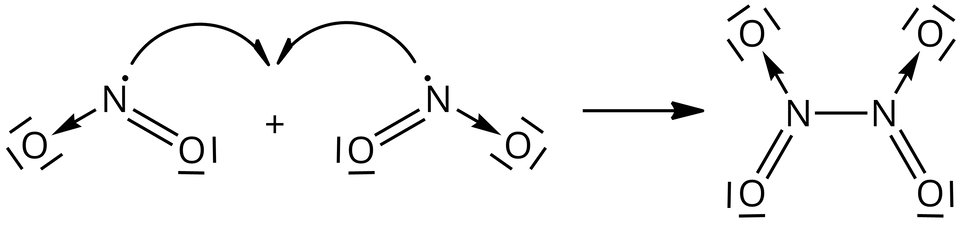
Równowaga chemiczna pomiędzy dimerem a monomerem zależy od temperatury – w niższych temperaturach przeważa dimer, a w wyższych monomer. Przykładowo, w temperaturze około dimery stanowią około mieszaniny tych gazów.
Powstawanie wolnych rodników
Wolne rodniki powstają w wyniku homolitycznegohomolitycznego rozszczepienia wiązania kowalencyjnego lub w wyniku przeniesienia pojedynczego elektronu do, albo z cząsteczki obojętnej.
W przypadku związków organicznych, fotolizie ulegają te związki, które mają możliwość absorbowania promieniowania, czyli takie, które w swojej budowie posiadają wiązania wielokrotne. Związki te nazywane są chromoforami.
Fotolizie ulegają także cząsteczki bromu, jodu czy chloru, w wyniku czego następuje rozpad wiązania tworzącego te cząsteczki z wytworzeniem dwóch rodników. Ilustracja przedstawiająca schemat reakcji fotolizy cząsteczki chloru. Cząsteczka chloru zbudowana z dwóch atomów chloru połączonych wiązaniem pojedynczym i posiadających każdy po trzy wolne pary elektronowe. Od wiązania łączącego oba atomy poprowadzone są dwie strzałki z połową grotu, jedna do pierwszego a druga do drugie atomu chloru. Strzałka w prawo nad strzałką zapis . Za strzałką znajdują się dwa rodniki każdy zbudowany z chloru posiadającego trzy wolne pary elektronowe oraz jeden niesparowany elektron zaznaczony w postaci kropki.
Autor: GroMar Sp. z o. o.; Licencja: CC BY-SA 3.0
Autor: GroMar Sp. z o. o.; Licencja: CC BY-SA 3.0
- przekazaniem elektronu (najczęściej z jonu lub atomu) metalu do cząsteczki organicznej;
- przyjęciem przez atom metalu elektronu, pochodzącego ze związku organicznego.
Jednym z przykładów powstania rodników jest reakcja Fentona. Jest to reakcja jonów żelaza() z nadtlenkiem wodoru, której jeden z etapów przedstawiono poniżej.
Usuwanie wolnych rodników – antyoksydanty
Antyutleniacze (antyoksydanty)Antyutleniacze (antyoksydanty) to związki, które mają na celu degradację wolnych rodników. Degradacja ta w istocie polega na sparowaniu elektronów, które pozostawały niesparowane w strukturze rodnika. Przykładem przeciwutleniacza jest witamina C (kwas askorbinowy), ale także karotenoidy, np. -karoten.


W organizmach żywych występuje równowaga między wolnymi rodnikami a antyutleniaczami. Jednak w wyniku jej zaburzenia, zwiększa się ilość wolnych rodników. Reagują one z białkami, zmieniając ich strukturę, co w konsekwencji może prowadzić do poważnych chorób, m.in. nowotworów, miażdżycy, cukrzycy. W organizmie pełnią one także pozytywne funkcje – przyśpieszają zrost kości, gojenie ran, mają także działanie antybakteryjne.
Wytworzeniu w organizmie większej ilości rodników sprzyjają czynniki, takie jak palenie papierosów, niewłaściwa dieta, spożywanie alkoholu, niestosowanie olejków do opalania – wówczas skóra jest narażona w większym stopniu na promieniowanie UV.
Trwałość wolnych rodników

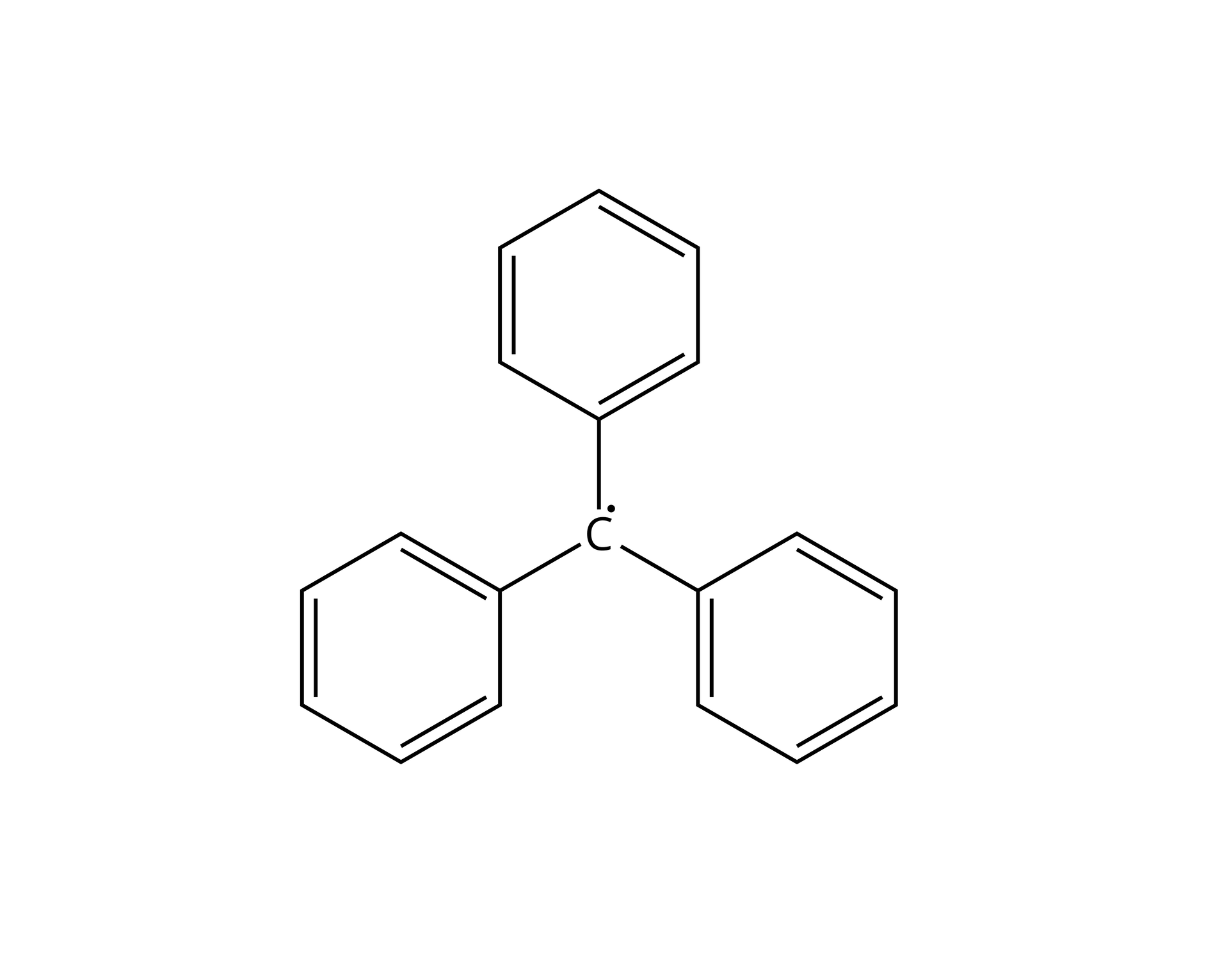
Wolne rodniki są indywiduami chemicznymi o stosunkowo krótkim czasie życia. Pierwszy stabilny rodnik trifenylometyl został odkryty w roku przez Moses Gomberg’a.
Trwałość wielu rodników wynosi od kilku setnych sekundy do kilkunastu sekund. Wynika ona z obecności niesparowanego elektronu. Każde indywiduum dąży do zachowania minimalnej energii. Kiedy atom posiada niesparowany elektron, jest w niekorzystnym stanie energetycznym. Dąży wtedy do przeformowania, w celu uzyskania stabilniejszej postaci. Łączy się to z takim przegrupowaniem elektronów, dzięki któremu powstają formy niebędące rodnikami.
Stwierdzono, że najłatwiej tworzy się rodnik trzeciorzędowy, następnie drugorzędowy i pierwszorzędowy. Razem z łatwością tworzenia się rodników rośnie ich trwałość.
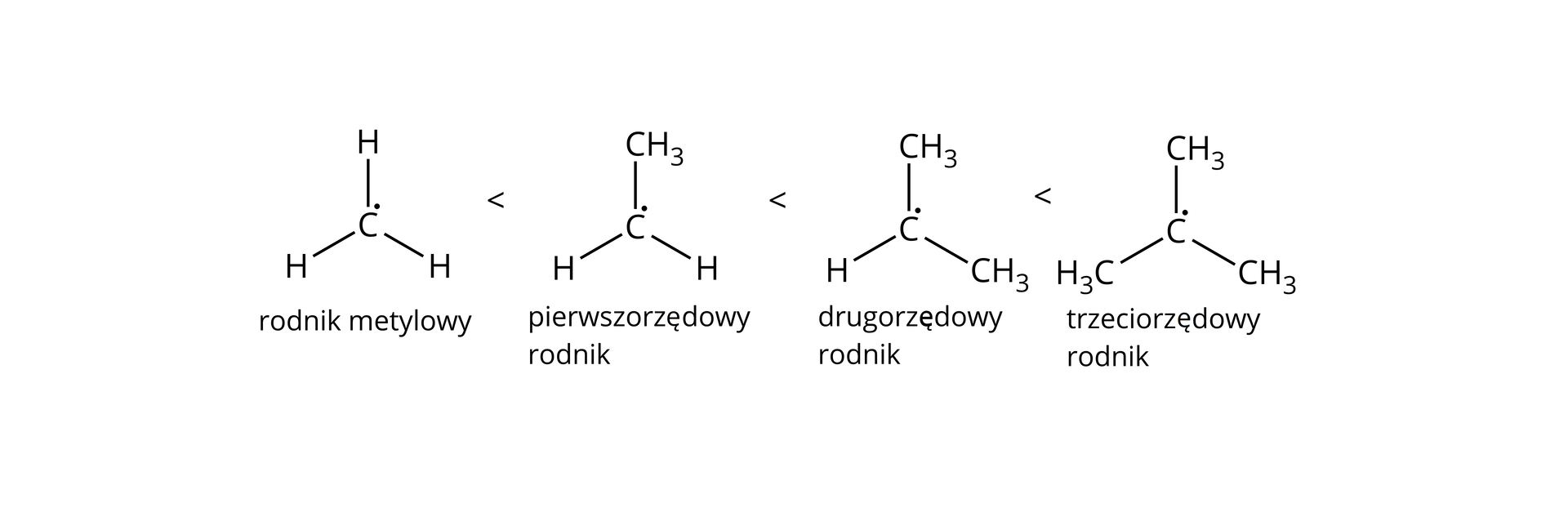
W przypadku rodnika metylowego, łączące się z węglem atomy wodoru nie zapewniają takiej stabilizacji. Wprowadzenie kolejnych grup alkilowych sprawia, że rodnik zaczyna być stabilizowany przez oddziaływanie orbitalu p, posiadającego niesparowany elektron z orbitalami typu sigma () wiązań . Trwałość rodnika rośnie również wraz ze wzrostem długości łańcucha węglowodorowego.
Słownik
związki chemiczne, które dzięki swym właściwościom redukującym zapobiegają utlenianiu się wiązań nienasyconych
(gr. ḗlektron „bursztyn”) cząstka elementarna o masie
() i ładunku elektrycznym
elektrony znajdujące się na najbardziej oddalonej od jądra powłoce elektronowej
(gr. homós „taki sam”, lýsis „rozpuszczenie, rozluźnienie”) rozerwanie wiązania kowalencyjnego w cząsteczce, przebiegające z utworzeniem dwóch atomów lub rodników
rodzaj wiązania chemicznego, polegającego na uwspólnianiu pary lub par elektronowych, w którym elektrony są współdzielone przez dwa pierwiastki
(gr. chrṓma „barwa” phoréō „noszę”) grupa chromoforowa, zgodnie z teorią barwności, ugrupowanie atomów, które w połączeniu z układem sprzężonych wiązań podwójnych w cząsteczkach związków chemicznych jest przyczyną ich barwy
Bibliografia
Duffy S. J., VanLoon G., Chemia środowiska, Warszawa 2007.
Encyklopedia PWN
Jackson R. A. Mechanizmy reakcji organicznych tłum. H. Korniak i in., Warszawa 2007.
Mastalerz P., Chemia organiczna, Wrocław 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, Warszawa 2010, wyd. 5.
Phaniendra A., Jestadi D. B., Periyasamy L., Free radicals: properties, sources, targets, and their implication in various diseases, „Indian J Clin Biochem” 2015, t. 30, nr 1, s. 11‑26.