Przeczytaj
Właściwości fizykochemiczne cukrów prostych
- Nazwa kategorii: Cukry proste
- Nazwa kategorii: właściwości fizyczne
- Nazwa kategorii: bezbarwne
- Nazwa kategorii: bezwonne
- Nazwa kategorii: rozpuszczalne w wodzie
- Nazwa kategorii: nie rozpuszczają się w rozpuszczalnikach organicznych
- Nazwa kategorii: mają najczęściej słodki smak Koniec elementów należących do kategorii właściwości fizyczne
- Nazwa kategorii: właściwości chemiczne
- Nazwa kategorii: tworzą izomery strukturalne i optyczne (mają zdolność skręcania płaszczyzny światła spolaryzowanego)
- Nazwa kategorii: mogą być utleniane do kwasów karboksylowych (wykazują właściwości redukujące) oraz zredukowane do alkoholi
- Nazwa kategorii: w środowisku zasadowym ulegają izomeryzacji i degradacji do związków o krótszym łańcuchu węglowym
- Nazwa kategorii: są odporne na działanie słabych kwasów
- Nazwa kategorii: w środowisku kwasowym i podwyższonej temperaturze ulegają dehydratacji i cyklizacji cząsteczek
- Nazwa kategorii: mogą reagować z aminami i aminokwasami Koniec elementów należących do kategorii właściwości chemiczne
- Elementy należące do kategorii Cukry proste
- Elementy należące do kategorii właściwości fizyczne
- Elementy należące do kategorii właściwości chemiczne
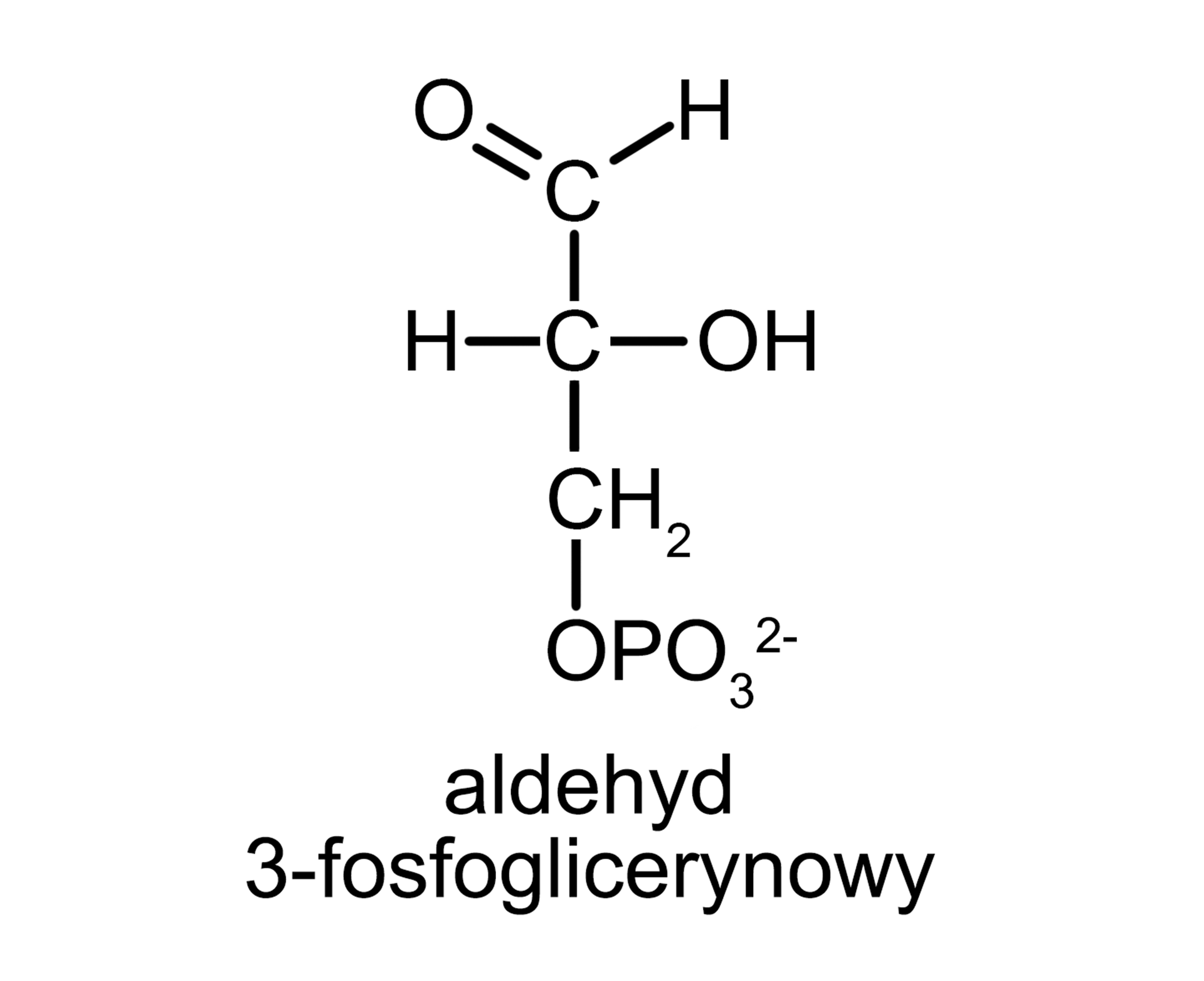
Cukry proste składają się z łańcuchów węglowych z licznymi grupami hydroksylowymi (–OH) i pojedynczą inną grupą funkcyjną: aldehydową lub ketonową. Cukry, zawierające grupę aldehydową –CHO na początku łańcucha nazywamy aldozami, a te z grupą ketonową –C=O przy drugim węglu to ketozy. Numerację atomów węgla zaczyna się od tego końca łańcucha węglowego, przy którym występuje grupa aldehydowa lub ketonowa.

Izomery strukturalne
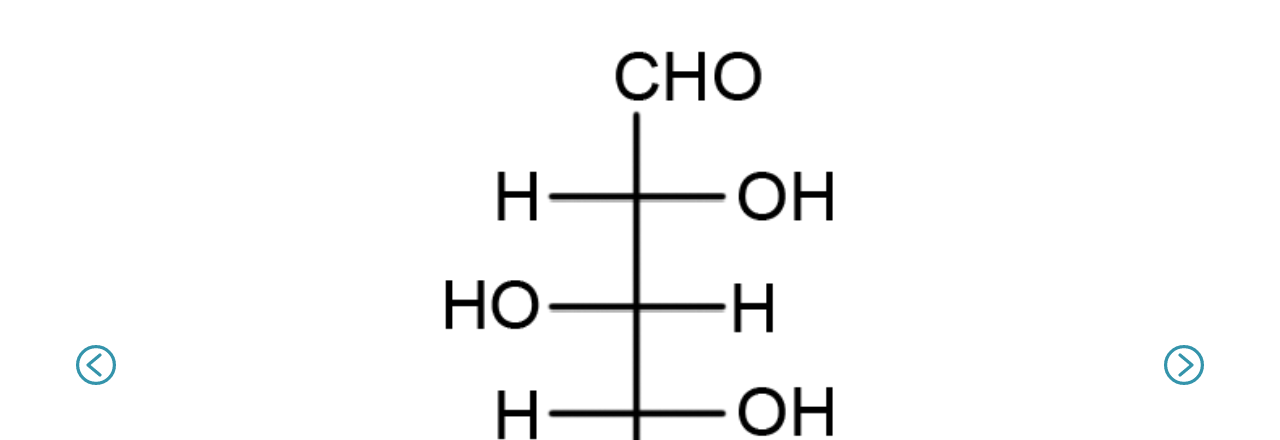
Cukrem o trzech atomach węgla jest aldehyd glicerynowy (GAL). Ponieważ jest i aldozą (ze względu na obecność grupy aldehydowej), i triozą (jest zbudowany z trzech atomów węgla), można go nazwać „aldotriozą”. Aldehyd glicerynowy ma taki sam skład atomowy CIndeks dolny 33HIndeks dolny 66OIndeks dolny 33 jak inna trioza – dihydroksyaceton (który jest ketozą, ponieważ zawiera grupę ketonową). Różni się jednak budową. To oznacza, że oba te związki są izomeramiizomerami strukturalnymi. Izomeryczne cząsteczki to różne związki chemiczne mające inne właściwości. Wśród cukrów prostych izomerami strukturalnymi są jeszcze m.in. glukoza i fruktoza czy ryboza i rybuloza.
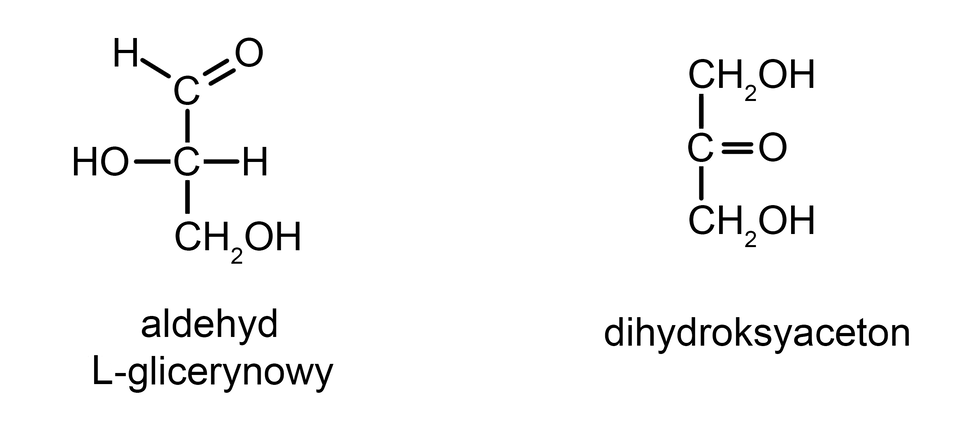
Dihydroksyaceton (DHA) jest używany do produkcji tzw. „samoopalaczy”. Ciemnienie skóry po użyciu takiego kosmetyku wynika z reakcji DHA z aminokwasami, które znajdują się w warstwie rogowej naskórka. Ponieważ warstwa ta ulega sukcesywnemu złuszczaniu, zabarwienie skóry zmniejsza się i po jakimś czasie znika.
Izomery optyczne
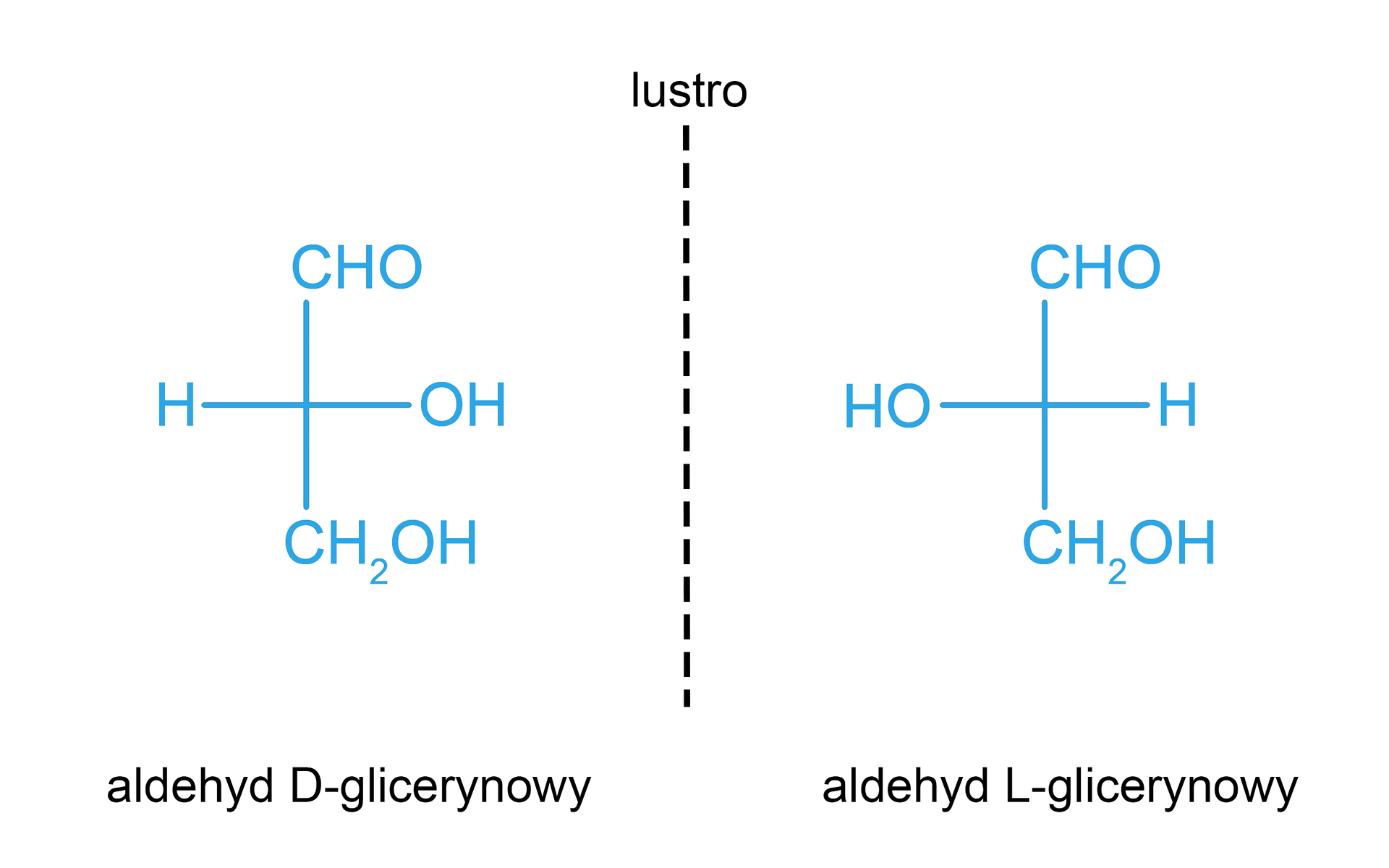
Związki, których cząsteczki są swoimi lustrzanymi odbiciami (nie mają wspólnej płaszczyzny symetrii) to enancjomeryenancjomery – izomeryizomery optyczne. Podobnie jak lewy i prawy but czy lewa i prawa ręka nie są symetryczne, ale stanowią swoje lustrzane odbicia. Enancjomery cukrów zapisane w projekcji Fischeraprojekcji Fischera wyglądają jak odbite w lustrze – różnią się położeniem grup –OH. Właściwość tę określa się chiralnościąchiralnością. Cząsteczki chiralne mogą dodatkowo skręcać strumień światła spolaryzowanego. Enancjomery skręcające światło w prawo oznacza się znakiem (+), natomiast te, które skręcają światło w lewo – znakiem (−).
Jeśli któryś z atomów węgla w cząsteczce jest asymetryczny, tzn. łączy się z czterema różnymi podstawnikami, możliwe jest utworzenie form D (prawa) i L (lewa). Cząsteczka cukru może mieć kilka asymetrycznych atomów węgla, ale o konfiguracji względnej cukru decyduje położenie grupy –OH na przedostatnim atomie węgla w łańcuchu. Jeśli grupa ta znajduje się po prawej stronie w projekcji Fischera, jest to konfiguracja D, natomiast jeżeli po lewej – konfiguracja L. Zazwyczaj w organizmach występuje tylko jedna z form i jest to D‑cukier. Sztucznie wytworzone formy L, np. L‑glukoza, są z reguły biologicznie nieczynne.
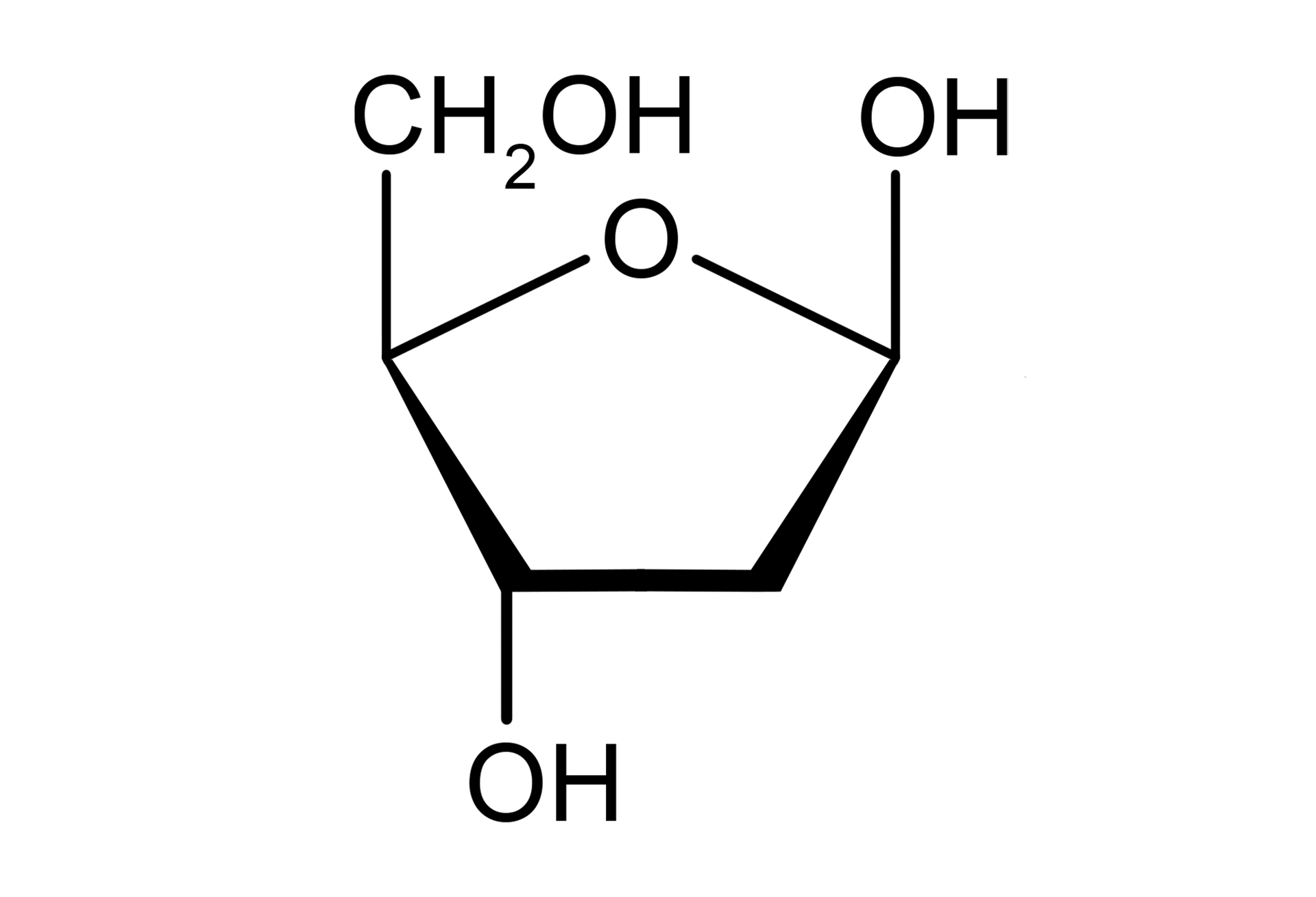
Tworzenie pierścieni (form cyklicznych)
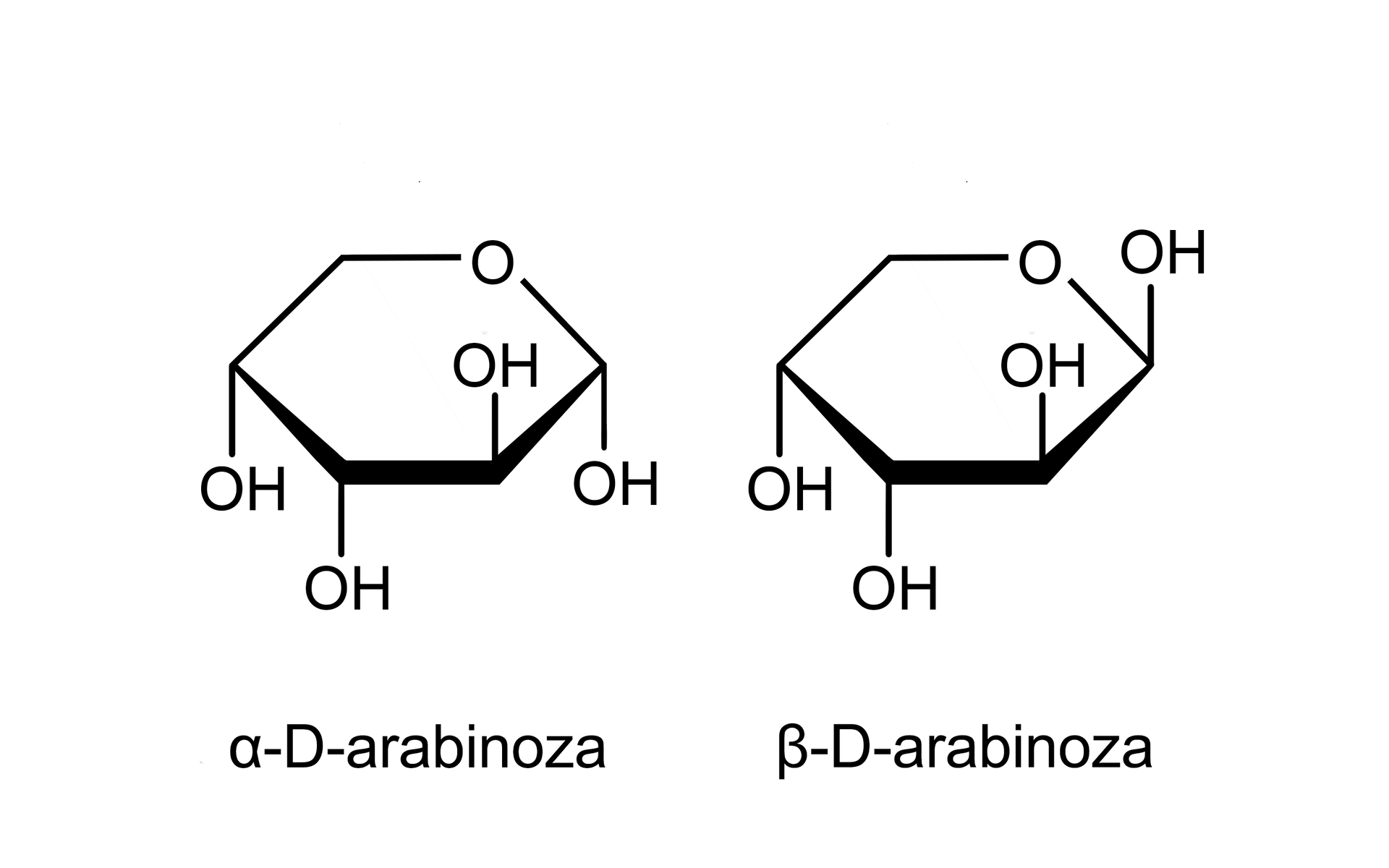
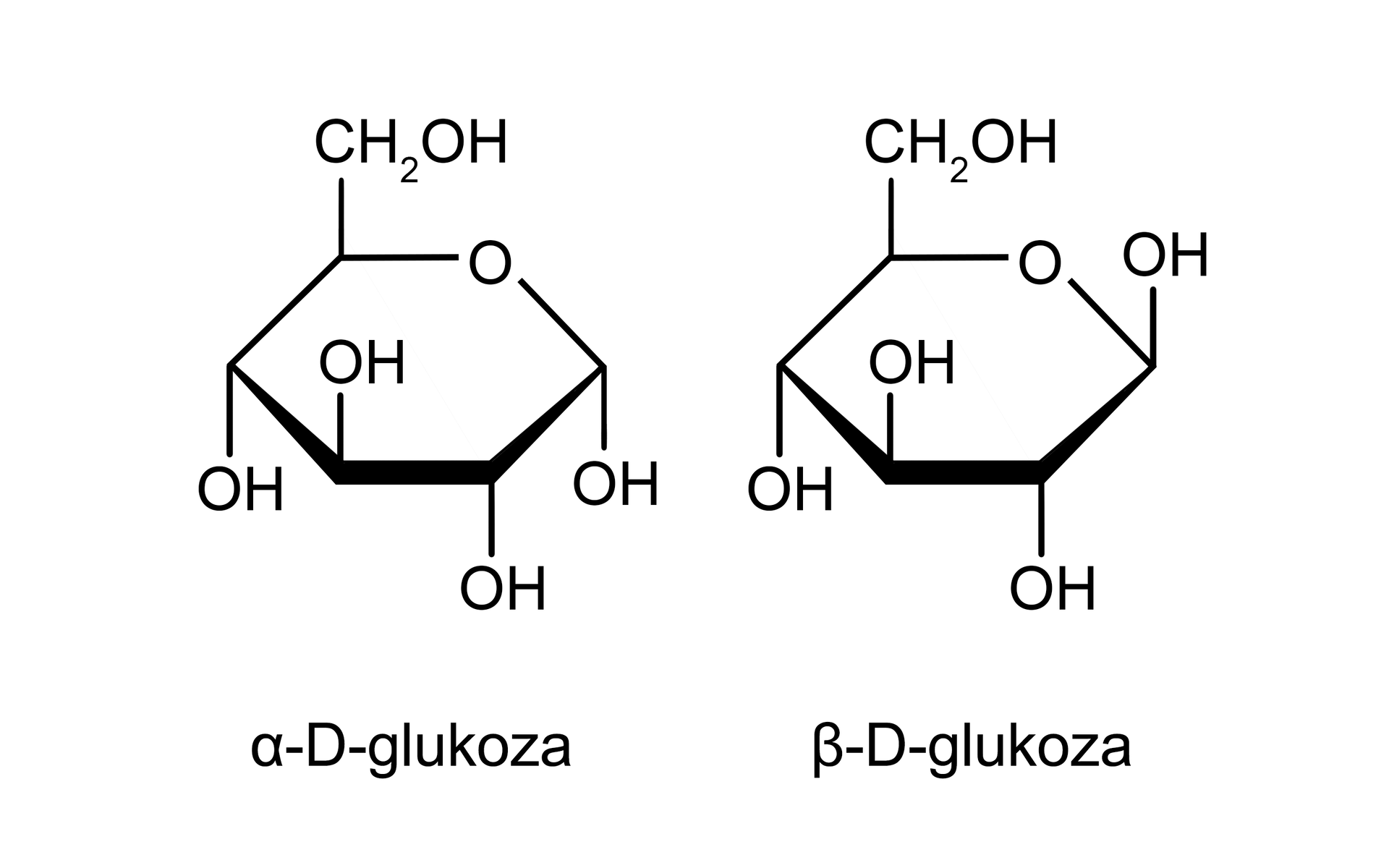
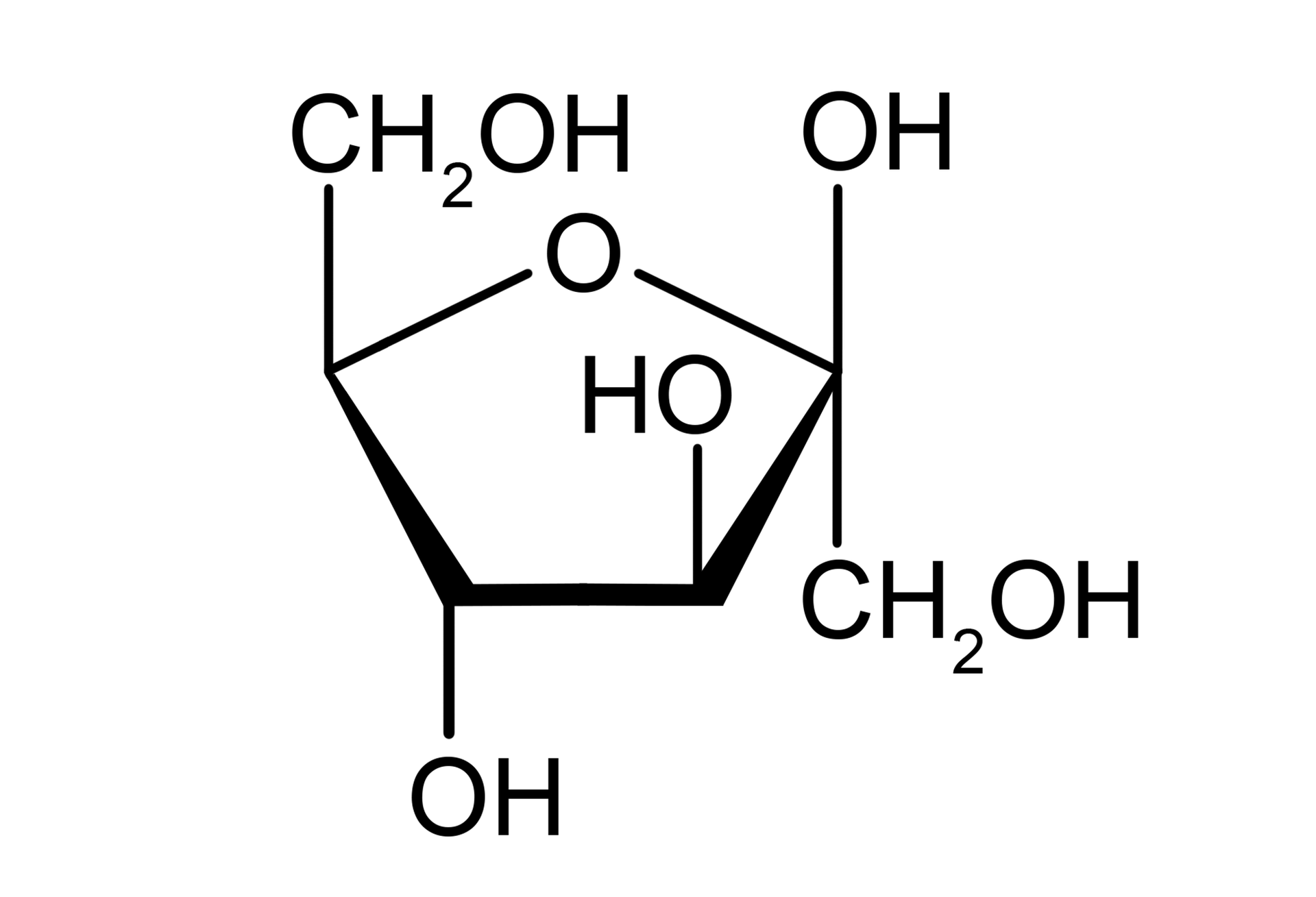
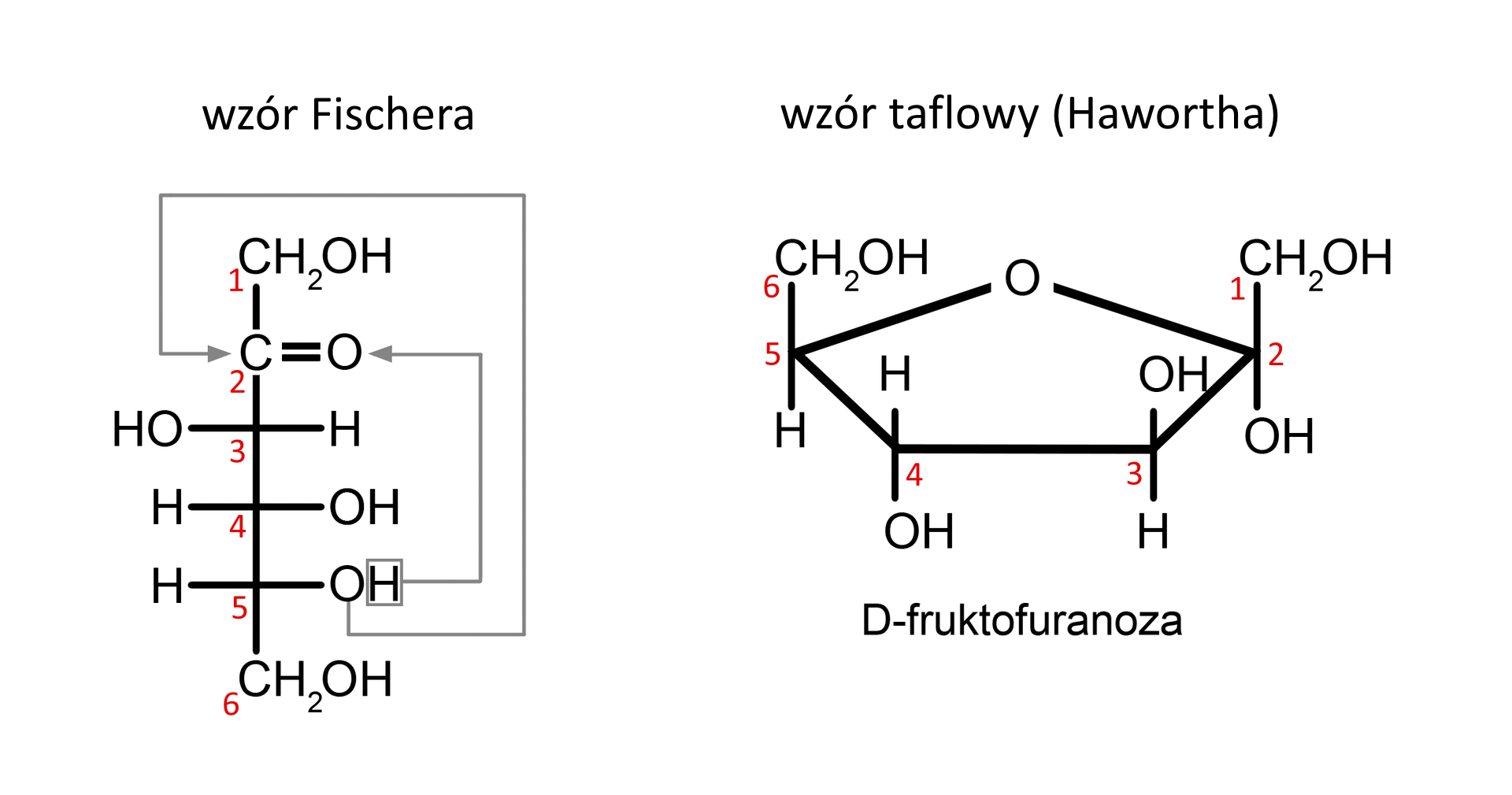
Grupa aldehydowa lub ketonowa może reagować z grupą hydroksylową tego samego łańcucha cukru, tworząc cząsteczkę o formie cyklicznej (pierścieniowej). Cukry zawierające co najmniej pięć atomów węgla w łańcuchu mogą, w roztworze wodnym, tworzyć struktury pierścieniowe. Proces ten nazywamy cyklizacją. Na przykład D‑glukoza cyklizuje do formy pierścienia sześcioczłonowego. Taki pierścień nazwano piranozą ze względu na podobieństwo strukturalne do związku pierścieniowego o nazwie piran. Zazwyczaj aldozy tworzą pierścienie piranozowe.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DZyOXHVkN
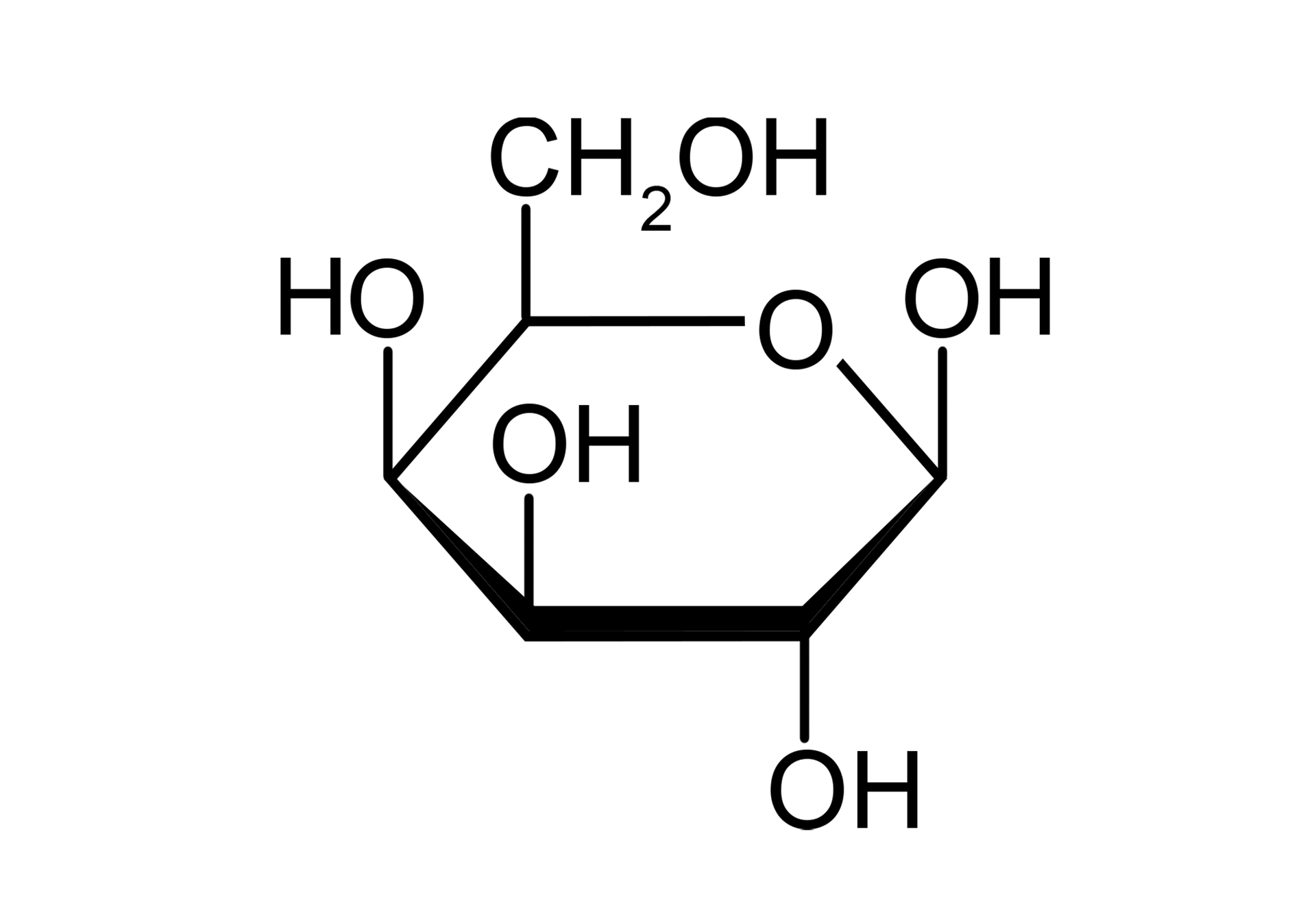
Z kolei D‑fruktoza cyklizuje do pierścienia pięcioczłonowego, gdy z grupą ketonową przy atomie węgla C‑2 reaguje grupa hydroksylowa przy atomie węgla C‑5. Taki pierścień nazwano furanozą, ze względu na podobieństwo do furanu.
Formy cukrów prostych (anomery)
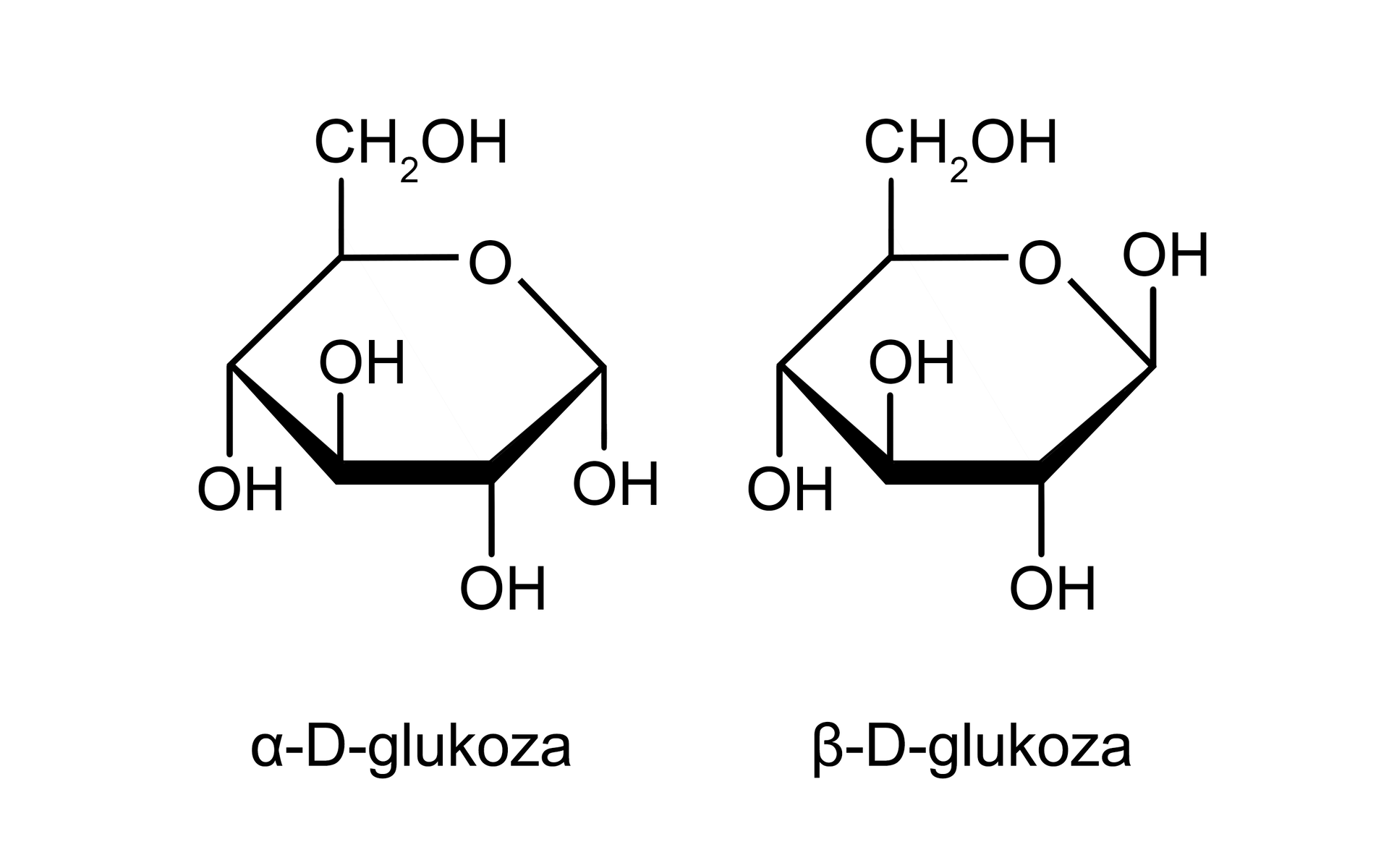
Monosacharydy pierścieniowe mają jeszcze jedną właściwość, która prowadzi do różnic między nimi. Po cyklizacji powstaje nowy asymetryczny atom węgla nazywany węglem anomerycznym. Grupa hydroksylowa przy takim węglu anomerycznym może znajdować się ponad płaszczyzną pierścienia lub pod nią – jeśli płaszczyznę wyobrazimy sobie przestrzennie. Z tego powodu mamy, między innymi, dwie formy pierścieniowe D‑glukozy: anomeranomer alfa (alfa‑D-glukozę), kiedy grupa –OH przy atomie węgla C‑1 leży poniżej płaszczyzny pierścienia, i anomer beta (beta‑D-glukozę), gdy grupa –OH przy atomie węgla C‑1 leży powyżej płaszczyzny pierścienia.
Biologiczne znaczenie wybranych monosacharydów
Podstawowym monosacharydem występującym w organizmach jest glukoza. Większość pozostałych cukrów prostych powstaje po chemicznym przekształceniu tego węglowodanu. Cukry proste stanowią też jednostki (monomeramimonomerami), z których zbudowane są wielocukry.
Reakcje cukrów prostych
Grupa aldehydowa aldoz może ulegać zarówno utlenianiuutlenianiu do grupy karboksylowej (w wyniku czego powstaje kwas karboksylowy), jak i redukcjiredukcji do grupy hydroksylowej (czego produktem jest alkohol). Właściwości redukujące wykazuje również grupa ketonowa ketoz, dzięki czemu reakcje utleniania cukrów prostych są wykorzystywane do ich wykrywania, o czym przeczytasz w materiale: Wykrywanie cukrów prostych.
Grupa hydroksylowa przy ostatnim atomie węgla może ulegać reakcji estryfikacji m. in. z kwasem fosforowym, tworząc fosforany. Ponadto cukry proste mogą ulegać również polikondensacji, tworząc oligosacharydy i polisacharydy. Więcej informacji na ten temat znajdziesz w materiale: Fabryka cukrów złożonychFabryka cukrów złożonych.
Słownik
(gr. ano – przedrostek oznaczający „w górę”, „w dół”, „w bok”; meros – część) izomer przestrzenny, w którym grupa hydroksylowa –OH znajduje się nad (anomer beta) lub pod (anomer alfa) płaszczyzną pierścienia cukru
(gr. cheir – ręka) cecha cząsteczek chemicznych, określająca, że są one swoim odbiciem lustrzanym i nie są identyczne (jak prawa i lewa ręka)
(gr. enantios – położony naprzeciw; meros – część) para związków chemicznych o symetrii lustrzanej; izomery przestrzenne
(gr. isos – równy; meros – część) związki chemiczne o takim samym składzie atomów pierwiastków (wzorze sumarycznym), różniące się sposobem wiązania, kolejnością lub układem wiązań pomiędzy nimi
gromada wyspecjalizowanych, w większości wielokomórkowych glonów należących do królestwa roślin, przeważnie morskich, o barwie czerwonej, fioletowej, brunatnej, ciemnozielonej; oprócz chlorofilu wytwarzają inne barwniki: czerwoną fikoerytrynę i niebieską fikocyjaninę
(gr. monos – pojedynczy; meros – część) jednostka składowa polimerów, większych cząstek, np. cukrów złożonych
przedstawienie trójwymiarowych konfiguracji wokół chiralnych atomów węgla w cząsteczce na płaszczyźnie
w znaczeniu chemicznym proces, w którym atom lub związek przechodzi z wyższego na niższy stopień utlenienia, połączony z przyjęciem elektronu od innego atomu lub związku (który ulega utlenieniu); redukcji musi towarzyszyć utlenienie (reakcja redoks)
proces polegający na oddaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego podwyższa się stopień utlenienia pierwiastka oddającego elektrony