Przeczytaj
Czynniki wpływające na aktywność enzymów
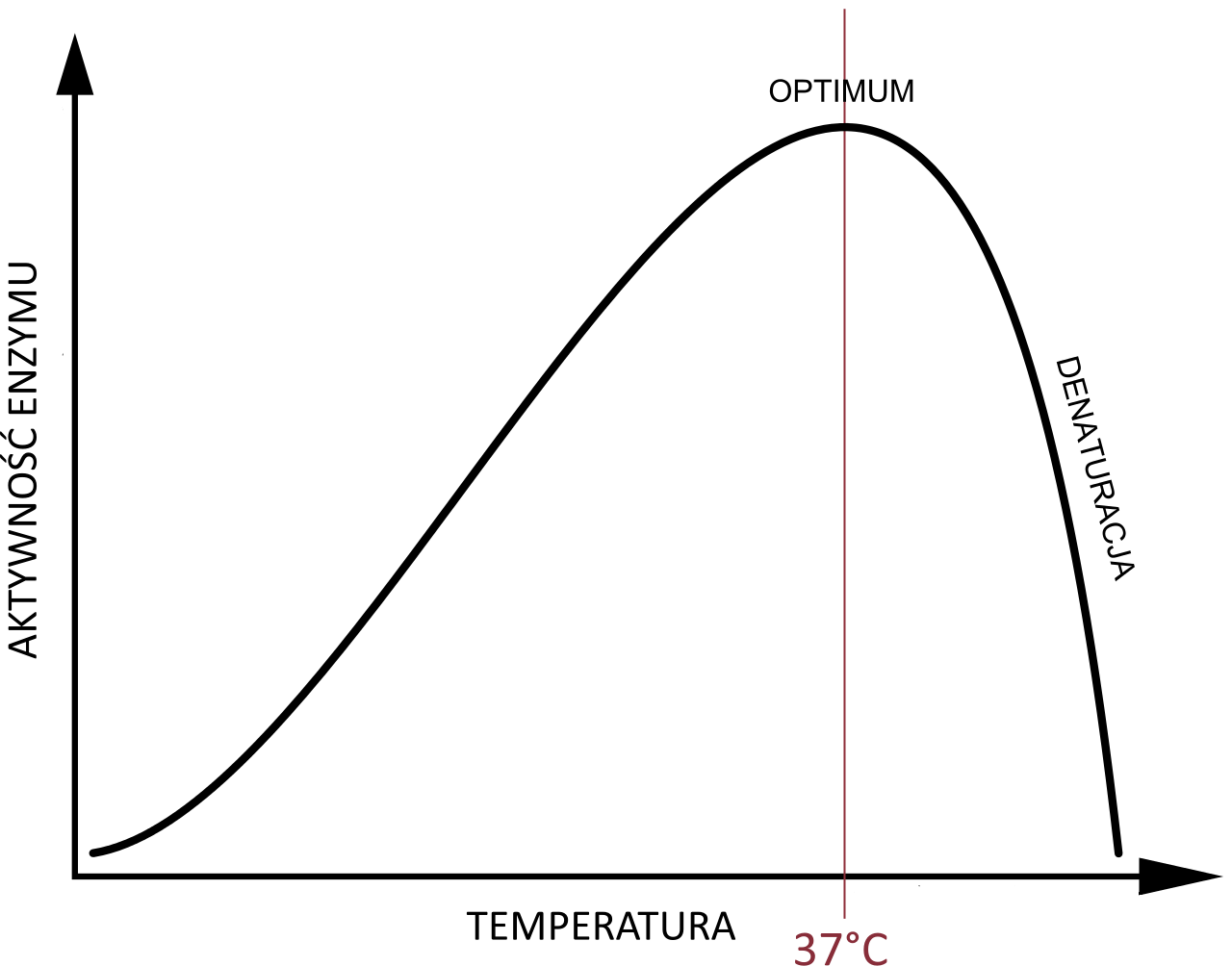
Najważniejszymi czynnikami środowiskowymi wpływającymi na aktywność enzymówenzymów są temperatura i pH. Optymalne wartości temperatury i pH dla enzymów działających w organizmie człowieka są zbliżone do panujących w nim warunków. Oznacza to, że odpowiednia temperatura dla działania enzymu jest porównywalna do temperatury ciała (od 35 do 40°C), a optymalne pH jest zbliżone do występującego w miejscu, w którym dany enzym jest aktywny.
Stała Michaelisa–Menten
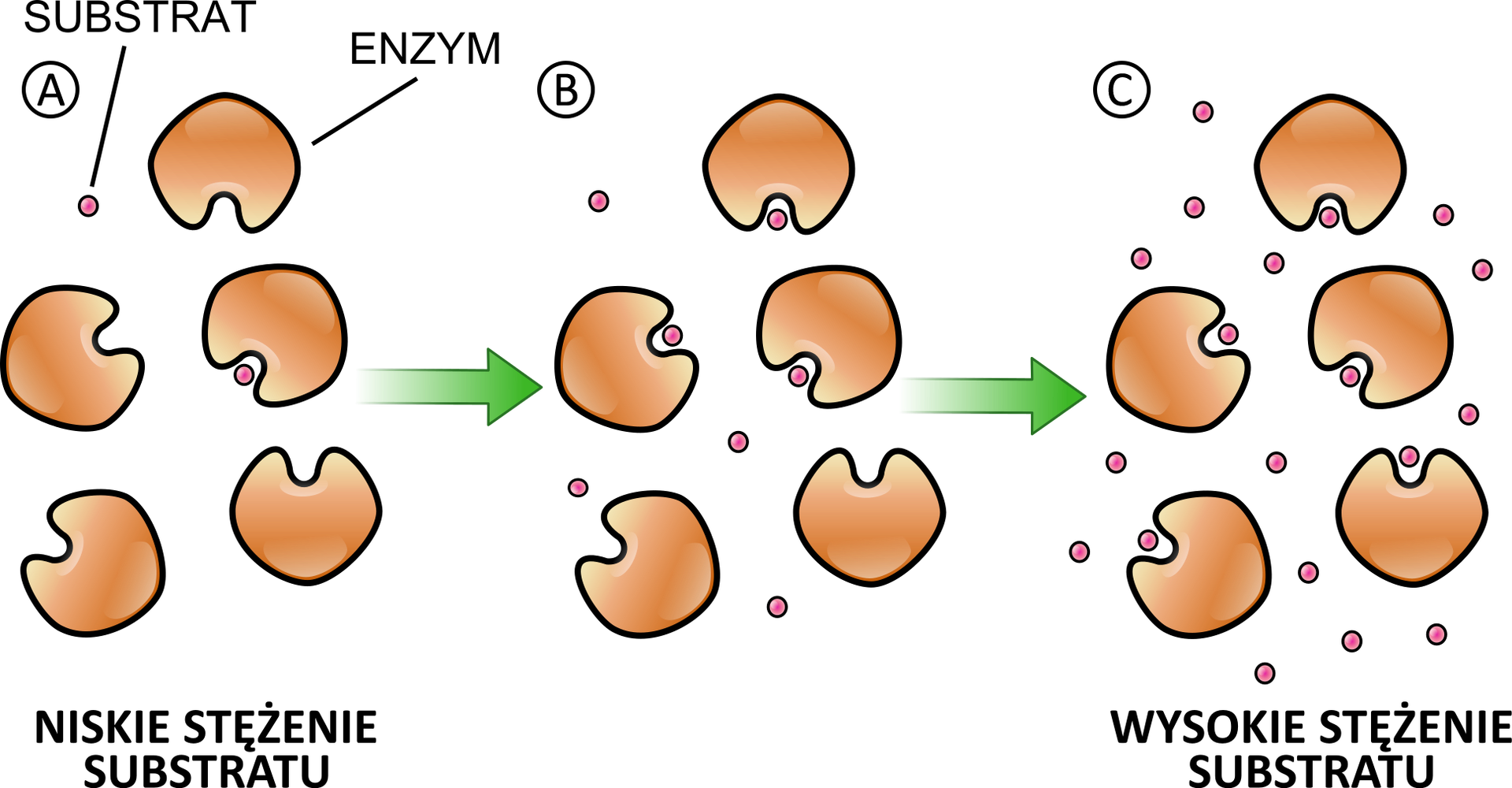
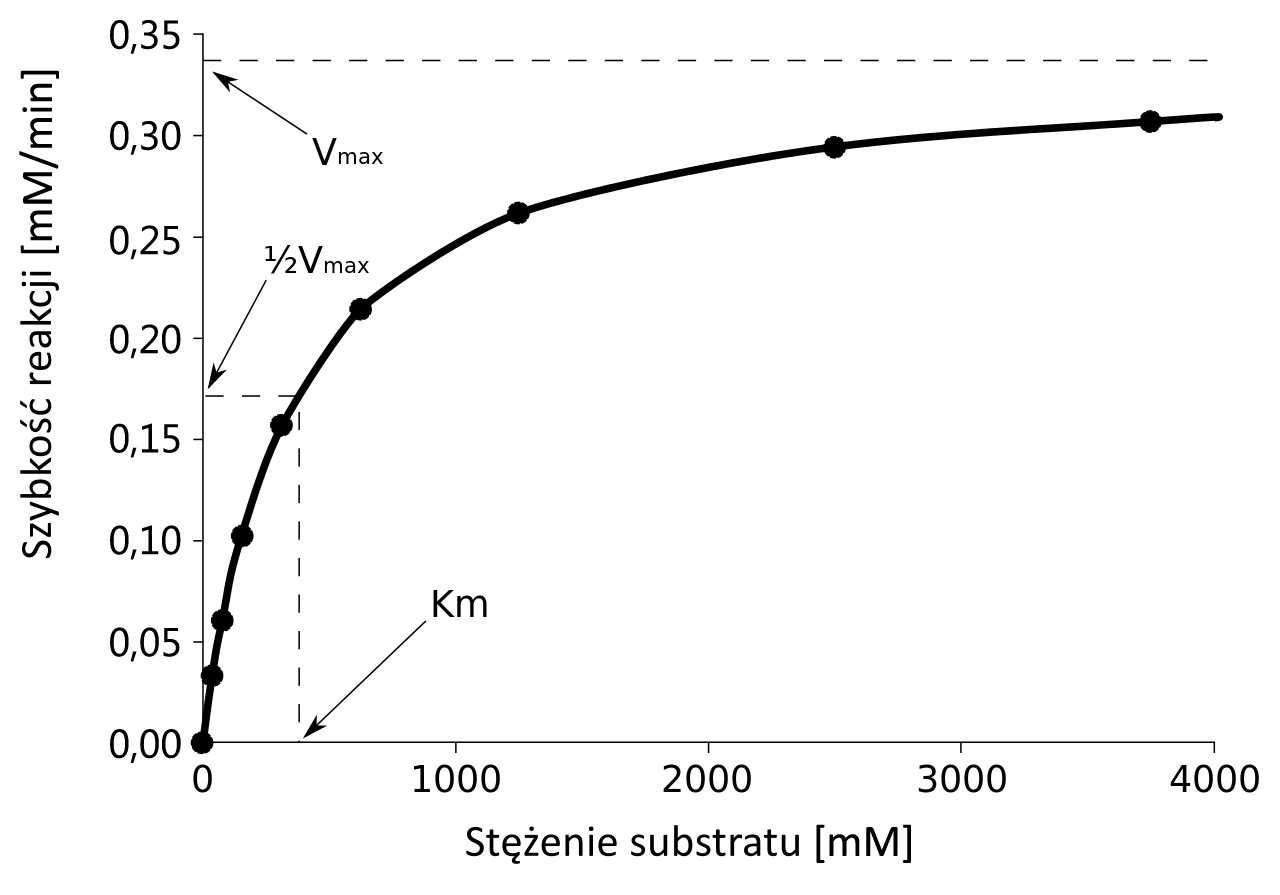
Stała Michaelisa–Menten (KIndeks dolny mm) to takie stężenie substratu (dla określonego stężenia enzymu), przy którym szybkość reakcji enzymatycznej osiąga połowę szybkości maksymalnej (VIndeks dolny maxmax) tej reakcji. Stała Michaelisa–Menten określa powinowactwopowinowactwo enzymu do substratu i jest wyrażana w molach na dmIndeks górny 33. Wysoka wartość KIndeks dolny mm mówi o małym powinowactwie enzymu do substratu. Natomiast im mniejsza KIndeks dolny mm, tym powinowactwo enzymu do substratu jest większe. Znając wartość KIndeks dolny mm różnych enzymów można więc porównać ich powinowactwo do substratu.

Doświadczenie – wpływ temperatury na aktywność enzymów komórek bulwy ziemniaka
Komórki bulwy ziemniaka zawierają katalazę, która katalizuje rozkład HIndeks dolny 22OIndeks dolny 22 (wody utlenionej) do wody oraz wolnego tlenu. Wydzielanie pęcherzyków tlenu widoczne jest w postaci piany.
Doświadczenie ilustruje wpływ temperatury na aktywność enzymów komórek bulwy ziemniaka. Na pierwszej fotografii widoczny jest biały blat z naczyniami laboratoryjnymi oraz plastrem bulwy ziemniaka. Na jasnej powierzchni znajduje się miska z moździerzem, skalpel, woda utleniona nalana do kolby stożkowej z zanurzoną w niej pipetą, stojak z trzema wąskimi, długimi probówkami, zlewka z wodą destylowaną i zanurzoną w niej pipetą oraz szalka Petriego z płaskim plastrem wyciętym z ziemniaka.
Pod spodem znajduje się prostokątna ramka z napisem: Przygotuj potrzebny sprzęt, pokrój ziemniaka na małe kawałki.
Po kliknięciu na tą ramkę pojawia się krótki filmik, na którym ręce w niebieskich, lateksowych rękawiczkach siekają plaster ziemniaka znajdujący się w szalce Petriego na mniejsze kawałki.
Pod spodem pojawia się prostokątna ramka z napisem: Kawałki ziemniaka przesyp do moździerza.
Po kliknięciu na ramkę wyświetla się następny krótki filmik, na którym ręce w niebieskich rękawiczkach przesypują kawałki ziemniaka do miski.
Pod spodem pojawia się prostokątna ramka z napisem: Kawałki ziemniaka utrzyj w moździerzu.
Po kliknięciu na napis pojawia się krótki filmik, na którym dwie ręce w niebieskich rękawiczkach ugniatają kawałki ziemniaka na miazgę.
Pod spodem wyświetla się kolejna, prostokątna ramka z napisem: Utarte kawałki ziemniaka dodaj do wody destylowanej.
Po kliknięciu na ramkę pojawia się kolejny, krótki filmik, w którym osoba ubrana w biały fartuch laboratoryjny i niebieskie rękawiczki przekłada zmiażdżonego ziemniaka z miski do zlewki z wodą destylowaną metalową łyżeczką.
Pod spodem pojawia się kolejna prostokątna ramka z napisem: Otrzymaną zawiesinę przelej do trzech próbek.
Po kliknięciu na nią wyświetla się kolejny filmik, na którym znajdują się trzy podłużne próbówki umieszczone na przeznaczonym do tego stojaku. Dłoń w niebieskiej rękawiczce przelewa zawartość zlewki do tych próbówek.
Pod spodem widoczna jest kolejna ramka z napisem: Zawartość pierwszej probówki zagotuj w łaźni parowej.
Po kliknięciu na nią pojawia się krótki filmik, w którym dłoń laboranta wkłada probówkę do urządzenia z klapą, w którym znajdują się przegródki o otworach wielkości probówek. Urządzenie to wypełnione jest wodą. Na obudowie urządzenia znajduje się panel sterowania z przyciskami i ustawioną temperaturą 93,3 stopnia Celsjusza
Pod spodem widoczna jest kolejna prostokątna ramka z napisem: Zawartość drugiej probówki wstaw do wanienki z lodem. Trzecią probówkę pozostaw w temperaturze pokojowej.
Po kliknięciu w tę ramkę pojawia się filmik, na którym laborant niebieskich rękawiczkach na dłoniach wkłada probówkę do okrągłego, wysokiego pojemnika wypełnionego lodem.
Pod spodem znajduje się prostokątna ramka z napisem: Do pierwszej probówki dodaj 2 mililitry 3% wody utlenionej.
Po kliknięciu na tą ramkę pojawiają się trzy probówki umieszczone w stojaku – pierwsza z nich posiada mętną, szarawą zawartość. Ręka w niebieskiej rękawicy wkrapla do probówki za pomocą pipety wodę utlenioną.
Pod spodem pojawia się kolejna ramka z napisem: Do drugiej probówki dodaj 2 mililitry 3% wody utlenionej.
Po kliknięciu na nią pojawia się filmik, na którym ręka laboranta wlewa do drugiej probówki niewielką ilość wody utlenionej za pomocą pipety.
Pod spodem pojawia się kolejna ramka z napisem: Do trzeciej probówki dodaj 2 mililitry 3% wody utlenionej.
Po kliknięciu na ramkę pojawia się następny filmik, w którym ręka laboranta powtarza wcześniej wykonywaną czynność.
Pod spodem zjawia się następna ramka z napisem: Obserwuj zachodzące zmiany. Wskaż probówkę, w której reakcja zaszła najgwałtowniej.
Po naciśnięciu na ramkę pojawia się kolejny filmik z trzema probówkami w stojaku oraz kolbą stożkową z zanurzoną w niej pipetą. W tle przechodzi przez kadr laborant ubrany w biały fartuch i niebieskie rękawiczki. Poziom płynu w probówce, która była przechowywana w temperaturze pokojowej wzrasta, płyn pieni się. Poziom płynu w probówce przechowywanej w lodzie nieznacznie wzrasta i powstaje niewielka ilość piany, a poziom płynu w probówce, która znajdowała się w wysokiej temperaturze nie zmienia się.
Pod spodem pojawia się ramka z napisem: Porównaj otrzymane wyniki.
Po kliknięciu na nią wyświetla się zdjęcie: płyn w probówce, który był poddany działaniu kąpieli w wysokiej temperaturze jest szary i mętny, ma niewielką objętość. Płyn w probówce, która znajdowała się w lodzie jest jasnobrązowy, na wierzchu widoczne jest znaczna ilość białej piany. Płyn w probówce przechowywanej w temperaturze pokojowej jest również jasnobrązowy, ale piany jest bardzo dużo, przewyższa ona ilość samego płynu.
Słownik
enzymy z klasy hydrolaz glikozydowych; katalizują rozkład polisacharydów: skrobi i glikogenu; występują w ślinie, soku trzustkowym oraz u roślin, np. w ziarnach zbóż
zniszczenie struktury cząsteczek białkowych wynikające z rozerwania wiązań chemicznych (wodorowych, jonowych, mostków disiarczkowych) stabilizujących ich strukturę drugo-, trzecio- i czwartorzędową
biokatalizator; zazwyczaj białko, rzadziej cząsteczka RNA lub DNA; zdolny do obniżenia energii aktywacji i przyspieszenia przebiegu reakcji chemicznej
główny enzym proteolityczny soku żołądkowego kręgowców; syntetyzowany jako proenzym (pepsynogen), który w żołądku pod wpływem niskiego pH zostaje przekształcony w pepsynę
trwałość połączenia enzymu z substratem
enzym proteolityczny, który trawi białka w jelicie cienkim; wytwarzany w trzustce jako proenzym (trypsynogen), a następnie transportowany do jelita cienkiego, gdzie przekształca się w trypsynę pod wpływem enzymu gruczołów ściany jelita cienkiego – enterokinazy