Przeczytaj
Przyczyna rozpuszczalności w wodzie, czyli wiązania wodorowe
Analizując budowę strukturalną kwasów karboksylowych, należałoby oczekiwać, że ich cząsteczki są polarne (ze względu na obecność hydrofilowejhydrofilowej grupy karboksylowej) i wykazują zdolność do tworzenia wiązań wodorowych między sobą lub z innymi cząsteczkami (np. wody). Idąc tym tropem, możemy przypuszczać, że kwasy karboksylowe dobrze rozpuszczają się w wodzie. Jednak badania przekonują, że jedynie kwasy karboksylowe, zawierające od jednego do czterech atomów węgla w cząsteczce (kwas mrówkowy, kwas octowy, kwas propanowy, kwas butanowy), są dobrze rozpuszczalne w wodzie. Na rysunku poniżej widzimy, jak atomy tlenu i wodoru z grupy karboksylowej tworzą wiązania wodorowe z atomami wodoru i tlenu, należącymi do cząsteczki wody.
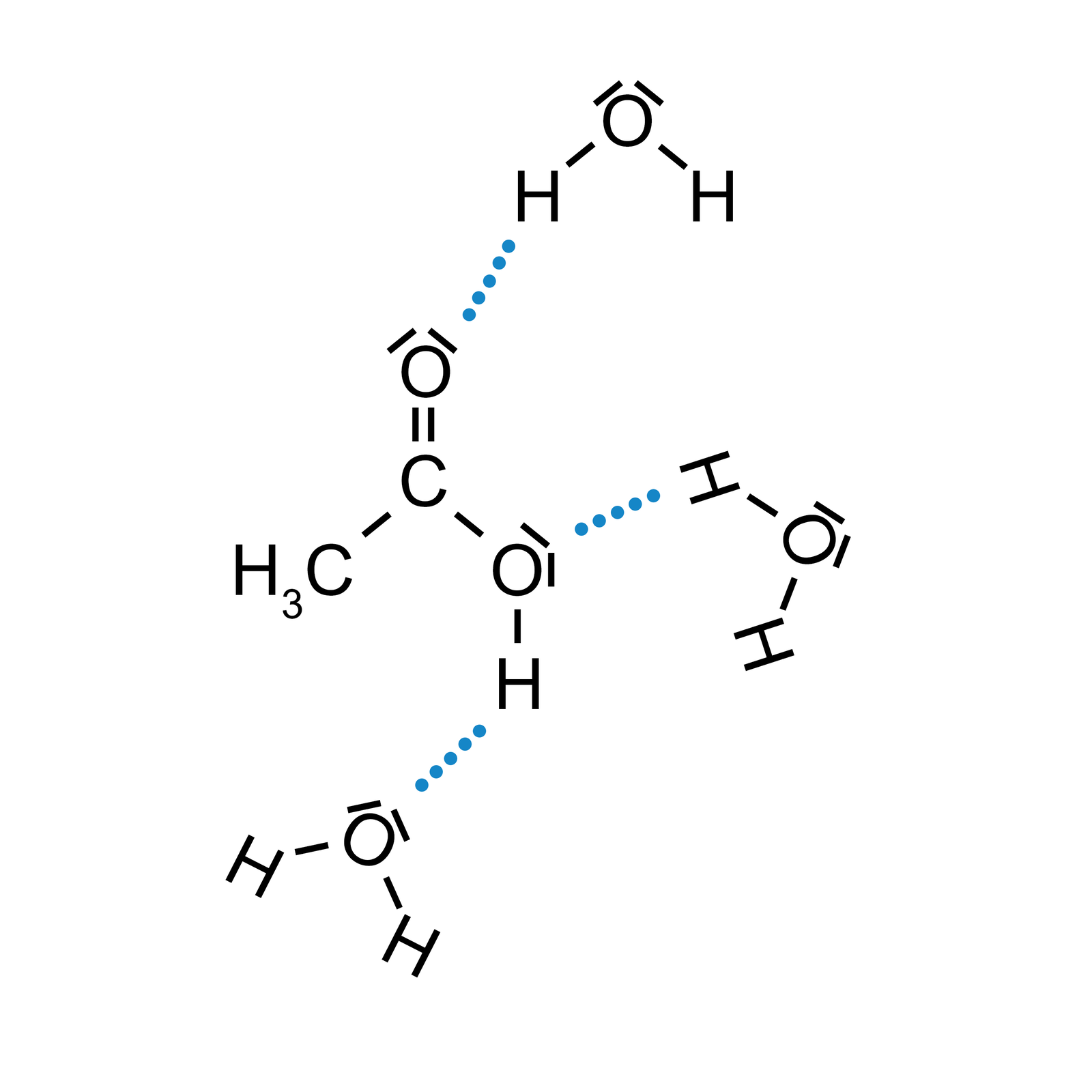
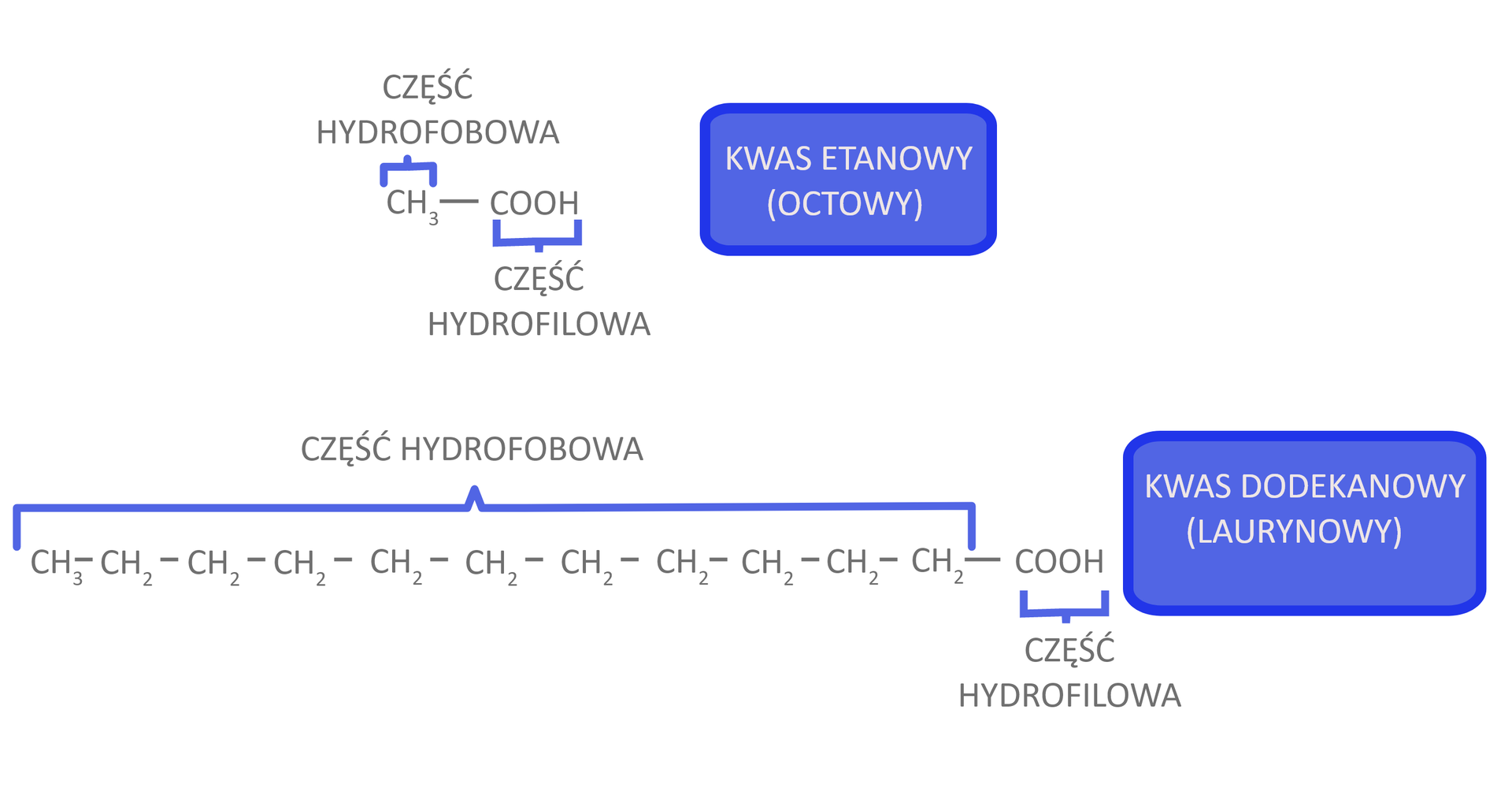
Rozpuszczalność wyższych homologówwyższych homologów maleje bardzo szybko wraz ze wzrostem długości łańcucha węglowego, ponieważ zmniejsza się udział hydrofilowej grupy karboksylowej w cząsteczce na rzecz hydrofobowejhydrofobowej reszty węglowodorowej. Kwas zawierający 12 atomów węgla w cząsteczce, kwas dodekanowy, potocznie zwany kwasem laurynowym, jest praktycznie nierozpuszczalny w wodzie.
Rozpuszczalność wybranych kwasów karboksylowych w wodzie. Miarą rozpuszczalności jest liczba gramów danej substancji, która rozpuszcza się w 100 g wody.
Nazwa | Rozpuszczalność |
|---|---|
Kwas mrówkowy (metanowy) | Bez ograniczeń |
Kwas octowy (etanowy) | Bez ograniczeń |
Kwas propanowy (propionowy) | Bez ograniczeń |
Kwas butanowy (masłowy) | Bez ograniczeń |
Kwas pentanowy (walerianowy) | 3,7 |
Kwas heksanowy | 1 |
Kwas oktanowy | 0,7 |
Kwas dekanowy | 0,2 |
Kwas dodekanowy (laurynowy) | Nierozpuszczalny |
Kwas heksadekanowy (palmitynowy) | Nierozpuszczalny |
Kwas-cis-oktadec‑9‑enowy (kwas oleinowy) | Nierozpuszczalny |
Kwas oktadekanowy (kwas stearynowy) | Nierozpuszczalny |
kwas benzoesowy (kwas benzenokarboksylowy) | 0,34 |
Indeks górny Źródło: R. T. Morrison, R. N. Boyd, W. Ankowiak i inni, Chemia organiczna tom 1, tłum, Państwowe Wydawnictwo Naukowe, Warszawa 1985, s. 668. Indeks górny koniecŹródło: R. T. Morrison, R. N. Boyd, W. Ankowiak i inni, Chemia organiczna tom 1, tłum, Państwowe Wydawnictwo Naukowe, Warszawa 1985, s. 668.
Dysocjacja elektrolityczna
Budowa elektronowa grupy karboksylowej znacząco wpływa na właściowości cząsteczek, w których występuje. Pomiędzy atomem węgla a atomem tlenu w grupie karbonylowej występuje wiązanie podwójne , które jest spolaryzowane w kierunku atomu tlenu. Konsekwencją tego jest wzrost polaryzacji wiązania , przez co ulega ono osłabieniu. Efekt ten potęguje wpływ chmury elektronowej atomu tlenu należącego do cząsteczki wody, która tworzy wiązania wodorowe z cząsteczką kwasu karboksylowego.
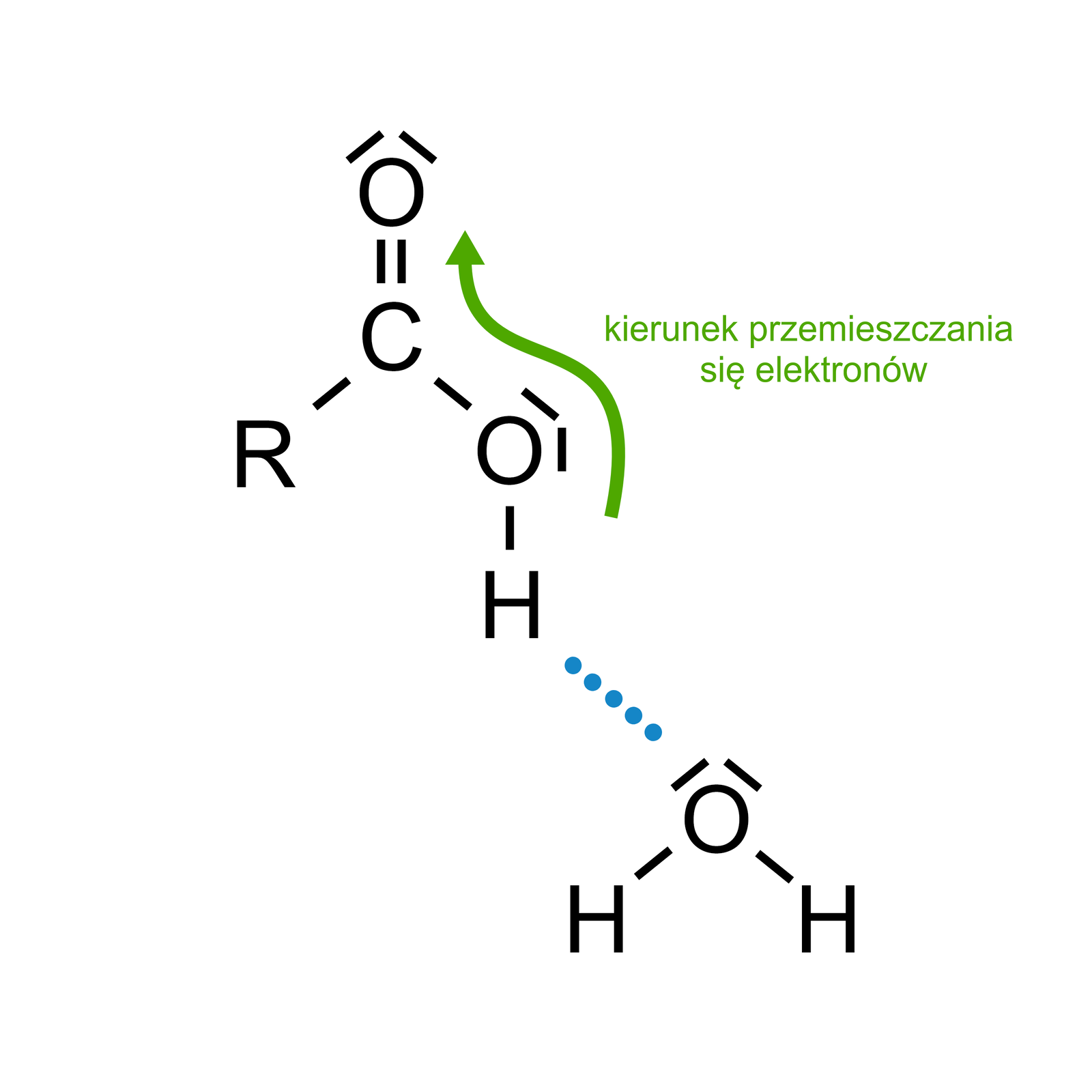
W konsekwencji, w jednym momencie dochodzi do przemieszczenia dwóch elektronów tworzących wiązanie na atomie tlenu. Powstaje anion karboksylanowyanion karboksylanowy oraz nowe wiązanie kowalencyjne . W wyniku czego z cząsteczki wody powstaje kation oksoniowy, (kation hydroniowy, kation hydronowy).
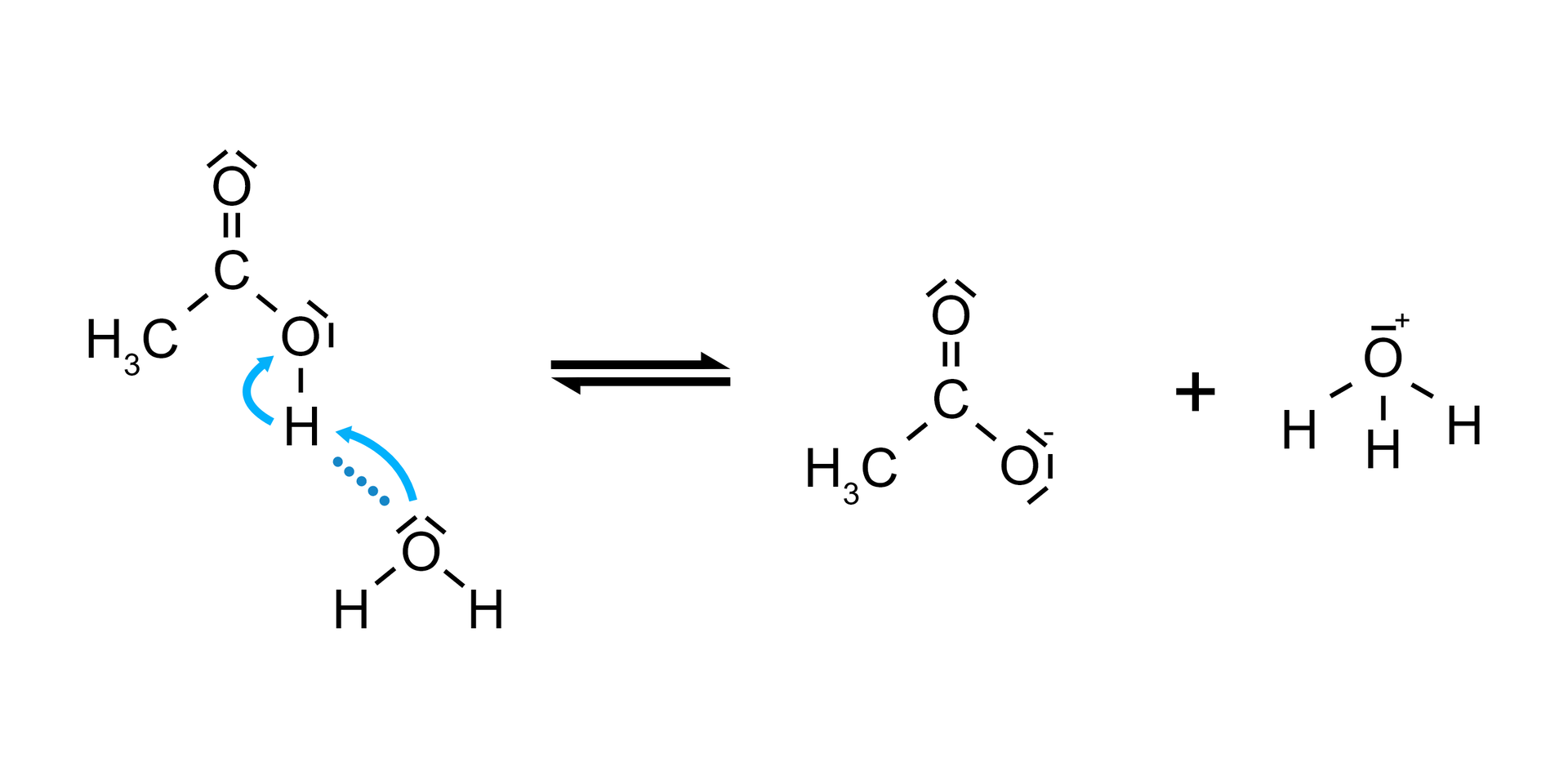
W ten sposób zachodzi dysocjacja elektrolityczna (jonowa), czyli rozpad cząsteczki na jony pod wpływem wody.

Wzrost stężenia kationów oksoniowych w roztworach kwasów karboksylowych odpowiada za ich odczyn kwasowy (pH<7). Im mniejsza rozpuszczalność, tym w mniejszym stopniu zachodzi dysocjacja elektrolityczna. Oznacza to, że każdy kolejny kwas karboksylowy w szeregu homologicznym jest słabszy od poprzedniego.
Stała dysocjacji kwasowej
Rozpuszczalny w wodzie kwas karboksylowy ulega dysocjacji elektrolitycznej, podczas której powstaje anion karboksylanowy, oraz kation oksoniowy (hydroniowy), :

W roztworze wodnym istnieje zatem równowaga pomiędzy cząsteczkami kwasu karboksylowego a anionami karboksylanowymi i kationami oksoniowymi (hydroniowymi), których stężenia są tak powiązane, jak w przypadku dowolnej równowagi, zależnością:
Gdzie:
– stała dysocjacji kwasowej;
– stężenie anionu karboksylanowego;
– stężenie kationu oksoniowego;
– stężenie niezdysocjowanego kwasu karboksylowego.
Stężenie rozpuszczalnika, w tym przypadku wody, zasadniczo pozostaje stałe i dlatego wartość tę pomijamy.
Kwasy wielokarboksylowe
Kwasy wielokarboksylowe są lepiej rozpuszczalne w wodzie niż kwasy monokarboksylowekwasy monokarboksylowe zawierające tyle samo atomów węgla w cząsteczce. Efekt ten jest spowodowany przez wzrost ilości hydrofilowych grup karboksylowych, które odpowiadają między innymi za tworzenie wiązań wodorowych z cząsteczkami wody. Wzrost liczby grup karboksylowych sprzyja również wzrostowi mocy kwasu. Przykładem kwasu dikarboksylowego jest kwas szczawiowy (etanodiowy), który, tak jak inne kwasy wielokarboksylowe, ulega dysocjacji etapowej:

Kwas szczawiowy (etanodiowy) jest jednym z najsilniejszych kwasów karboksylowych. Charakteryzuje się stałą dysocjacji pierwszego etapu: oraz stałą dysocjacji drugiego etapu: .
Moc kwasu
Każdy kwas karboksylowy charakteryzuje się swoją stałą dysocjacji kwasowej, która jest miarą jego mocy. Wyraża się ona stosunkiem stężenia substancji zdysocjowanej do niezdysocjowanej, dlatego im ma wyższą wartość, tym lepiej zachodzi dysocjacja, a więc kwas jest mocniejszy.
Na podstawie wartości możemy dokładnie porównywać moc różnych kwasów.
Równanie dysocjacji elektrolitycznej | |||
|---|---|---|---|
Stała dysocjacji, KIndeks dolny aa | |||
Nazwa anionu | mrówczanowy (metanianowy) | octanowy (etanianowy) | benzoesanowy (benzenokarboksylanowy) |
Indeks górny Źródło: J. McMurry, H. Koroniak i inni, Chemia organiczna, Warszawa 2018, t. 4, s. 924. Indeks górny koniecŹródło: J. McMurry, H. Koroniak i inni, Chemia organiczna, Warszawa 2018, t. 4, s. 924.
Wartość dla kwasu octowego w praktyce oznacza, że w roztworze o stężeniu 0,1 jedynie około 0,1% cząsteczek jest zdysocjowanych.
Jak wynika z tabeli, dwie wartości stałych dysocjacji kwasów karboksylowych są niskie, co oznacza, że kwasy te są słabymi elektrolitami. Najmocniejszy w szeregu homologicznym monokarboksylowych kwasów alifatycznychkwasów alifatycznych jest kwas mrówkowy (metanowy). Wraz ze wzrostem długości łańcucha węglowego moc kwasów karboksylowych maleje.
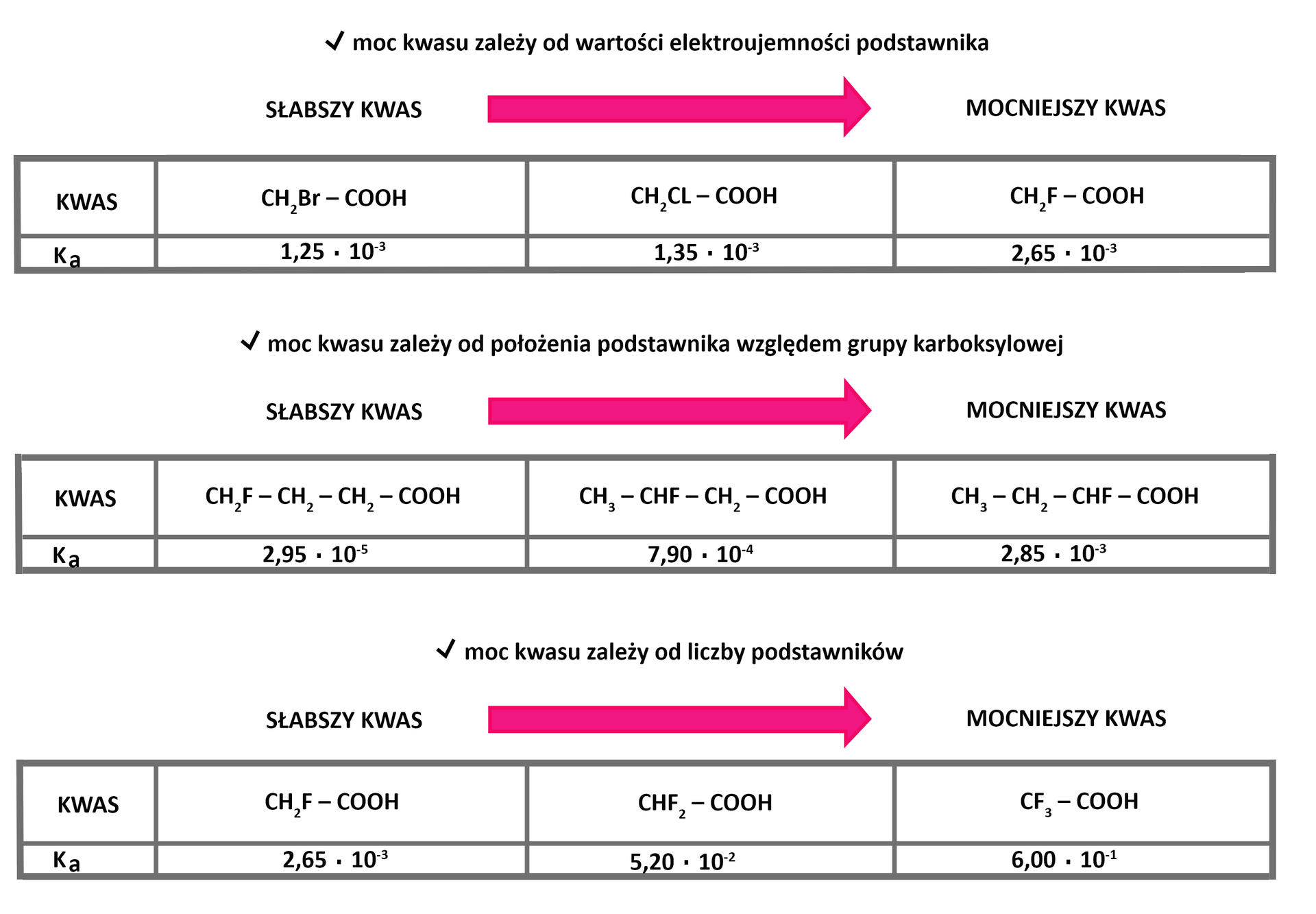
Wpływ silnie elektroujemnych podstawników na moc kwasu
Jeżeli w cząsteczce kwasu karboksylowego znajduje się silnie elektroujemnysilnie elektroujemny podstawnik,podstawnik, następuje znaczne zwiększenie mocy kwasu w stosunku do kwasu niepodstawionego. Przyczyną tego jest przemieszczenie się elektronów w kierunku podstawnika, co powoduje wzrost polaryzacji wiązania , czyniąc je bardziej podatnym na rozpad na jony pod wpływem wody.
Słownik
(wodolubność) skłonność cząsteczek chemicznych do łączenia się z wodą
związki należące do tego samego szeregu homologicznego, które posiadają dłuższy łańcuch węglowy od poprzedników
(gr. hydro „woda”, phobos „strach”) skłonność cząsteczek chemicznych do odpychania od siebie cząsteczek wody
anion powstały z kwasu karboksylowego po dysocjacji elektrolitycznej
kwasy karboksylowe zawierające jedną grupę karboksylową w strukturze
kwasy nasycone lub nienasycone, w których atomy węgla tworzą łańcuchy proste lub rozgałęzione, ale nie tworzą struktur zamkniętych (cyklicznych)
posiadający wysoką wartość elektroujemności
atom lub ich grupa w miejscu atomu wodoru, zwykle przy atomie węgla
Bibliografia
Morrison R. T., Boyd R. N., Chemia organiczna tom 1, Warszawa 1985.
McMurry J., Chemia organiczna tom 4, Warszawa 2018.
Kaznowski K., Chemia Vademecum maturalne, Warszawa 2016.
Litwin M., Styka‑Wlazło S., Szymońska J., To jest chemia 2, Warszawa 2016.
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura Vademecum, Warszawa 2015.
Mieszkowicz J., Męcik M., Wróblewska M., Matras K., Chemia, Rzeszów 2019, t. 3.