Przeczytaj
E‑materiały powiązane z tematem
Budowa pierwotna korzenia
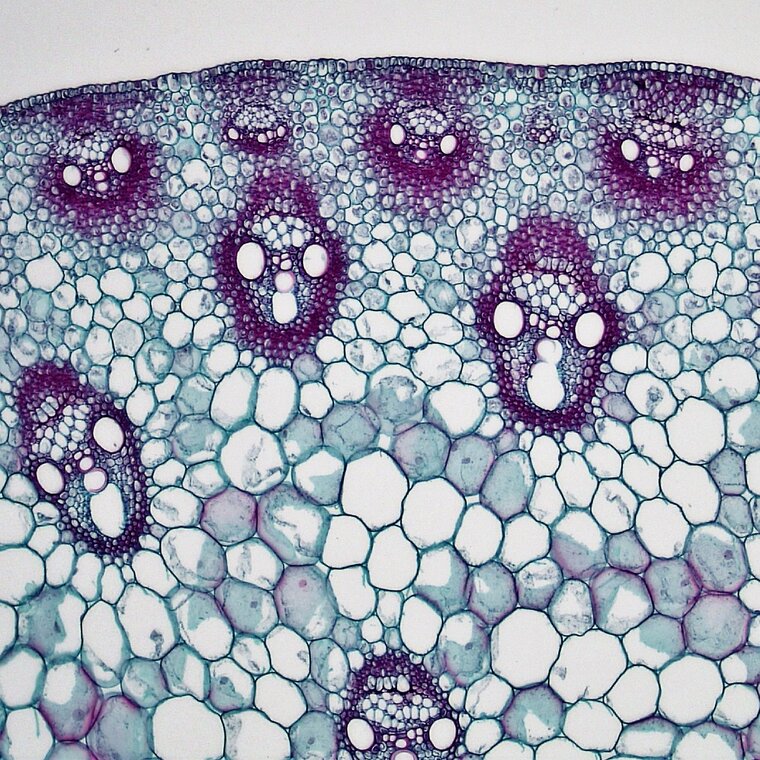
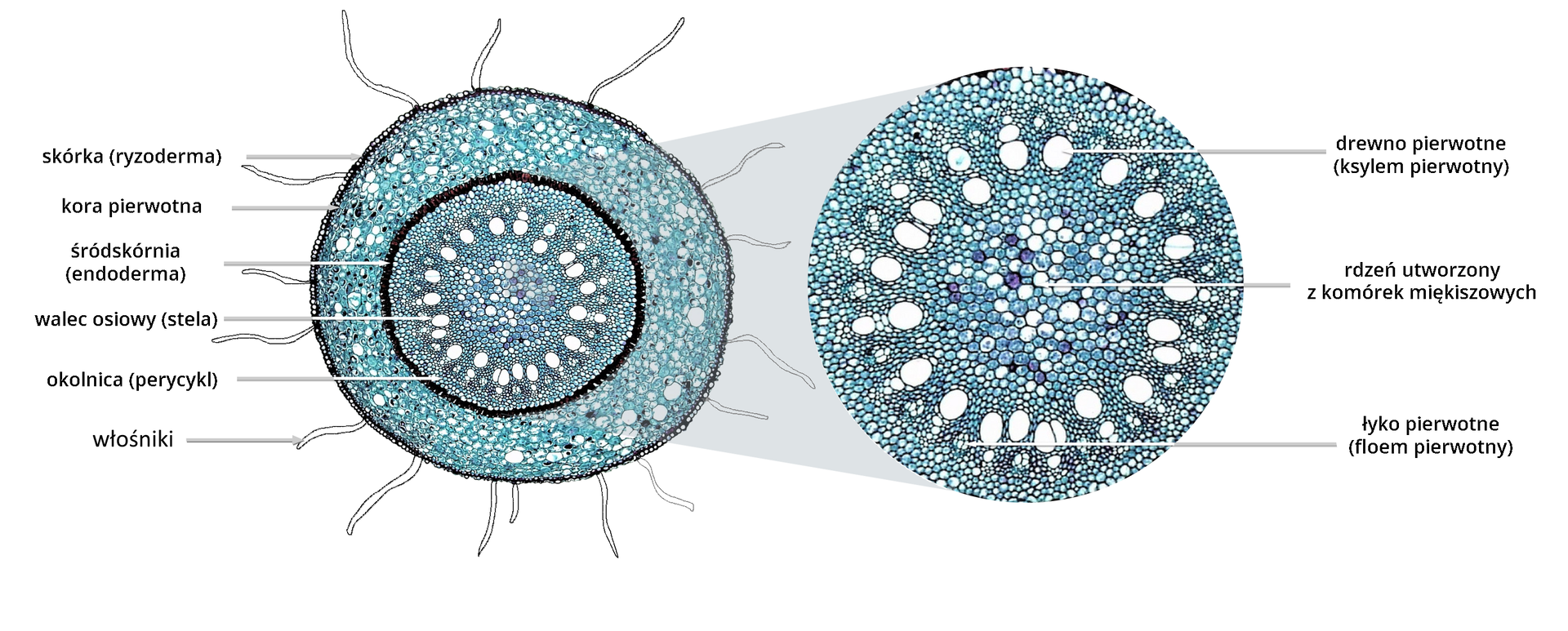
Budowa anatomiczna korzenia, którą stanowią tkanki stałe wytworzone przez merystem wierzchołkowy korzeniamerystem wierzchołkowy korzenia, określana jest jako budowa pierwotna.
W młodym korzeniu tkanki stałe tworzą układ charakterystyczny dla tego organu. Stało się to podstawą do wydzielenia trzech warstw tkanek, widocznych na przekroju poprzecznym korzenia. Stanowią je: skórka korzenia (ryzoderma)skórka korzenia (ryzoderma), kora pierwotnakora pierwotna oraz walec osiowy (stela)walec osiowy (stela).
Budowa wtórna korzenia

Typowy dla roślin dwuliściennych przyrost korzenia na grubość jest wynikiem aktywności dwóch tkanek twórczych wtórnych, miazgi (kambium) i miazgi korkotwórczej (fellogenu). Tkanki te powstają z przekształcenia określonych tkanek pierwotnych.
Obserwacja mikroskopowa tkanek roślinnych
Do obserwacji struktur tkankowych i komórkowych używa się głównie mikroskopów (z gr. mikros – mały, skopeo – patrzę, obserwuję) – przyrządów optycznych pozwalających na otrzymywanie powiększonych obrazów obiektów niewidocznych gołym okiem. Najczęściej stosowanym mikroskopem do obserwacji tkanek roślinnych jest mikroskop świetlny, który wykorzystuje wiązkę światła przechodzącą przez specjalny układ optyczny, tworzony przez zestaw soczewek umieszczonych w obiektywie i okularze.
Taka obserwacja jest jednak utrudniona, gdyż komórki i ich elementy nie wykazują różnic w absorpcji promieniowania elektromagnetycznego. Przekłada się to na brak wyraźnego kontrastu między poszczególnymi elementami. Nie ma więc możliwości rozróżnienia szczegółów budowy danej tkanki czy też elementów komórki. Z tego powodu w preparatach mikroskopowych niezbędne jest zastosowanie barwników histologicznych, które wybarwiają komórki wraz z ich elementami strukturalnymi, a tym samym umożliwiają ich dokładną obserwację i identyfikację.
Barwniki histologiczne
Barwniki histologiczne to związki chemiczne wykorzystywane w mikroskopii świetlnej do wybarwiania struktur komórkowych i tkankowych. Typowy barwnik zawiera dwie grupy chemiczne: chwytną i barwną. Część chwytna łączy się z elementami komórkowymi o określonym składzie chemicznym, natomiast barwna absorbuje światło o określonej długości fali, dzięki czemu możliwe jest dostrzeżenie wybarwionych struktur.
W zależności od struktury, jaką się będzie obserwować, należy zastosować odpowiedni barwnik histologiczny. Do wykrywania amyloplastów, czyli leukoplastów magazynujących skrobię, stosuje się jodek w jodku potasu, który barwi skrobię na kolor od jasnoniebieskiego do granatowego. Celulozowe ściany komórkowe wykrywa się za pomocą roztworu chlorku cynku z jodem, pod wpływem którego ściany komórkowe zbudowane z celulozy wybarwiają się na kolor fioletowy. Ściany komórkowe inkrustowane ligniną po zastosowaniu floroglucyny z kwasem solnym barwią się na kolor czerwony. Natomiast ściany komórkowe adkrustowane suberyną pod wpływem sudanu III nabierają barwy żółtoczerwonej.
Barwienie różnicowe
Aby odróżnić od siebie poszczególne struktury komórkowe i tkankowe, dany preparat należy potraktować jednocześnie dwoma różnymi barwnikami – jest to tzw. barwienie różnicowe. Dzięki tej technice można odróżnić m.in. zdrewniałe ściany komórkowe, które pod wpływem safraninysafraniny barwią się na kolor czerwony, od celulozowych ścian komórkowych, które pod wpływem zieleni świetlistej barwią się na kolor niebieskozielony. Innym przykładem barwników stosowanych w barwieniu różnicowym są: karmin ałunowy, barwiący ściany celulozowe na kolor czerwony, oraz zieleń metylenowa, barwiąca zdrewniałe ściany komórkowe na kolor zielony.
Jak przygotować preparat mikroskopowy z korzenia?
Obejrzyj film pokazujący, jak prawidłowo pobrać materiał roślinny w celu przygotowania preparatu mikroskopowego.
Zapoznaj się z opisem filmu pokazującego, jak prawidłowo pobrać materiał roślinny w celu przygotowania preparatu mikroskopowego.

Film dostępny pod adresem /preview/resource/RjkjLjOGoMNvK
Film nawiązujący do instrukcji pobierania materiału roślinnego.
Z rośliny o zielonych liściach za pomocą skalpela odcięto kawałek korzenia. Korzenie są cienkie, mają liczne rozgałęzienia. Następnie z pobranego fragmentu korzenia za pomocą skalpela odcięto fragment o grubości 1 milimetra. Pobrany fragment korzenia przecięto na pół i umieszczono na szkiełku podstawowym.
Podczas przygotowywania preparatu istnieje ryzyko pojawienia się artefaktówartefaktów, np. pęcherzyków powietrza. Jest to bardzo częste zjawisko towarzyszące samodzielnemu sporządzaniu preparatów. Duża liczba artefaktów uniemożliwia przeprowadzenie obserwacji mikroskopowych. W takiej sytuacji należy spróbować usunąć pęcherzyki powietrza poprzez delikatne ruchy góra‑dół, lewo‑prawo szkiełka nakrywkowego lub wykonać preparat na nowo.
Barwienie safraniną z zielenią trwałą
Przygotowanie roztworu do barwienia
Dodaj 20 mg safraninysafraniny w proszku do zlewki o pojemności 100 ml.
Wlej 20 ml wody destylowanej do zlewki i przez ciągłe mieszanie przygotuj 0,1‑procentowy roztwór barwiący safraniny.
Przenieś 20 mg zieleni trwałejzieleni trwałej do innej zlewki o pojemności 100 ml.
Dodaj do niej 20 ml wody destylowanej i przygotuj 0,1‑procentowy roztwór barwiący.
Przefiltruj oba roztwory barwiące.
Przygotowanie szkiełek do obserwacji
Nawodnij preparaty po deparafinizacji (przeprowadź przez szereg alkoholowy, zanurzając je kolejno w alkoholu: 99,8%, 90%, 80%, 70% i 50%, a następnie w wodzie).
Zanurz skrawki w 0,1‑procentowym roztworze zieleni trwałej na 5–10 minut.
Przepłucz szkiełka 0,1‑procentowyn kwasem octowym przez 10–15 sekund.
Zanurz szkiełka w 0,1‑procentowym roztworze safraniny na 20–30 minut.
Wyczyść i odwodnij szkiełka (odwodnienie w etanolu 95% i 100%).
Wyniki barwienia
Celulozowe ściany komórkowe pod wpływem zieleni trwałej barwią się na kolor niebieskozielony. Natomiast zdrewniałe ściany komórkowe pod wpływem safraniny barwią się na kolor czerwony.
Komórki o celulozowych ścianach komórkowych występują m.in. w: tkankach merystematycznych, ryzodermie, tkankach miękiszowych, kolenchymie i łyku. Z kolei komórki o zdrewniałych ścianach komórkowych obecne są m.in. w sklerenchymie i drewnie.
Słownik
struktury obserwowane w preparatach mikroskopowych powstałe podczas przygotowywania preparatów, niewystępujące w żywych komórkach lub tkankach
rejon znajdujący się między skórką a walcem osiowym (stelą), w którego skład wchodzą tkanka miękiszowa oraz śródskórnia (endoderma)
tkanka roślinna twórcza znajdująca się na wierzchołku korzenia; jej dzielące się komórki zapewniają korzeniowi wzrost na długość

zasadowy barwnik organiczny, trwały (odporny na działanie światła, wody, mydła itp.), stosowany w histologii i cytologii, używany podczas barwienia kontrastowego; wiąże się z DNA i innymi polianionami tkankowymi oraz składnikami ligniny w tkankach roślinnych
pierwotna tkanka okrywająca, zwykle jednowarstwowa
centralna część łodygi i korzenia; wewnątrz walca osiowego korzenia znajdują się tkanki przewodzące – drewno (ksylem) i łyko (floem); jego najbardziej zewnętrzną warstwę stanowi okolnica (perycykl), czyli jednowarstwowa tkanka merystematyczna umiejscowiona bezpośrednio pod śródskórnią (endodermą)
niebieskozielony barwnik rozpuszczalny w alkoholu; może być stosowany z safraniną jako barwnik do tkanek roślinnych