Przeczytaj
Aromatyczne kwasy karboksylowe
Aromatyczne kwasy karboksylowe to związki organiczne, w cząsteczkach których karboksylowa grupa funkcyjna związana jest z atomem węgla z pierścienia aromatycznego. Schematyczne wzory ogólne aromatycznych kwasów karboksylowych przedstawiono poniżej:

Kwas benzoesowyKwas benzoesowy to najprostszy aromatyczny kwas karboksylowy. Występuje naturalnie w wielu roślinach – np. w korze czereśni oraz malinach. Został odkryty już w wieku przez Nostradamusa w wyniku suchej destylacji gumy benzoinowej ( r.).

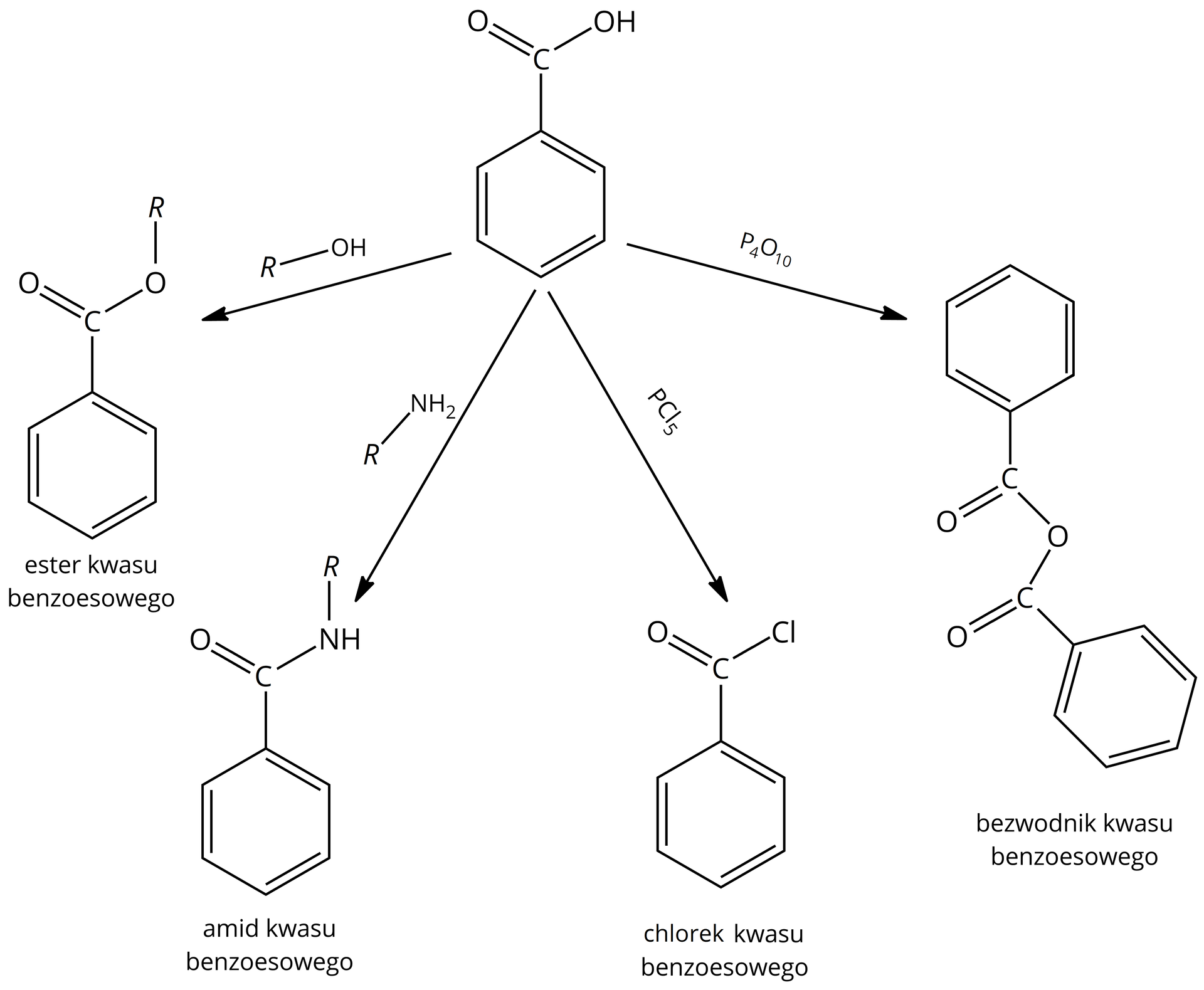
Otrzymywanie kwasu benzoesowego
Związek ten można otrzymać na wiele sposobów.
Właściwości fizyczne i chemiczne kwasu benzoesowego
Wygląd | |
|---|---|
stan fizyczny | ciało stałe |
kolor | biały |
zapach | bezwonny |
Inne parametry fizyczne i chemiczne | |
wartość stałej dysocjacji dla | |
temperatura topnienia/krzepnięcia | |
początkowa temperatura wrzenia | przy |
temperatura zapłonu | |
gęstość | przy |
rozpuszczalność w wodzie |
|
temperatura samozapłonu | |
właściwości wybuchowe | nie klasyfikuje się jako materiał wybuchowy |
właściwości utleniające | żadne |
Indeks górny Opracowano na podstawie: www.carlroth.com Indeks górny koniecOpracowano na podstawie: www.carlroth.com
Zastosowanie kwasu benzoesowego
Kwas benzoesowy jest stosowany w syntezie organicznej, np. do otrzymywania fenolu.
Kwas benzoesowy (E210) i jego sole (najczęściej benzoesan sodu – E211, benzoesan potasu – E212 i benzoesan wapnia – E213) to popularne konserwanty, stosowane w postaci dodatków do żywności, w celu jej utrwalenia i zapobiegania rozwojowi drożdży, grzybów i bakterii. Używane także do utrwalania: marynat, sosów, napojów gazowanych, soków owocowych, dżemów, marmolad, gum do żucia, margaryn i lodów.

Kwas salicylowy
Kwas salicylowy to związek organiczny, który stanowi pochodną kwasu benzoesowego. W swojej strukturze zawiera grupę karboksylową, przyłączoną do pierścienia benzenowego, oraz grupę hydroksylową w pozycji orto (względem grupy karboksylowej). Kwas ten naturalnie występuje w korze wierzby (łac. Salix). Po raz pierwszy został wyodrębniony właśnie z tej rośliny. Natomiast chemiczną metodę syntezy odkrył Hermann Kolbe w roku. Oparta jest ona na dwóch etapach otrzymywania tego kwasu z fenolanu sodu.
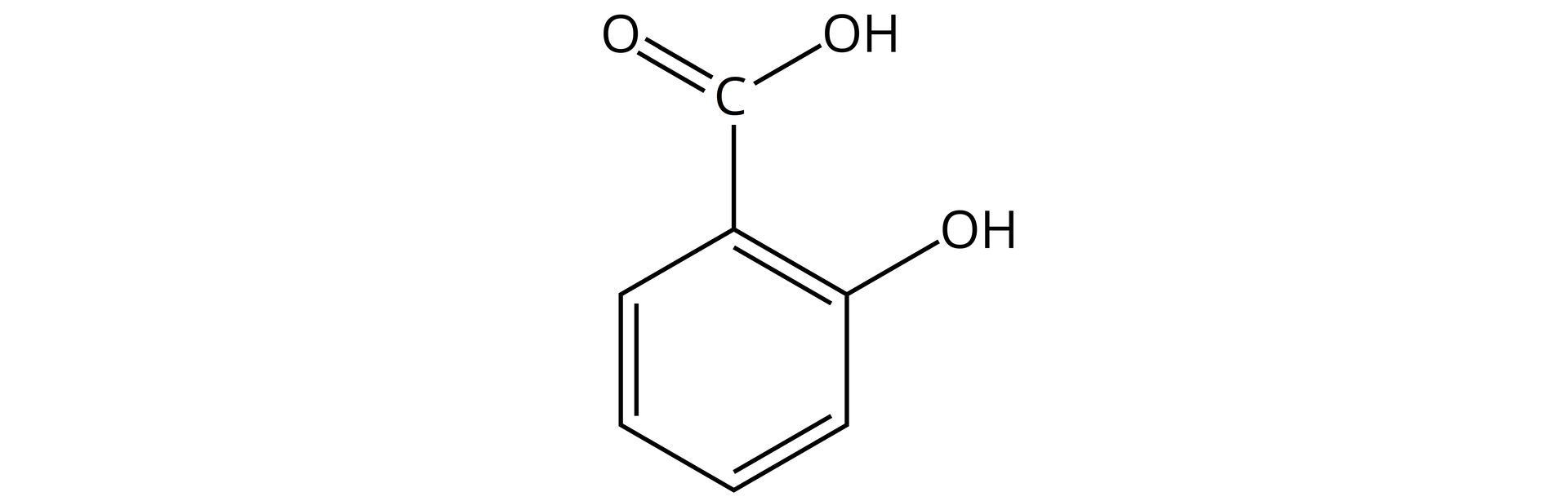
Otrzymywanie kwasu salicylowego
Kwas salicylowyKwas salicylowy otrzymuje się w wyniku reakcji Kolbego‑Schmitta. Jest to dwuetapowa metoda syntezy, która przebiega pod wysokim ciśnieniem i w wysokiej temperaturze. W pierwszym etapie, tlenek węgla() działa na fenolan sodu. Na skutek tego elektrofilowego ataku powstaje salicylan sodu. W drugim etapie salicylan sodu jest zakwaszany i w efekcie otrzymywany jest m.in. kwas salicylowy.

Właściwości fizyczne i chemiczne kwasu salicylowego
Wygląd | |
|---|---|
stan fizyczny | ciało stałe |
kolor | biały |
zapach | bezwonny |
Inne parametry fizyczne i chemiczne | |
wartość stałej dysocjacji dla | () |
temperatura topnienia/krzepnięcia | – |
początkowa temperatura wrzenia | |
temperatura zapłonu | |
gęstość | przy |
rozpuszczalność w wodzie | przy |
temperatura samozapłonu | |
właściwości wybuchowe | nie klasyfikuje się jako materiał wybuchowy |
właściwości utleniające | żadne |
Indeks górny Opracowano na podstawie: www.carlroth.com Indeks górny koniecOpracowano na podstawie: www.carlroth.com
Zastosowanie kwasu salicylowego
Kwas salicylowy, podobnie jak kwas benzoesowy, jest odczynnikiem szeroko rozpowszechnionym w syntezie organicznej. Jednym z najważniejszych jego zastosowań jest wykorzystanie go do produkcji kwasu acetylosalicylowego, czyli aspiryny. Powstaje ona w wyniku reakcji kwasu salicylowego z bezwodnikiem octowym, w obecności katalizatora (np. kwasu siarkowego()).

Kwas salicylowy stosowany jest również do otrzymywania kwasu -aminosalicylowego, będącego lekiem przeciwgruźliczym. Kwas salicylowy stosuje się jako środek dezynfekujący (np. do produkcji spirytusu salicylowego) oraz w lekach na trądzik. Dawniej, podobnie jak kwas benzoesowy, stosowany był jako konserwant żywności, jednak został wycofany z uwagi na znaczącą toksyczność przy stosowaniu go w żywności w wyższych stężeniach.

Już od czasów Hipokratesa (– r. p.n.e.) znane były przeciwbólowe właściwości soku z kory wierzby (z łac. Salix). Obecnie wiadomo, że w korze wierzby naturalnie występuje kwas salicylowy. A jak to się stało, że odkryto inną drogę pozyskiwania tego lekarstwa? Otóż, kiedy za czasów Napoleona w roku wprowadzono blokadę kontynentu, najpowszechniejszy ówcześnie środek przeciwgorączkowy – chinina – nie mógł być importowany z Peru do Europy. Naukowcy pilnie poszukiwali alternatywnej substancji. Dzięki Johann’owi Andreas’owi Buchner’owi w roku zaczęto produkować żółtą masę z kory wierzby. Rok później Leroux otrzymał formę krystaliczną kwasu salicylowego. Blisko cztery dekady później, Hermann Kolbe otrzymał po raz pierwszy syntetycznie kwas salicylowy, choć wcale nie miał tego w planach – jego celem było otrzymanie indygo (ciemnobłękitnego barwnika).
Słownik
związki organiczne, w których cząsteczkach karboksylowa grupa funkcyjna związana jest z pierścieniem aromatycznym
(łac. acidum salicylicum „kwas salicylowy”) organiczny związek chemiczny, który należy do grupy aromatycznych hydroksykwasów karboksylowych; w swojej strukturze zawiera jedną grupę karboksylową i jedną grupę hydroksylową, która znajduje się w pozycji
(łac. acidum benzoicum „kwas benzoesowy”) (E210) organiczny związek chemiczny, będący najprostszym karboksylowym kwasem aromatycznym; w swojej strukturze zawiera jedną grupę karboksylową przyłączoną do pierścienia benzenowego
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.