Przeczytaj
Reakcja endotermiczna
Reakcje chemiczne możemy podzielić na reakcje endotermicznereakcje endotermiczne, które potrzebują ciepła oraz egzotermiczneegzotermiczne, które to ciepło oddają. Schematycznie traktując ciepło „Q”, jako jeden z reagentów, omówimy wpływ temperatury na stan równowagi.
Przeanalizujmy hipotetyczną reakcję przebiegającą zgodnie z poniższym równaniem:
Oznaczając ciepło „Q”, zapisujemy je po stronie substratów jako jeden z elementów reakcji. W ten sposób uzyskamy zapis:
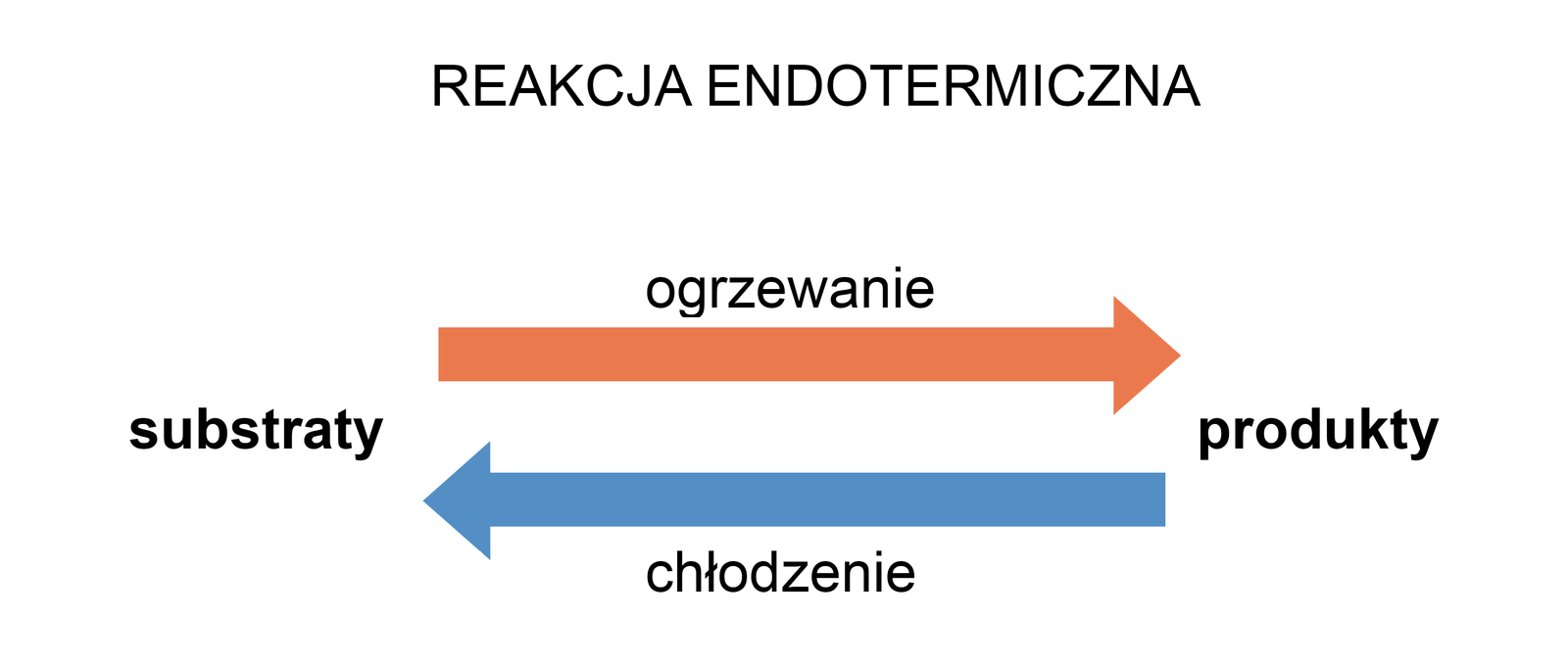
Przyjmijmy, że w układzie ustalił się już stan równowagi. W takiej sytuacji, podnosząc temperaturę, dostarczamy do układu ciepło (Q), które pełni rolę substratu. Układ zostaje zatem wytrącony ze stanu równowagi. Aby przywrócić ów stan, rozpoczyna się proces, w czasie którego układ działa „na przekór” i zużywa dostarczone ciepło. W takiej sytuacji stan równowagi przesunie się w stronę syntezy związku C.
Gdy z kolei zaczniemy ochładzać układ znajdujący się w stanie równowagi, to odbieranie ciepła będzie równoznaczne z odbieraniem jednego z substratów. Wytrącony w ten sposób ze stanu równowagi układ zaczyna odbierane przez nas ciepło odtwarzać. W ten sposób stan równowagi przesuwa się w stronę syntezy związków A i B.
Reakcja rozkładu pary wodnej na pierwiastki jest reakcją endotermiczną. Zakładając, że reakcja biegnie w układzie zamkniętym przy p, V=const, zapisz odpowiednie równanie reakcji, uwzględniając w nich ciepło (oznacz je literą Q). Napisz, jak na położenie stanu równowagi wpłynie ogrzewanie i ochładzanie układu.
Reakcja egzotermiczna
Przeanalizujmy hipotetyczną reakcję:
Oznaczając ciepło „Q”, zapisujemy je po stronie produktów jako jeden z elementów reakcji. W ten sposób uzyskamy zapis:
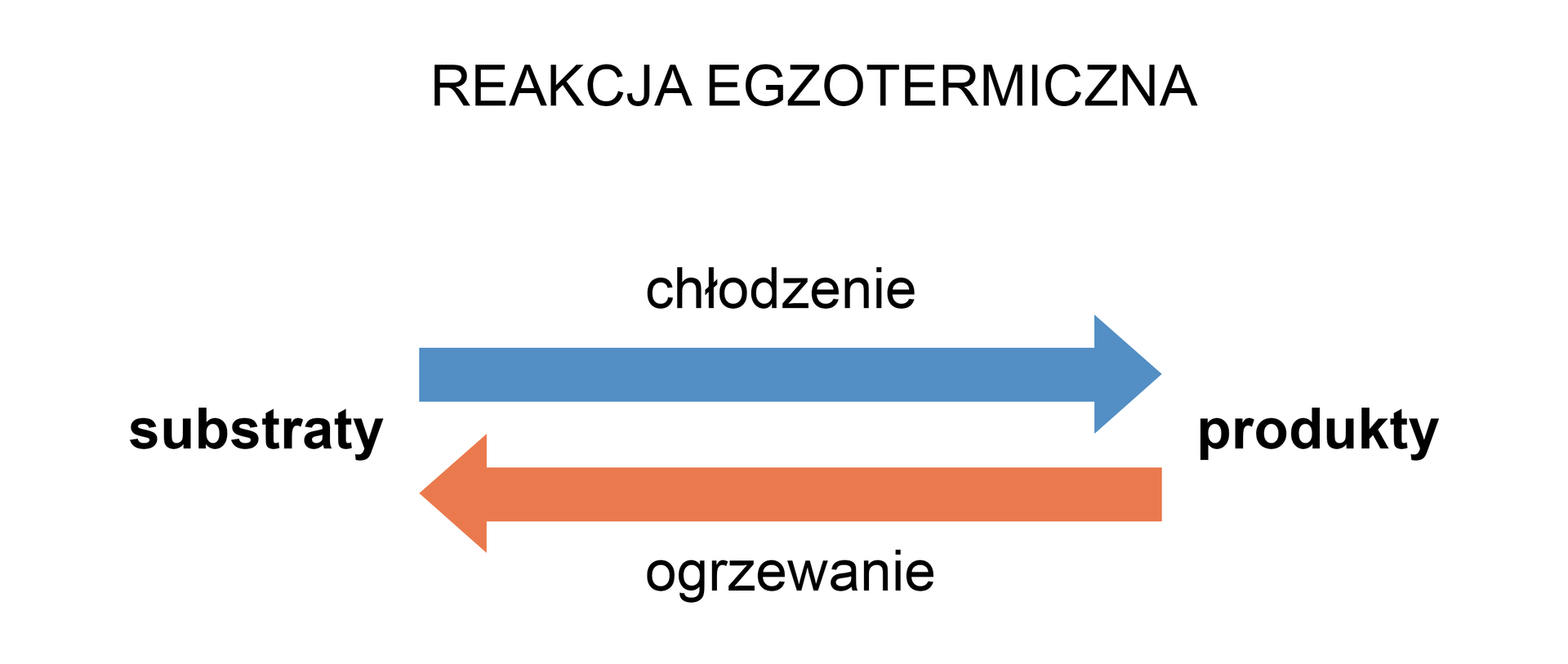
Przeanalizujmy, co się stanie, jeśli układ, w którym ustalił się już stan równowagi, zaczniemy ogrzewać. Układ zaczyna powracać do stanu równowagi, czyli obniżenia temperatury. Zgodnie z regułą przekory, stan równowagi przesunie się w stronę rozkładu związku C – rozkład C to proces zużywający dostarczane przez nas ciepło.
Gdy zaś zaczniemy ochładzać układ znajdujący się w stanie równowagi, odbierzemy z układu ciepło (Q). Układ znów zacznie dążyć do stanu równowagi i zacznie się proces wytwarzający ciepło. Zgodnie z regułą przekory, stan równowagi przesunie się w kierunku produktów.
Reakcja spalania metanu w tlenie do tlenku węgla(IV) i wody jest reakcją egzotermiczną. Zakładając, że reakcja biegnie w układzie zamkniętym przy p, V=const, zapisz odpowiednie równanie reakcji, uwzględniając w nich ciepło (oznacz je literą Q). Napisz, jak na położenie stanu równowagi wpłynie ogrzewanie i ochładzanie układu.
Podsumowując, trzeba zaznaczyć, że każda zmiana temperatury w reakcjach egzotermicznych i endotermicznych powoduje przesunięcie położenia równowagi. W przypadku reakcji endotermicznych, dostarczenie ciepła przesuwa stan równowagi w kierunku syntezy produktów. Ochłodzenie układu wywołuje skutek odwrotny, czyli przesunięcie stanu równowagi w kierunku substratów. W przypadku reakcji egzotermicznych, dostarczenie ciepła przesuwa stan równowagi w kierunku substratów, a ochłodzenie układu w kierunku produktów.
Słownik
reakcja chem., która przebiega w warunkach izobaryczno‑izotermicznych (pod stałym ciśnieniem i w stałej temperaturze) z wydzielaniem ciepła do otoczenia
reakcja chem., która przebiega w warunkach izobaryczno‑izotermicznych (pod stałym ciśnieniem i w stałej temperaturze) z pochłanianiem ciepła z otoczenia
reguła, wg której układ w stanie równowagi chem., poddany działaniu czynnika z zewnątrz, reaguje w taki sposób, żeby zmniejszyć wpływ tego czynnika i osiągnąć nowy stan równowagi, możliwie niezbyt odległy od stanu równowagi wyjściowej
Bibliografia
Hejwowska S., Marcinkowski R., Staluszka J., Równowagi i procesy jonowe Chemia 3, Gdynia 2006.
Encyklopedia PWN
Kaznowski K., Pazdro K., Chemia podręcznik dla liceów i techników Warszawa 2019.
Litwin M., Styka‑Wlazło S., Szymońska J., To jest chemia 1, Warszawa 2013.