Przeczytaj
Sole kwasów karboksylowych
Sole kwasów karboksylowych powstają w wyniku reakcji zobojętnieniareakcji zobojętnienia kwasów karboksylowych z roztworem wodorotlenku.
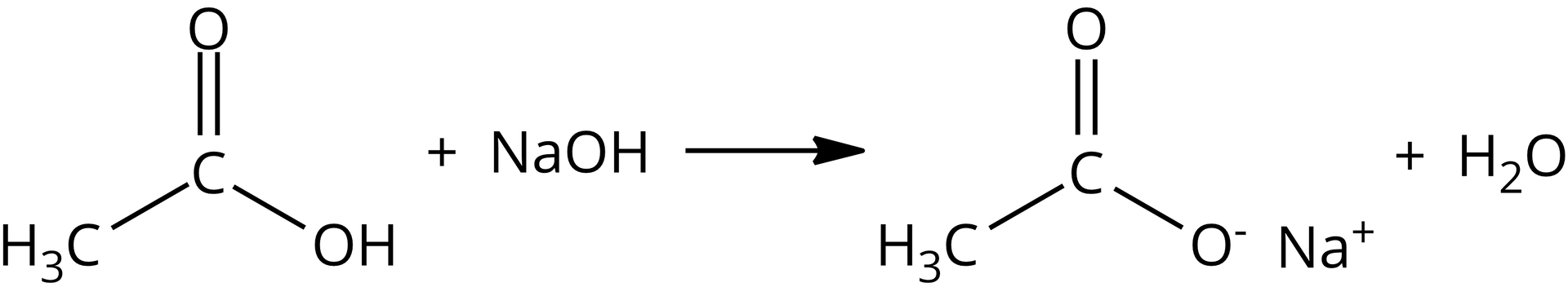
Jak możesz zauważyć, w wyniku tej reakcji atom wodoru grupy hydroksylowej został zastąpiony jonem sodu. Czy to jest jedyna różnica? Zwróć uwagę na zmianę charakteru wiązania. W grupie hydroksylowej między atomem tlenu a atomem wodoru występuje wiązanie kowalencyjne spolaryzowanewiązanie kowalencyjne spolaryzowane. Po reakcji następuje zmiana charakteru wiązania na jonowejonowe, w wyniku czego otrzymujemy anion octanowy (reszty kwasowej) oraz kation sodu .
Skąd jednak wiemy, że jon metalu połączył się z atomem tlenu grupy hydroksylowej? Odpowiedź jest zaskakująco prosta, przecież widać to ze wzoru strukturalnego
– możesz tak pomyśleć. Jednak z badań z wykorzystaniem rentgenografii strukturalnej wynika, że nie można jednoznacznie określić, do którego tlenu bezpośrednio przyłącza się jon metalu.
Jest to związane z długością wiązań – średnie wartości długości wiązania grupy karbonylowej wynoszą 1,214 ÅÅ [czyt.: angsztrem], wiązanie ma długość 1,308 Å. Natomiast w przypadku struktur krystalicznych soli kwasów karboksylowych, wiązanie i wiązanie ma taką samą długość 1,254 Å. Wzór octanu sodu powinniśmy narysować następująco:
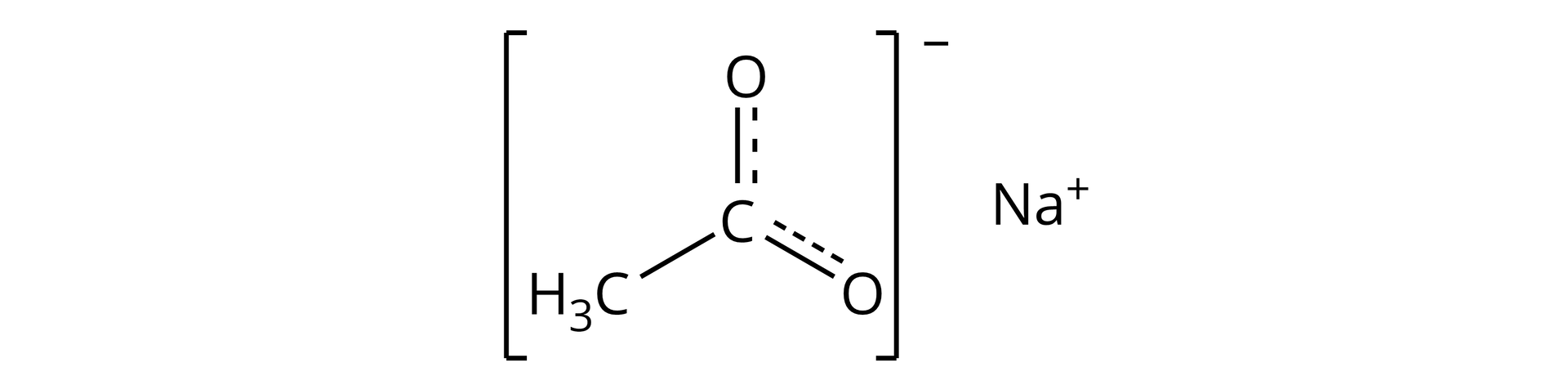
Wiązanie między atomami węgla i tlenu ulega uśrednieniu, formalnie możemy je nazwać wiązaniem półtora (jedno i pół wiązania). Elektrony są rozmyte pomiędzy tymi dwoma atomami tlenu. Stąd wynika uśrednienie wiązania.
Wzory grupowe soli kwasów karboksylowych powinniśmy zapisywać, pamiętając o ładunkach. W przypadku wzoru kwasu octowego, zapisujemy:
Nazwy soli kwasów karboksylowych tworzy się podając nazwę anionu karboksylanowego, który pochodzi od danego kwasu karboksylowego, oraz nazwę kationu, np.:
Sole kwasów karboksylowych z więcej niż jednym jonem metalu
W przypadku nazywania soli kwasów karboksylowych z więcej niż jednym atomem metalu, zachowujemy nazwę kwasu i dodajemy końcówkę „-an”, zaś metale wymieniamy w kolejności alfabetycznej. Winian potasu sodu to nazwa niezalecana przez IUPAC, ale możesz się z nią spotkać. Poprawna nazwa tej soli to butanodian potasu sodu.
Wzór grupowy tej soli to:
Oba sposoby rysowania wzorów są poprawne, jednak wzór z zastosowaniem uśrednienia jest bliższy prawdzie.
Przy zapisywaniu wzorów grupowych czy strukturalnych, nie zapomnij o zapisaniu odpowiednich ładunków. Pamiętaj, że wzory soli możesz także zapisywać bez zapisywania ładunków, nigdy jednak nie dawaj kreski pomiędzy atomem tlenu a atomem metalu, co stanowi wówczas bardzo poważny błąd – sole są bowiem związkami jonowymi.
Słownik
neutralizacja, reakcja chemiczna między kwasem i zasadą, której produktami są woda i sól
kowalencyjne wiązanie chemiczne między atomami różnych pierwiastków; w wiązaniu tym chmura elektronów tworzących je ma większą gęstość w pobliżu jednego z atomów (atomu pierwiastka chemicznego o większej elektroujemności)
(heteropolarne, elektrowalencyjne) tworzy się wskutek elektrostatycznego przyciągania się jonów o różnych ładunkach elektrycznych
Å; jednostka długości stosowana do wyrażania bardzo małych długości, np. długości fal świetlnych, rozmiarów atomów i cząsteczek; 1 Å = 0,1 nm = 10Indeks górny –10–10 m
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J. E., Fundamentals of General, Organic, and Biological Chemistry, 6th Edition, 2007.
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.