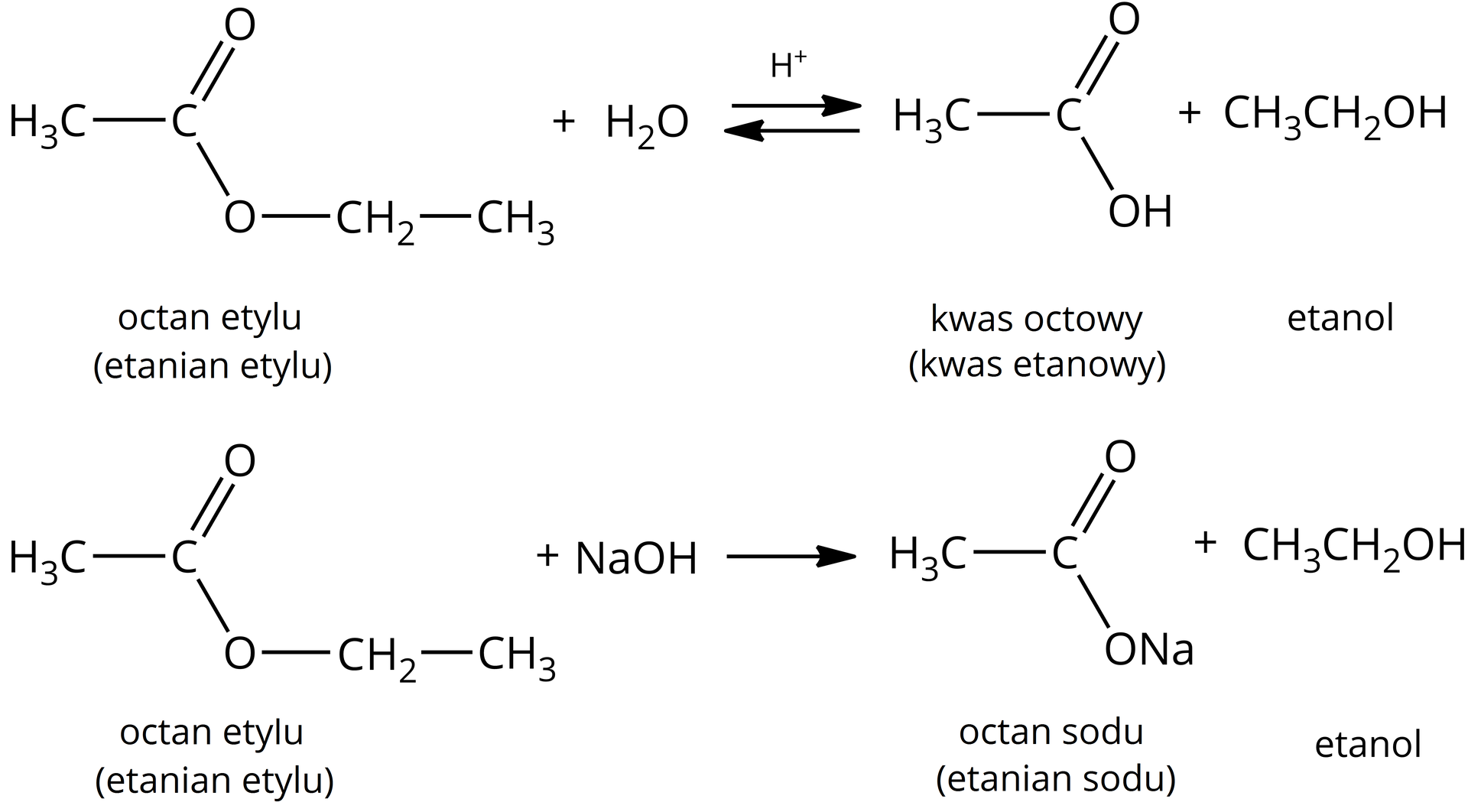
Przeczytaj
Hydroliza estrów
Doświadczenie
W oparciu o problem badawczy, zaproponuj hipotezę, a następnie przeprowadź doświadczenie. Skorzystaj ze schematu doświadczenia i zapisz swoje obserwacje, wnioski i równania zachodzących reakcji chemicznych.
Schemat doświadczenia:
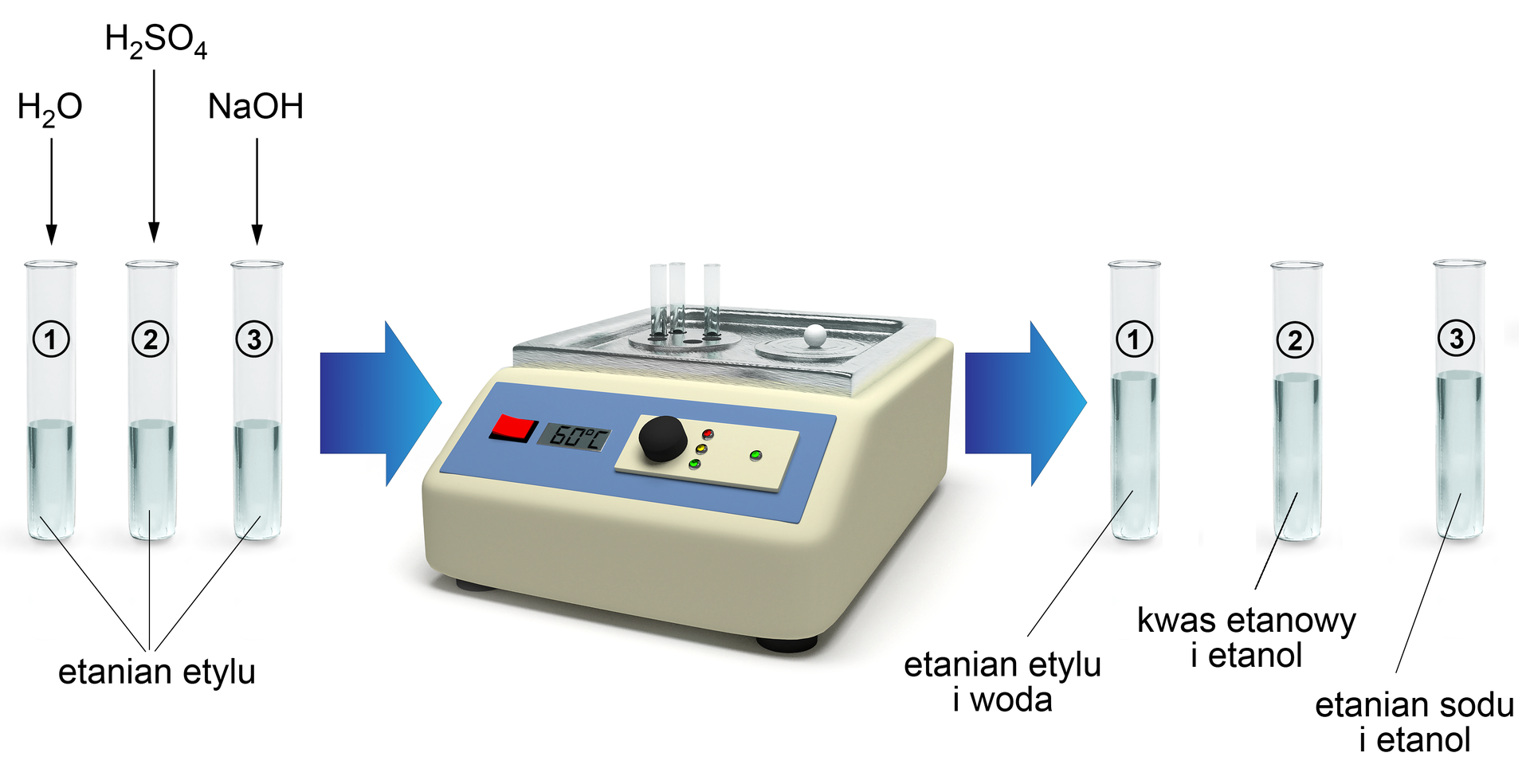
Podsumowanie:
Estry mogą ulegać hydrolizie w środowisku kwasowym oraz zasadowym. Hydroliza estrów w środowisku kwasowym jest reakcją odwracalną – odwrotną do reakcji estryfikacji. Powstają w niej kwas karboksylowy oraz alkohol lub fenol. Hydroliza estrów w środowisku zasadowym jest praktycznie nieodwracalna. Powstają w niej sól kwasu karboksylowego oraz alkohol lub fenoksylan (fenolan).
Ogólny zapis reakcji hydrolizy estru w środowisku kwasowym

Ogólny zapis reakcji hydrolizy estru w środowisku zasadowym

Aminoliza estrów
Reakcja estrów z amoniakiem lub aminami, w której powstają amidy i alkohol lub fenol, nosi nazwę aminolizy.

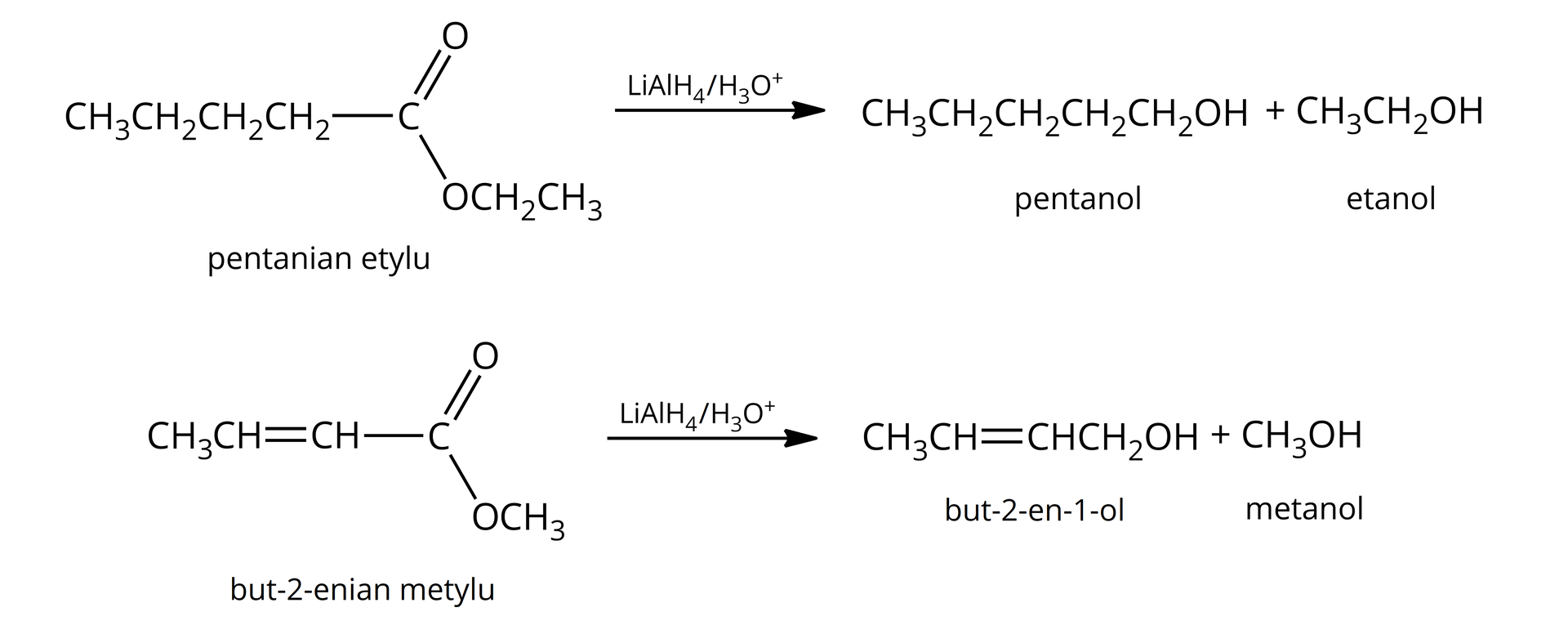
Redukcja estrów
Estry reagują z anionem wodorkowym, który pochodzi z tetrahydroglinianu litu w środowisku kwasowym, redukując się do pierwszorzędowych alkoholi.
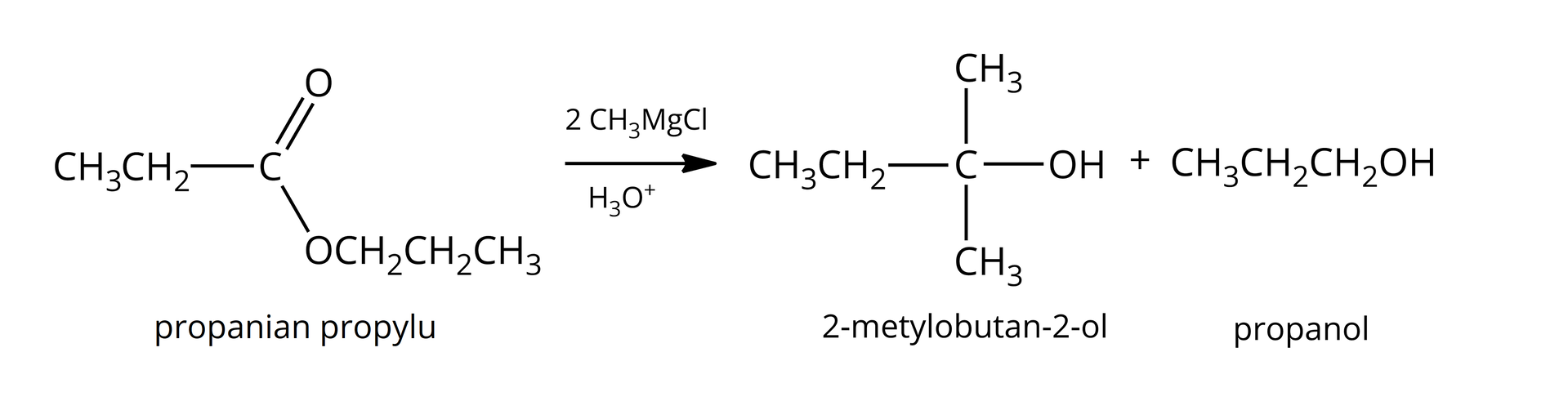
Reakcja ze związkami Grignarda (metaloorganicznymi)
Estry reagują ze związkami GrignardaGrignarda, tworząc alkohole trzeciorzędowe, które posiadają przynajmniej dwa identyczne podstawniki przy atomie węgla, połączonym z grupą .
Słownik
związki posiadające wiązanie ; ich wzór ma postać , gdzie:
stanowi grupę alkilową lub arylową
to ,
przykładem takiego związku jest , czyli chlorek metylomagnezowy
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.