Przeczytaj
Podatność halogenopochodnych węglowodorów na substytucję nukleofilowąsubstytucję nukleofilową należy rozpatrywać osobno dla dwucząsteczkowego podstawienia nukleofilowego i osobno dla jednocząsteczkowego podstawienia nukleofilowego . Wynika to z różnego mechanizmu, tzn. innego przebiegu tych reakcji. Jednak struktura halogenku alkilowego, jako substratu w obu typach substytucji, ma największy wpływ na szybkość ich zachodzenia.
Najwolniejszym etapem substytucji nukleofilowej typu jest tworzenie karbokationukarbokationu, w wyniku działania nukleofilanukleofila, na halogenek alkilowy. Proces ten zachodzi znacznie szybciej, jeżeli halogen nie jest otoczony podstawnikami o dużej objętości, ponieważ grupy te utrudniają dojście nukleofila do atomu węgla związanego z halogenem i utworzenie wiązania.
Utworzenie wiązania z nukleofilem jest wyżej energetyczne w przypadku sterycznego osłaniania atomu węgla, czyli występowania podstawników, które utrudniają atak nukleofila. Dlatego substytucji typu najchętniej ulegają halogenki metylowe oraz pierwszorzędowe, ponieważ nie występuje tam tzw. zawada steryczna, czyli pozostałe podstawniki nie przysłaniają dostępu do halogenu.

Najbardziej podatne na atak nukleofila są halogenki metylowe, następnie halogenki pierwszorzędowe i w dalszej kolejności halogenki drugorzędowe. Natomiast halogenki trzeciorzędowe praktycznie nie ulegają reakcji typu .
Warto podkreślić, że halogenki arylowe oraz winylowe nie ulegają reakcji typu ze względu na brak możliwości ataku nukleofila ze strony przeciwnej od halogenu, tak jak to ma miejsce w mechanizmie tego typu substytucji.
W przypadku substytucji typu , najwolniejszym etapem reakcji jest rozpad homolitycznyrozpad homolityczny halogenu w halogenku alkilowym, co prowadzi do powstania karbokationu. Im trwalszy powstanie karbokation, tym łatwiej i szybciej zachodzi substytucja typu . A najbardziej trwały jest wtedy, gdy charakteryzuje się największą stabilnością. Właściwość ta wynika z rzędowości karbokationu i zmienia się w następujący sposób:
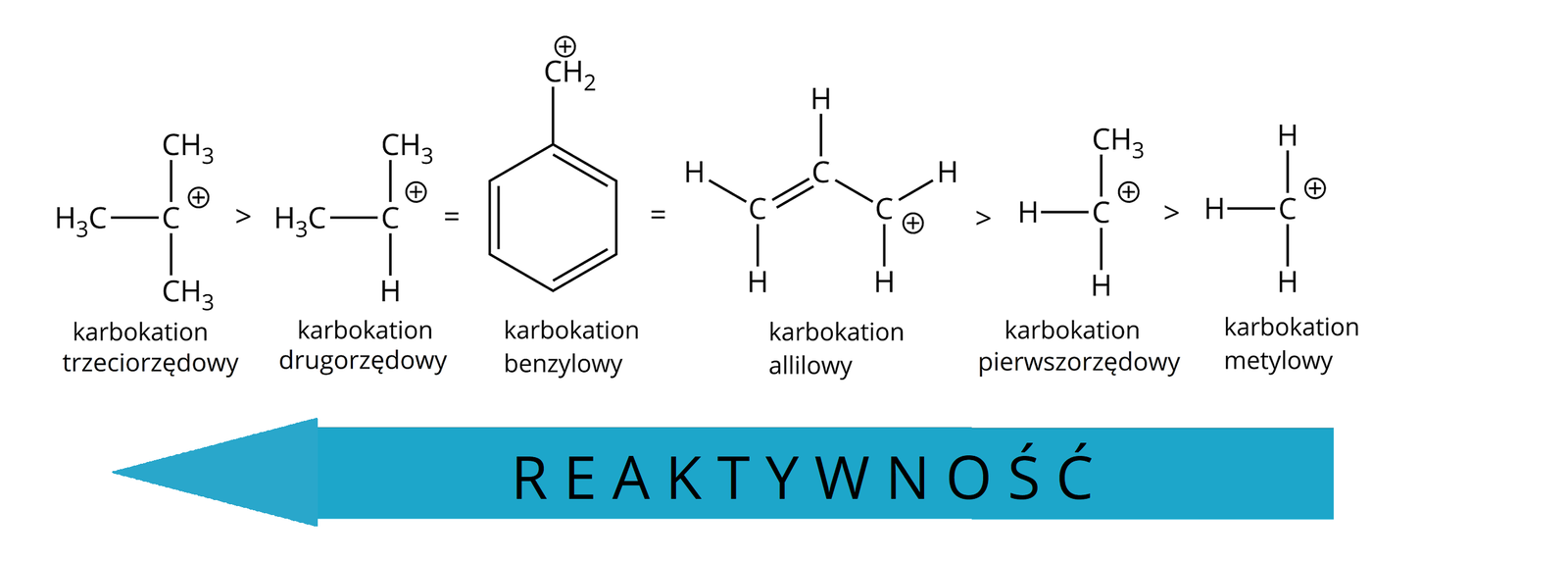
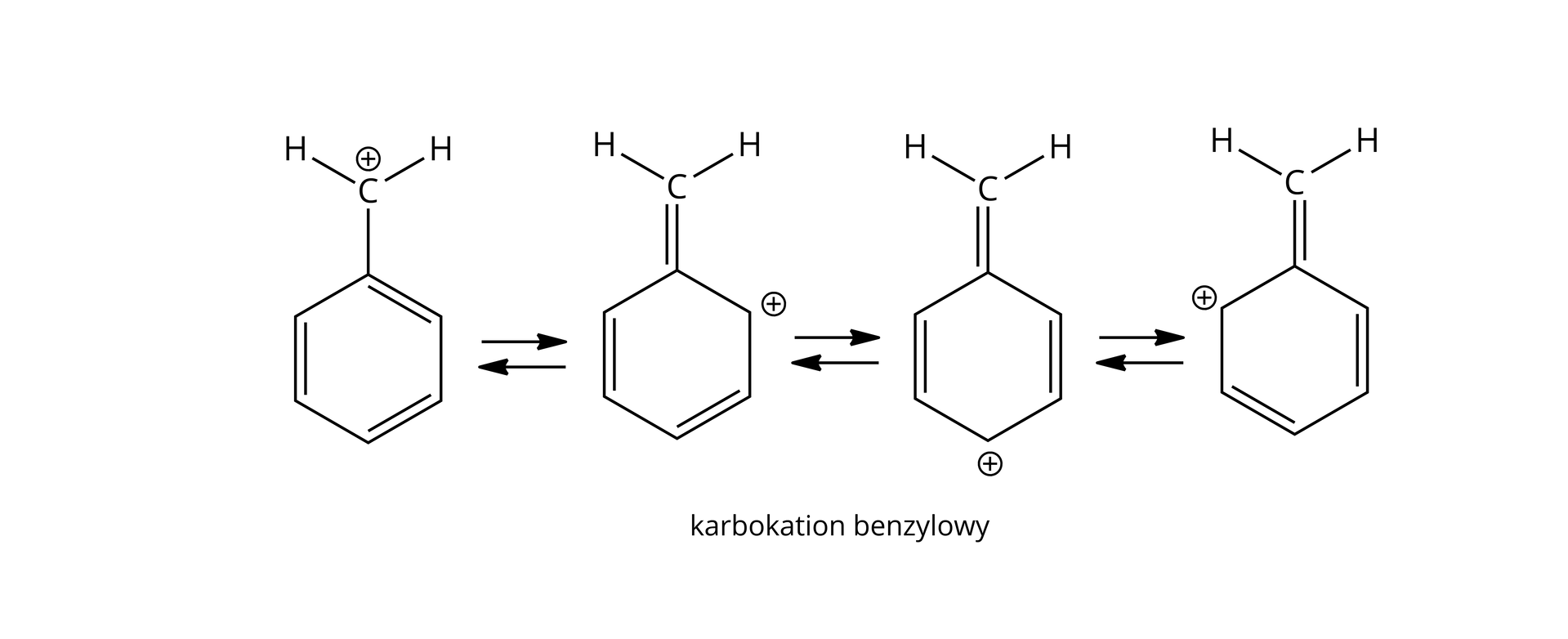
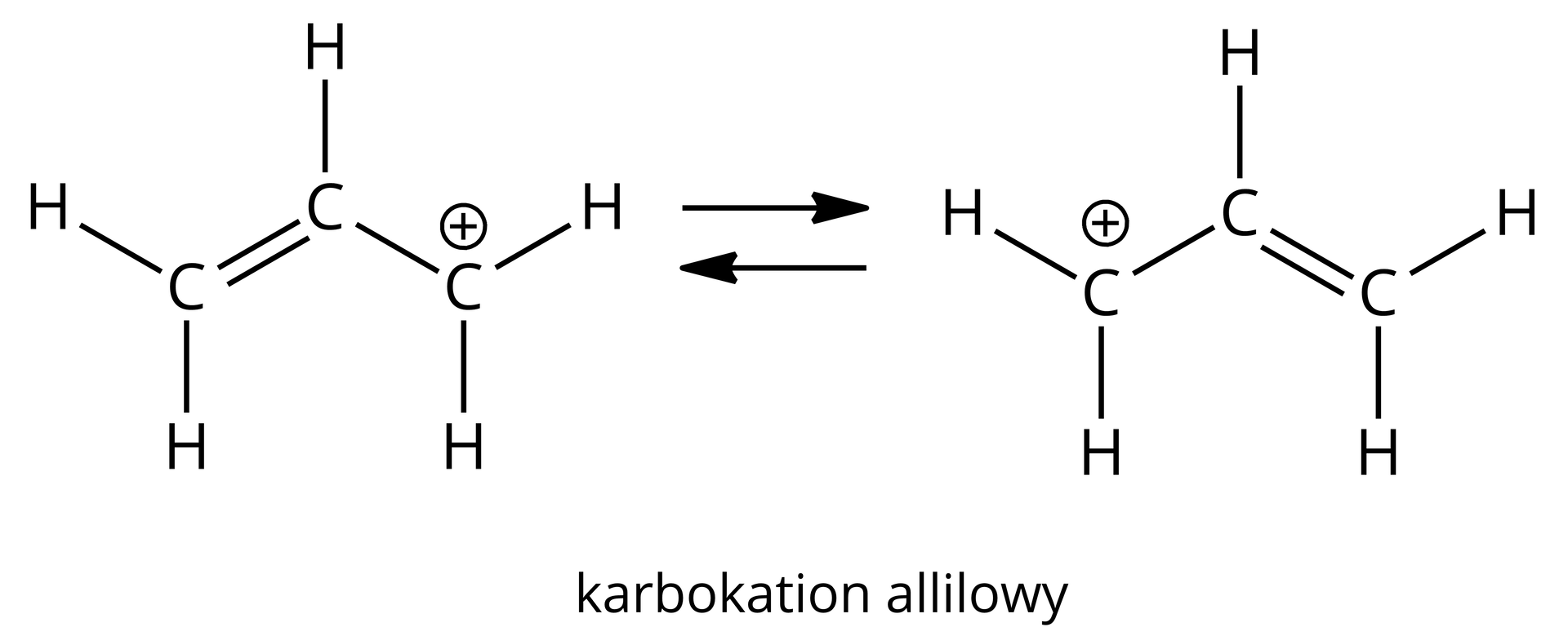
Im wyżej rzędowa halogenopochodna węglowodoru, tym mniej energii potrzeba do jej rozpadu homolitycznego. Wynika to z faktu, że karbokationy o wyższej rzędowości, które powstają po rozpadzie, charakteryzują się większą trwałością i stabilnością. Stąd substytucji nukleofilowej typu najchętniej ulegają trzecio- i drugorzędowe halogenopochodne węglowodorów. Również powstające jako produkty przejściowe karbokationy – benzylowy i allilowy – są bardzo trwałe dzięki stabilizacji, przez powstające struktury rezonansowe:
Słownik
reakcja podstawienia, polegająca na wymianie grupy związanej z atomem węgla na odczynnik nukleofilowy (oznaczany często jako ); podstawnikiem jest przeważnie grupa elektronoakceptorowa, która polaryzuje wiązanie (np. , , ) następnie odchodzi z parą elektronową, zaś nukleofilem jest drobina obdarzona ładunkiem ujemnym bądź/i parą elektronową
indywiduum chemiczne obdarzone ładunkiem ujemnym (np. , , ) lub cząsteczka obojętna, posiadająca wolne pary elektronowe (np. , , ); zasady Lewisa
(łac. carbo „węgiel” gr. katiṓn „idący w dół”) jon karboniowy, kation organiczny, w którym dodatni ładunek wywołany deficytem elektronów jest zlokalizowany na atomie węgla
związki chemiczne, w których atom fluorowca przyłączony jest do grupy alkilowej
rozpad homolityczny, reakcja homolityczna; rozerwanie wiązania kowalencyjnego w cząsteczce związku chemicznego, przebiegające z utworzeniem atomów lub rodników; w reakcji homolitycznej para elektronów tworząca wiązanie chemiczne zostaje rozdzielona w taki sposób, że przy każdym z atomów połączonych uprzednio wiązaniem pozostaje jeden elektron; przykładem homolizy jest dysocjacja cząsteczek chloru pod wpływem światła:
Bibliografia
Encyklopedia PWN
McMurry J., Chemia organiczna, Warszawa 2000.