Przeczytaj
Uwzględniając rodzaj wiązań, który decyduje o właściwościach fizycznych kryształów wyróżniamy:
Kryształy molekularne
Kryształy molekularneKryształy molekularne są zbudowane z odrębnych cząsteczek, które weszły w interakcję dzięki oddziaływaniom międzycząsteczkowym (van der Waalsa). Takie struktury tworzą związki organiczne lub zestalone gazy. Wspomniane oddziaływania między cząsteczkami są słabe, co skutkuje m.in. stosunkowo małą twardością kryształów molekularnych i niską temperaturą topnienia. Przykładowymi związkami chemicznymi, które tworzą analizowane kryształy są jod oraz naftalen (popularnie nazywany naftaliną). Dodatkowo warto wspomnieć, że kryształy molekularne:
nie przewodzą prądu elektrycznego,
nie ulegają dysocjacji jonowej,
słabo rozpuszczają się w wodzie i innych rozpuszczalnikach polarnych,
dobrze rozpuszczają się w niepolarnych rozpuszczalnikach (np. benzen, benzyna),
mają niskie temperatury topnienia,
są bardzo reaktywne.
W kryształach molekularnych niektórych niepolarnych substancji, oddziaływania między drobinami są na tyle słabe, że pojedyncze cząsteczki mogą odrywać się od kryształu (ciała stałego), zmieniając tym samym stan skupienia na gazowy. Opisana przemiana to sublimacja. Przykładem substancji, która stosunkowo łatwo ulega sublimacji jest jod. Proces odwrotny do sublimacji to resublimacja.
Kryształy kowalencyjne
W kryształach kowalencyjnychkryształach kowalencyjnych (atomowych) atomy są ze sobą związane za pomocą wiązań kowalencyjnych. Podobnie jak w kryształach jonowych, także w kryształach atomowych traci sens pojęcie cząsteczki. W analizowanych układach nie można bowiem wyróżnić pojedynczych cząsteczek – cały kryształ kowalencyjny (atomowy) trzeba traktować jako jedną olbrzymią cząsteczkę. Sztandarowym przykładem kryształu kowalencyjnego jest diament. W sieci krystalicznej diamentu, każdy atom węgla łączy się z czterema innymi atomami węgla za pomocą wiązań kowalencyjnych. Regularna sieć przestrzenna diamentu sprawia, że jest on najtwardszą znaną substancją – przypisuje mu się twardość 10 w skali Mohsa. Wykorzystanie wszystkich elektronów walencyjnych atomów węgla do utworzenia wiązań kowalencyjnych powoduje, że diament jest izolatorem elektrycznym. Podobny układ występuje w krzemie i germanie.
Dodatkowo, kryształy kowalencyjne:
nie ulegają dysocjacji jonowej,
mają wysoką temperaturę topnienia,
są niereaktywne.


Kryształy jonowe
Kryształy jonowe są tworzone tylko przez związki chemiczne o budowie jonowej, m.in. tlenki i sole metali i grupy układu okresowego. W stanie stałym związki te tworzą jonowe sieci krystaliczne, w których na przemian rozmieszczone są jony dodatnie i ujemne.
Przykładowymi związkami chemicznymi, które tworzą kryształy jonowekryształy jonowe są:
tlenki metali alkalicznych, np.: tlenek sodu, tlenek potasu,
wodorotlenki metali alkalicznych, np. wodorotlenek litu,
sole metali alkalicznych, np.: chlorek sodu, jodek potasu.
Analizowane kryształy zbudowane są z jonów rozmieszczonych równomiernie w sieci krystalicznej. Jony te działają na siebie siłami przyciągania elektrostatycznego, których wartości są dość znaczne. Dlatego też kryształy związków o wiązaniu jonowym wykazują specyficzne właściwości fizyczne tj.:
posiadają wysokie temperatury wrzenia, np. chlorek sodu wrze w temperaturze ,
posiadają wysokie temperatury topnienia, np. chlorek sodu topi się w temperaturze (proces topienia związku jonowego wymaga użycia dużych ilości energii w celu zerwania wszystkich wiązań jonowych w krysztale),
odznaczają się stosunkowo dużą twardością,
w stanie stopionym i w roztworze wodnym przewodzą prąd,
najczęściej dobrze rozpuszczają się w rozpuszczalnikach polarnych.

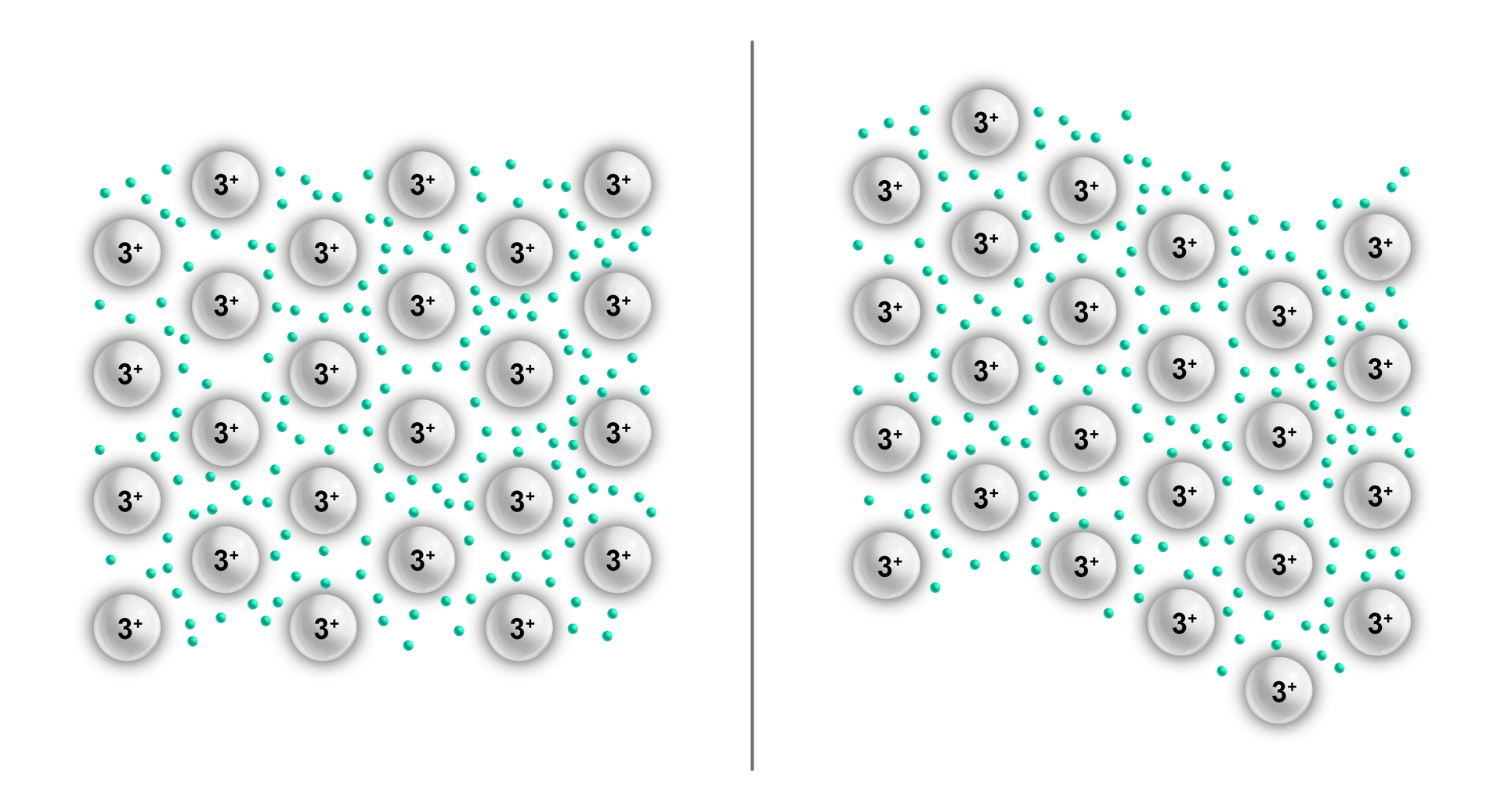
Związki jonowe są na ogół twarde, ale kruche. Dlaczego? Potrzeba dużej siły mechanicznej, takiej jak np. uderzenie kryształu młotkiem, aby doprowadzić do przesunięcia jednej warstwy jonów budującej kryształ, względem drugiej warstwy. W takiej sytuacji, zbliżają się do siebie jony o tym samym ładunku (patrz rysunek poniżej). Jony te odpychają się, powodując tym samym rozbicie (rozkruszenie) kryształu.

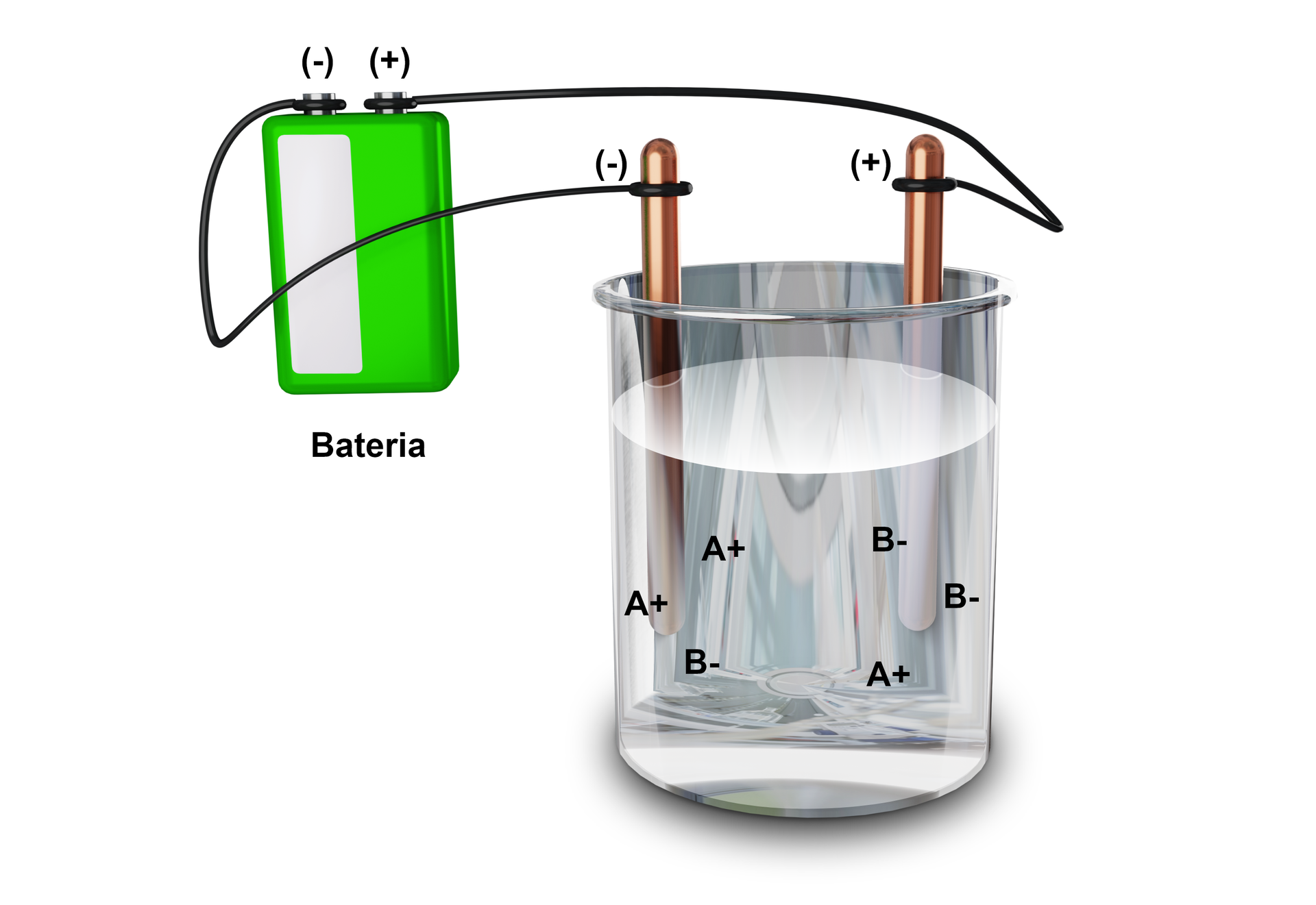
Badanie przewodnictwa kryształów jonowych
Inną charakterystyczną właściwością związków jonowych jest ich przewodnictwo elektryczne. Poniższy rysunek przedstawia trzy eksperymenty, w których dwie elektrody podłączone do żarówki są umieszczone w zlewkach zawierających trzy różne substancje. Przeanalizuj schemat i zapisz wynikające z niego obserwacje i wnioski.
Inną charakterystyczną właściwością związków jonowych jest ich przewodnictwo elektryczne. Zapoznaj się z opisem rysunku przedstawiającego trzy eksperymenty, w których dwie elektrody podłączone do żarówki są umieszczone w zlewkach zawierających trzy różne substancje. Zapisz wynikające z niego obserwacje i wnioski.
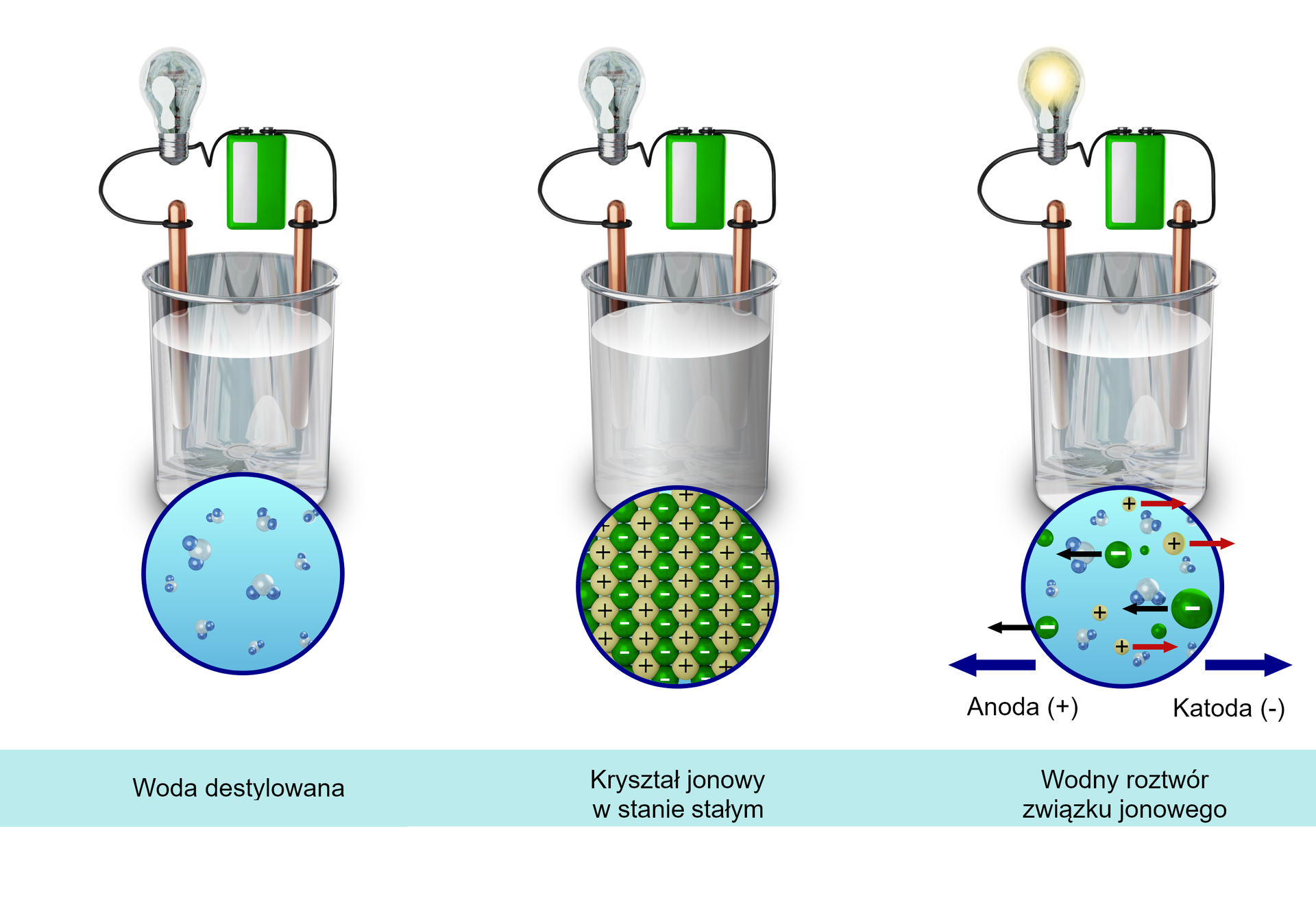
Rozpuszczalność kryształów
Kryształy jonowe, np. chlorku sodu, siarczanu() miedzi() – czy siarczanu() żelaza() – , są łatwo rozpuszczalne w rozpuszczalnikach polarnych w przeciwieństwie do kryształów kowalencyjnych, np. kryształów diamentu.
Kryształy o wiązaniach metalicznych
Kryształy metaliczneKryształy metaliczne występują w czystych metalach i ich stopach. W sieci kryształu metalicznego węzły sieci przestrzennej są obsadzone przez gęsto upakowane dodatnie rdzenie atomowe pozbawione elektronów walencyjnych. Odłączone od rdzenia elektrony tworzą tzw. “gaz elektronowy”, czyli zdelokalizowaną chmurę ładunku ujemnego.

Obecność „chmury elektronowej” zapewnia kryształom metalicznym przewodnictwo elektronowe. Z kolei kationowa budowa sieci krystalicznej zapewnia metalom plastyczność, której nie mają kryształy jonowe. Sieć taka charakteryzuje się m.in. dobrą przewodnością cieplną i elektryczną oraz kowalnością (zdolnością do przyjmowania przez metal dowolnych kształtów, co jest wynikiem braku ukierunkowania wiązań metalicznych). Przemieszczanie się kationów w sieci krystalicznej metalu, w wyniku działania siły zewnętrznej, nieznacznie wpływa na oddziaływania między elementami struktury kryształu (kationami) – jądra atomowe w tym typie kryształów przemieszczają się łatwo względem siebie nawzajem.

Kryształy metaliczne charakteryzuje:
połysk metaliczny;
dobre przewodnictwo cieplne dzięki zrębom atomowym, które drgając przekazują sobie energię;
dobre przewodnictwo elektryczne;
ciągliwość;
wysokie temperatury topnienia (wyjątek: litowce, gal, ind, rtęć).

Podsumowanie właściwości kryształów
rodzaj właściwości | kowalencyjne (atomowe) | jonowe | metaliczne | molekularne (cząsteczkowe) |
|---|---|---|---|---|
właściwości mechaniczne | duża wytrzymałość, duża twardość | duża wytrzymałość, duża twardość | wytrzymałość różna dla różnych metali, na ogół duża, ciągliwość | mała twardość, mała wytrzymałość |
właściwości termiczne | temperatury topnienia wysokie, mały współczynnik rozszerzalności cieplnej | temperatury topnienia wysokie, mały współczynnik rozszerzalności cieplnej | temperatury topnienia różne, duży współczynnik rozszerzalności cieplnej | temperatury topnienia niskie, duży współczynnik rozszerzalności cieplnej |
przewodnictwo elektryczne | w stanie oczyszczonym nie przewodzą prądu elektrycznego | w stanie stałym źle przewodzą prąd elektryczny, w stanie stopionym i roztworach wodnych wykazują przewodnictwo | przewodniki prądu elektrycznego | nie przewodzą prądu elektrycznego (izolatory) |
Słownik
kryształ; równoległościan stanowiący podstawowy, powtarzający się okresowo w przestrzeni element sieci przestrzennej
kryształ, w którym sieć krystaliczną tworzą dobrze zdefiniowane cząsteczki powiązane słabymi oddziaływaniami międzycząsteczkowymi (np. siłami van der Waalsa), natomiast nie występują w niej wiązania jonowe ani wodorowe
kryształy mające w węzłach sieci krystalicznej obojętne elektrycznie atomy; wiązania tworzą pary elektronów walencyjnych pochodzących od dwóch sąsiednich atomów, elektrony te stanowią wspólną własność obydwu atomów; takie wiązania przejawiają wyraźną kierunkowość, a typowym przykładem jest diament; cechy kryształów kowalencyjnych to duża twardość oraz małe przewodnictwo elektryczne
kryształy, w których węzły sieci krystalicznej są obsadzone przez jony – kationy i aniony, o równoważnej ilości ładunków elektrycznych (dzięki czemu kryształ jonowy jako całość jest elektrycznie obojętny); tworzą je głównie sole składające się z pierwiastków o dużej różnicy elektroujemności, np. , – związki o dominującym charakterze jonowym wiązań
kryształy, w których elektrony walencyjne są wspólne dla wszystkich jonów w krysztale i tworzą gaz elektronowy, wypełniający przestrzeń pomiędzy dodatnimi jonami; kryształy metaliczne są doskonałymi przewodnikami elektryczności i ciepła; przykładem kryształów metalicznych są kryształy tworzone przez metale alkaliczne
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.
Bogdańska–Zarembina A., Matusewicz E. I., Matusewicz J., Chemia dla szkół średnich, Warszawa 1993.
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Litwin M., Styka–Wlazło S., Szymońska J., Chemia ogólna i nieorganiczna, Warszawa 2002.
Pazdro K. M., Chemia. Podręcznik do kształcenia rozszerzonego w liceach. Część 1. Chemia ogólna, Warszawa 2009.