Przeczytaj
Alkohole to związki, które w swoich cząsteczkach zawierają grupę (bądź grupy) związaną z atomem węgla o hybrydyzacji . Wiązanie to jest spolaryzowane z uwagi na różnice w elektroujemności pomiędzy atomem węgla i atomem tlenu. Grupa jest grupą elektronoakceptorową, a to powoduje, że alkohole mogą ulegać reakcji substytucji nukleofilowej, np. z wodorkami fluorowców. W reakcji alkoholi z fluorowcowodorami (, ) udział bierze cała grupa hydroksylowa, która zastąpiona zostaje atomem fluorowca.
Zarówno alkohole pierwszorzędowealkohole pierwszorzędowe, jak i drugorzędowedrugorzędowe i trzeciorzędowetrzeciorzędowe, reagują z i . Alkohole wyższego rzędu łatwiej ulegają tym reakcjom z uwagi na ich większą reaktywność. W przypadku alkoholi pierwszo– i drugorzędowych konieczne bywa użycie katalizatora – i podwyższonej temperatury.
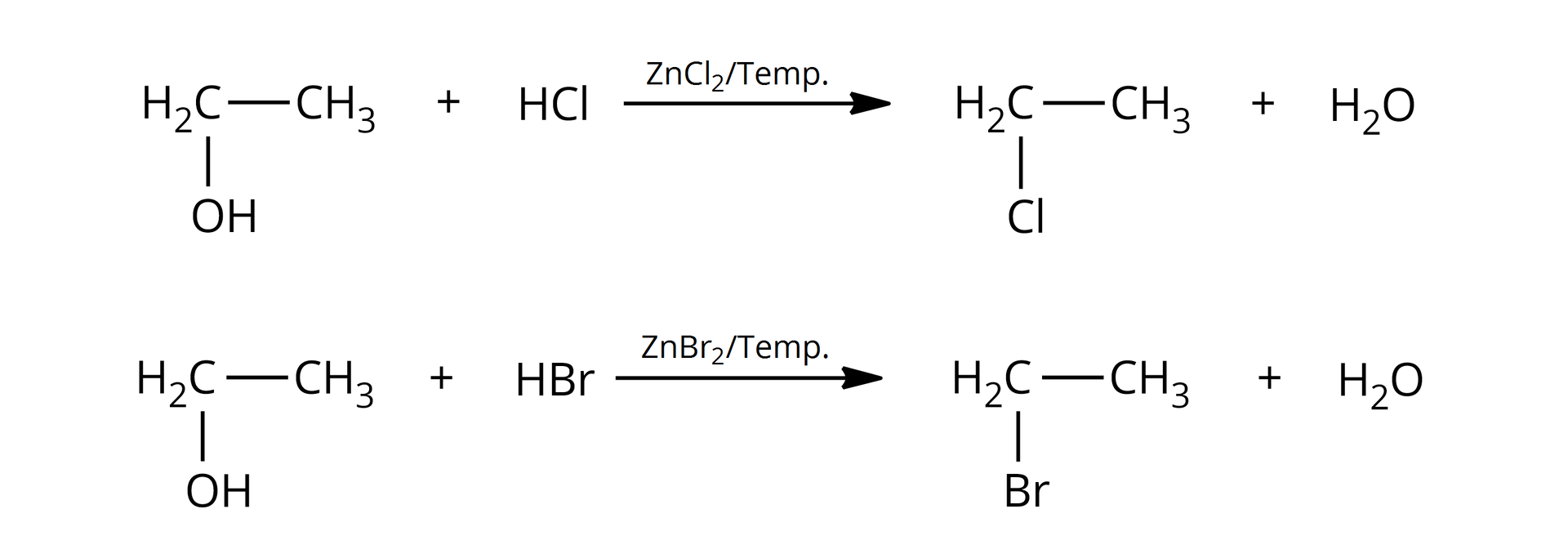
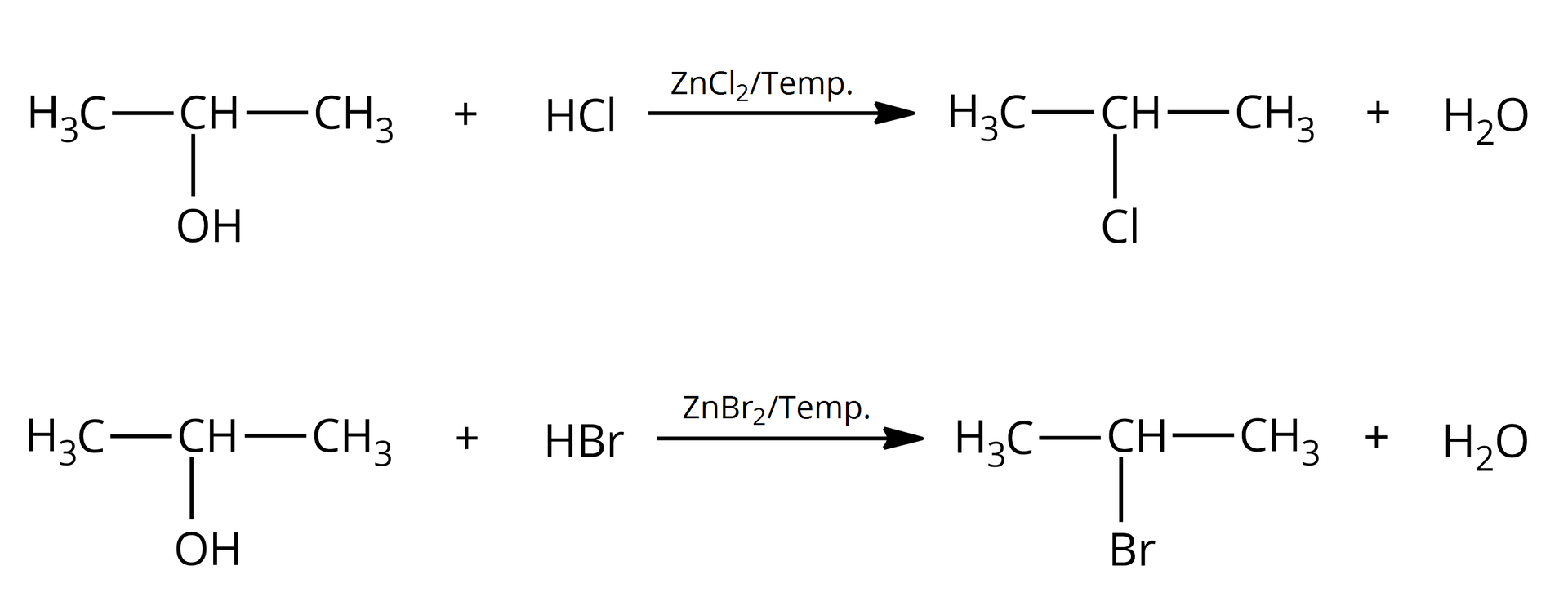
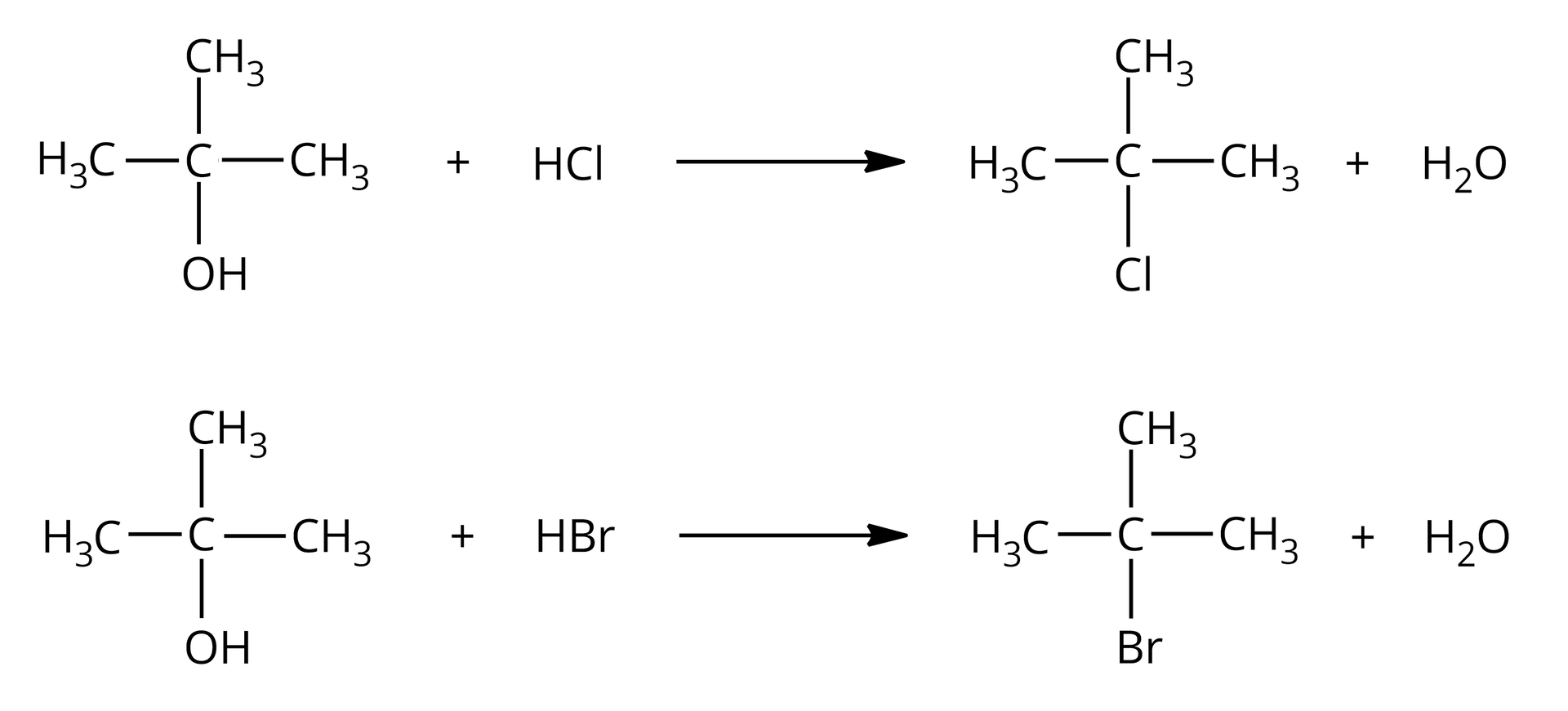
Podstawienie grupy hydroksylowej atomem fluorowca to przykład reakcji substytucji nukleofilowejsubstytucji nukleofilowej, ponieważ zarówno grupa opuszczająca cząsteczkę (anion hydroksylowy, ), jak i grupa, która ją podstawia (anion chlorkowy, lub anion bromkowy, ), to nukleofilenukleofile. Substytucja nukleofilowa może zachodzić zgodnie z mechanizmem jednocząsteczkowym lub dwucząsteczkowym, w zależności od rzędowości alkoholu.
Substytucja nukleofilowa jednocząsteczkowa
Substytucji nukleofilowej jednocząsteczkowej ulegają alkohole drugorzędowe i trzeciorzędowe. Szybkość tej reakcji zależy od stężenia jednej cząsteczki (stąd nazwa „jednocząsteczkowa”) powstającej w etapie , limitującym szybkość reakcji; w tym przypadku szybkość reakcji zależy od stężenia powstającego karbokationukarbokationu – im jest on trwalszy, tym szybciej powstaje.
W pierwszym etapie cząsteczka alkoholu monohydroksylowego (, gdzie to grupa alkilowa) przyłącza kation wodoru z cząsteczki halogenowodoru (, gdzie = , , ) za pomocą wolnej pary elektronowej atomu tlenu (zaznaczonej na zielono), w wyniku czego powstaje protonowana forma alkoholu ( – jon alkilooksoniowy).
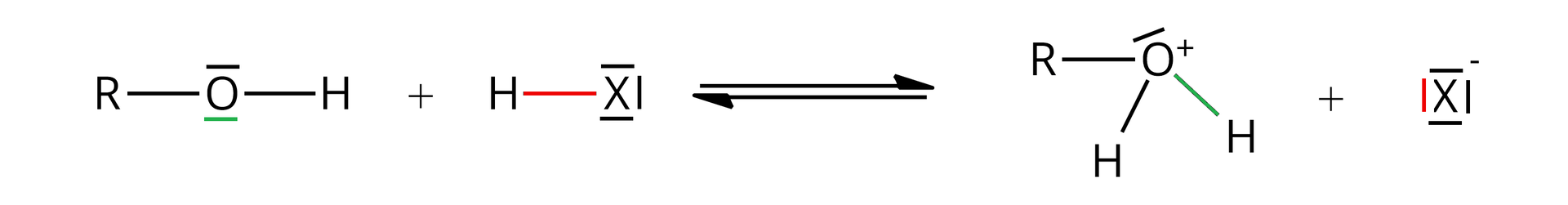
Podczas drugiego etapu dochodzi do odczepienia cząsteczki wody od protonowanej formy alkoholu i utworzenia karbokationu ().
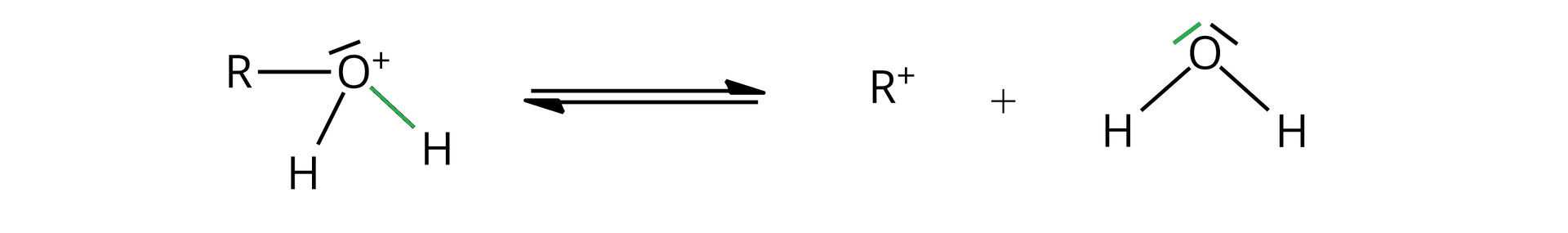
W trzecim etapie karbokation łączy się z jonem halogenkowym, tworząc halogenek alkilu ().
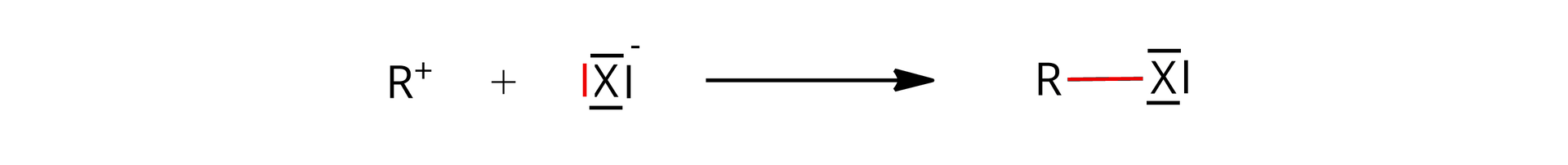
Substytucja nukleofilowa dwucząsteczkowa
Substytucji nukleofilowej dwucząsteczkowej ulegają alkohole pierwszorzędowe i metanol. Szybkość tej reakcji zależy od stężeń dwóch cząsteczek (stąd nazwa „dwucząsteczkowa”) powstających w etapie , limitującym szybkość reakcji; w tym przypadku szybkość reakcji zależy zarówno od stężenia grupy opuszczającej, jak i przyłączanej grupy.
W pierwszym etapie cząsteczka alkoholu monohydroksylowego (, gdzie to grupa alkilowa) przyłącza kation wodoru z cząsteczki halogenowodoru (, gdzie = , , ) za pomocą wolnej pary elektronowej atomu tlenu (zaznaczonej na zielono), w wyniku czego powstaje protonowana forma alkoholu ( – jon alkilooksoniowy).

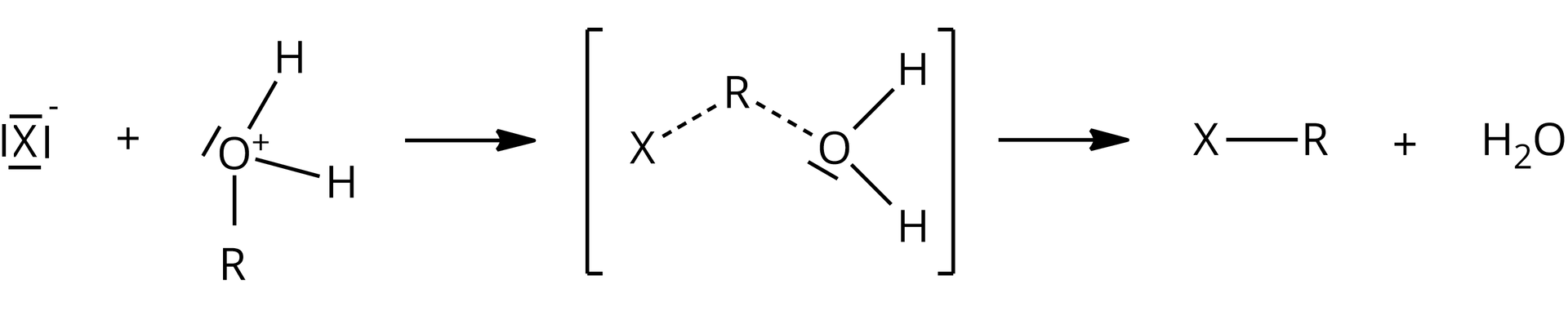
W drugim etapie nukleofil halogenkowy () atakuje swoją wolną parą elektronową atom węgla powstałego wcześniej jonu alkilooksoniowego, do którego przyłączona jest grupa , co prowadzi do utworzenia stanu przejściowego, w którym wiązanie jest częściowo utworzone, natomiast wiązanie jest częściowo rozerwane. Ostatecznie dochodzi do utworzenia wiązania i rozerwania wiązania , skutkiem czego powstaje halogenopochodna i woda.
Reaktywność alkoholi w substytucji nukleofilowej
Zmiana cząsteczkowości substytucji nukleofilowej potwierdza fakt, że reaktywność alkoholi maleje w szeregu od alkoholi trzeciorzędowych do alkoholi pierwszorzędowych, po czym ponownie wzrasta dla metanolu. Alkohole trzeciorzędowe są najbardziej reaktywne w substytucji nukleofilowej ze względu na dużą trwałość powstających karbokationów.
Im wyższa rzędowość karbokationu, tym jest on trwalszy, więc powstaje szybciej.
Wolniej reagują alkohole drugorzędowe, ponieważ powstające karbokationy charakteryzują się mniejszą trwałością. Tworzenie się pierwszorzędowych karbokationów z alkoholi pierwszorzędowych zachodzi bardzo powoli, a brak zawady sterycznejzawady sterycznej umożliwia zastąpienie reakcji jednocząsteczkowej reakcją dwucząsteczkową. Z tego względu alkohole pierwszorzędowe i metanol reagują zgodnie z mechanizmem substytucji nukleofilowej dwucząsteczkowej . W przypadku metanolu reakcja zachodzi szybciej (w porównaniu do alkoholu pierwszorzędowego) ze względu na mniejszą zawadę przestrzenną cząsteczki.
Odróżnianie alkoholi ze względu na ich rzędowość
W sposób doświadczalny można odróżnić alkohole pierwszo– od drugo– i od trzeciorzędowych w reakcji zwanej próbą Lucasa. Wykorzystywany odczynnik to roztwór Lucasa: kwas chlorowodorowy w obecności chlorku cynku, który pełni rolę katalizatora ( bezwodnego chlorku cynku rozpuszczonego w stężonego kwasu solnego).
Obserwacje w wyniku poczynionego doświadczenia pozwalają na określenie rzędowości badanych alkoholi:
Brak widocznych oznak reakcji świadczy o tym, że próbie poddaliśmy alkohol pierwszorzędowy zawierający w cząsteczce od do atomów węgla.
Brak zmętnienia, ale powstanie dwóch warstw świadczy o tym, że w doświadczeniu użyliśmy alkoholu pierwszorzędowego zawierającego w cząsteczce powyżej atomów węgla.
Jeśli po kilku minutach obserwujemy zmętnienie roztworu, a następnie jego rozwarstwienie to znaczy, że w doświadczeniu użyliśmy alkoholu drugorzędowego bądź prop––en––olu.
Jeżeli obserwujemy natychmiastowe zmętnienie i rozwarstwienie roztworu, oznacza to, że badany alkohol jest trzeciorzędowy bądź jest fenylometanolem.
Słownik
alkohol, w którego cząsteczce grupa hydroksylowa jest połączona z atomem węgla pierwszorzędowym
alkohol, w którego cząsteczce grupa hydroksylowa jest połączona z atomem węgla drugorzędowym
alkohol, w którego cząsteczce grupa hydroksylowa jest połączona z atomem węgla trzeciorzędowym
reakcja polegająca na wymianie grupy związanej z atomem węgla, którą jest przeważnie podstawnik elektronoakceptorowy, na odczynnik nukleofilowy
rodzaj substytucji nukleofilowej, w której dochodzi do oderwania od centralnego atomu grupy opuszczającej z utworzeniem mniej lub bardziej trwałego karbokationu, a następnie jego połączenia z nukleofilem; szybkość tej reakcji zależy głównie od szybkości powstawania i trwałości karbokationu, a tym samym zależy ona od stężenia reagenta tworzącego karbokation
rodzaj substytucji nukleofilowej, w której dochodzi do powstania kompleksu przejściowego cząsteczka‑nukleofil, w którym nukleofil przyłączony jest po przeciwnej stronie atomu centralnego do grupy odchodzącej i niemal natychmiastowego oderwania grupy odchodzącej od kompleksu przejściowego i przemieszczenia podstawników w stronę grupy odchodzącej; szybkość tej reakcji zależy głównie od szybkości powstawania kompleksu przejściowego, a tym samym zależy ona od stężenia obydwóch reagentów biorących udział w tej reakcji
anion lub cząsteczka, w której występuje nadmiar elektronów
kation z ładunkiem dodatnim zlokalizowanym na atomie węgla
uniemożliwienie zajścia reakcji chemicznej cząsteczki danego związku spowodowane zbyt dużym rozmiarem obecnych grup funkcyjnych, powodujące brak możliwości dostępu atakującego indywiduum chemicznego do danego atomu w cząsteczce związku
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.