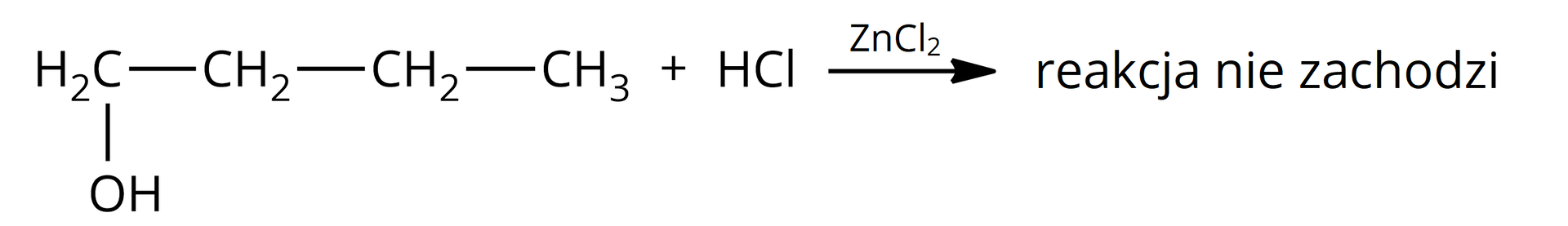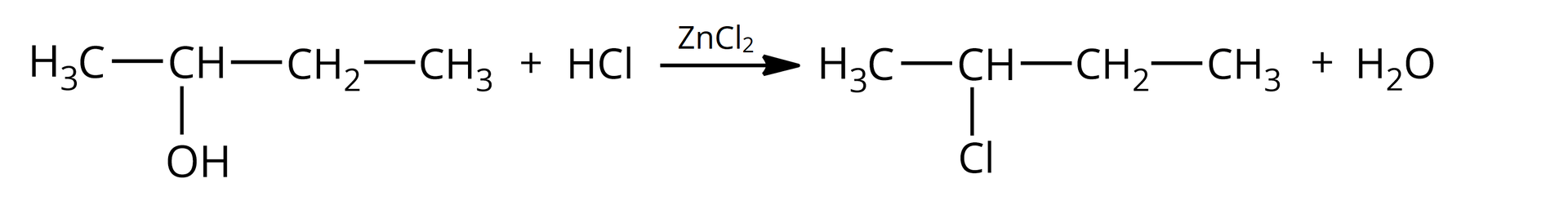Wirtualne laboratorium – I
Korzystając z wiedzy na temat reakcji alkoholi z kwasem chlorowodorowym, zaplanuj i przeprowadź eksperyment, który pozwoli Ci rozwiązać poniższy problem badawczy. Hipotezę, obserwacje, wyniki i wnioski zanotuj w dzienniku.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DiTWI7LkV
Przeprowadzono eksperyment, które pozwolił zbadać reakcję alkoholi z kwasem chlorowodorowym w środowisku chlorku cynku. Zapoznaj się z opisem doświadczenia i wykonaj polecenia.
Analiza eksperymentu: Badanie reakcji alkoholi z kwasem chlorowodorowym w środowisku chlorku cynku.
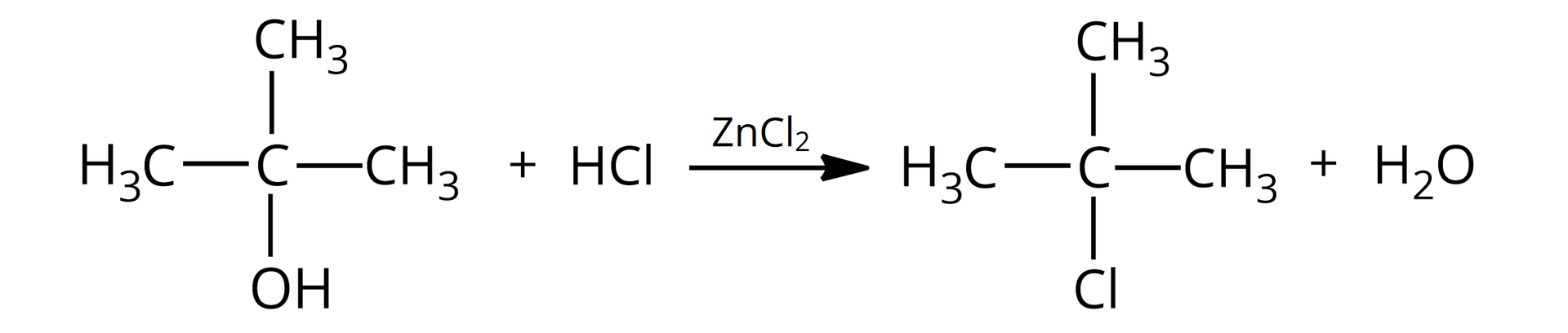
Problem badawczy: Jak odróżnić od siebie trzy alkohole: butan––ol, butan––ol i –metylopropan––ol.
Hipoteza: Butan––ol, butan––ol i –metylopropan––ol to alkohole o różnych rzędowościach, w związku z czym będą z różną szybkością reagowały z pod wpływem .
Sprzęt laboratoryjny:
probówki – podłużne naczynia szklane do przeprowadzania prostych reakcji chemicznych;
waga laboratoryjna – urządzenie elektryczne służące do wyznaczania mas substancji. Daną substancję umieszcza się na srebrnej tacy umieszczonej na urządzeniu. Masa ważonej substancji wyświetlana jest na wyświetlaczu;
naczynko wagowe – sprzęt laboratoryjny służący do dokładnego odważania substancji stałych;
łyżeczka – długi trzonek wykonany ze szkła, porcelany lub metalu zakończony z jednej strony łyżeczką. Służy do nabierania sypkich substancji chemicznych;
cylinder miarowy – podłużne szklane naczynie laboratoryjne w kształcie walca z umieszczoną na ściance podziałką objętości. Służy do odmierzania cieczy;
pręcik szklany, służący do mieszania cieczy;
pipeta automatyczna – jest to specjalny rodzaj pipety miarowej; posiada ona mechanizm składający się z tłoczka ze sprężynką, rączki, regulatora oraz wymiennej końcówki.
Odczynniki chemiczne:
butan––ol;
butan––ol;
–metylopropan––ol;
bezwodny chlorek cynku;
stężony roztwór kwasu chlorowodorowego.
Przebieg eksperymentu:
Przygotowany odczynnik Lucasa: a) za pomocą łyżeczki pobrano bezwodny chlorek cynku do naczynka wagowego i odważono gramów; b) odmierzono centymetrów sześciennych w cylindrze miarowym stężonego roztworu ; c) odważony bezwodny chlorek cynku przeniesiono do stężonego roztworu kwasu chlorowodorowego i zamieszano szklanym pręcikiem.
Odmierzono za pomocą pipety automatycznej po centymetra sześciennego badanych alkoholi i przeniesiono je do probówek , i .
Za pomocą pipety automatycznej do każdej z probówek dodano po centymetry sześcienne odczynnika Lucasa.
Probówki lekko wstrząśnięto.
Obserwacje:
W probówce brak objawów reakcji, w probówce zaobserwowano zmętnienie po około minutach, natomiast w probówce zmętnienie pojawiło się natychmiast.
Wyniki:
W probówce pierwszej znajduje się butan––ol, ponieważ reakcja chemiczna zaszła z tak niewielką szybkością, że nie zaobserwowano powstającego chlorku – jest to charakterystyczne dla alkoholi pierwszorzędowych.
W drugiej probówce obecny jest butan––ol, ponieważ reakcja chemiczna zaszła po pewnym czasie (zmętnienie pojawiło się po około minutach) – jest to charakterystyczne dla alkoholi drugorzędowych, które są aktywniejsze od alkoholi pierwszorzędowych.
W trzeciej probówce znajduje się –metylopropan––ol, ponieważ reakcja chemiczna zaszła natychmiast (od razu pojawiło się zmętnienie) – jest to charakterystyczne dla alkoholi trzeciorzędowych, które są najbardziej aktywne.
Wnioski:
Alkohole trzeciorzędowe są aktywniejsze w reakcji substytucji nukleofilowej od alkoholi drugorzędowych, które są aktywniejsze od alkoholi pierwszorzędowych. Butan––ol, butan––ol i –metylopropan––ol to alkohole o różnych rzędowościach, w związku z czym reagują z różną szybkością z kwasem chlorowodorowym – butan––ol najwolniej, butan––ol szybciej, natomiast –metylopropan––ol najszybciej.
Przyporządkuj nazwy alkoholi do obserwacji, których można dokonać po przeprowadzeniu próby Lucasa z ich udziałem.