Przeczytaj
Jod został odkryty w popiele z wodorostów przez Bernarda Courtois ( wiek). Jest mało rozpowszechnionym na Ziemi pierwiastkiem, którego związki obecne są w wodzie morskiej ( na tonę), wodorostach morskich, ostrygach i wątróbkach dorsza. Jod pierwiastkowy nie tworzy niezależnych minerałów. Do celów przemysłowych pozyskiwany jest z solanek oraz z jodanu() sodu () towarzyszącemu złożom saletry sodowej (), zwłaszcza na terenie Chile. W temperaturze pokojowej jod to krystaliczne szaro‑czarne ciało stałe, któremu zwykle towarzyszy fioletowa poświata par jodu.
Właściwości i zastosowanie jodu
Ten pierwiastek chemiczny to ważny mikroelement odpowiedzialny za prawidłowe funkcjonowanie tarczycy, która reguluje pracę całego organizmu ludzkiego. Aby więc zapobiec jego niedoborom, zaleca się spożycie tzw. soli jodowanejsoli jodowanej w miejsce innych typów soli.
Związki jodu posiadają szereg komercyjnych zastosowań:
ze względu na zdolność tarczycy do gromadzenia aktywnego jodu, jego promieniotwórczy izotop stosowany jest w rozpoznawaniu i leczeniu chorób tarczycy;
ze względu na swoje właściwości odkażające, w wyniku których niszczone są drobnoustroje, stosowany jest w produkcji środków antyseptycznychśrodków antyseptycznych, np. jodyny (90% roztwór jodu w etanolu z dodatkiem jodku potasu) oraz w tabletkach do dezynfekcji wody pitnej;
w produkcji barwników.
Podobnie jak bromek srebra, jodek srebra wykorzystywany jest w fotografii klasycznej, w której jest składnikiem emulsji światłoczułej, wypełniającej błonę fotograficzną (potocznie zwaną kliszą). Ta emulsja to zawiesina soli srebra (bromku srebra, chlorku srebra lub jodku srebra) w żelatynie, która na skutek fotochemicznej reakcjifotochemicznej reakcji powoduje pojawianie się obrazu (wytrącanie srebra). Co więcej, pierwsze komercyjne zastosowanie związków jodu było związane z techniką tworzenia obrazów na metalu (dagerotypów). Fotografię tego typu wynalazł w roku Louis Daguerre.
Jak powstawał dagerotypdagerotyp?
Płytki miedziane, posrebrzone i wypolerowane poddawane były działaniu oparów jodu, w wyniku czego na ich powierzchni powstawała warstwa światłoczułego jodku srebra. Tak przygotowaną płytkę umieszczano w kamerze i naświetlano. W celu wywołania powstałego obrazu, płytkę poddawano działaniu oparów rtęci, a by utrwalić fotografię, zanurzano ją w roztworze chlorku sodu lub tiosiarczanu sodu.

W chemii znane są liczne zastosowania jodu. W dużej mierze wykorzystuje sie go w syntezie chemicznej do otrzymywania związków jodoorganicznych, jodku potasu i innych związków nieorganicznych z jodem. One z kolei stosowane są jako katalizatory, suplementy paszowe dla zwierząt, barwniki, farmaceutyki, środki dezynfekcyjne. Ponadto jod wykorzystywany jest w analizie chemicznej do wykrywania skrobi w próbie jodoskrobiowej, jak i w chemii analitycznej do analitycznych metod oznaczeń (jodometrii). Co więcej, pozwala na identyfikację rodzaju tłuszczów poprzez wyznaczenie liczby jodowejliczby jodowej, stanowiącej miernik nienasycenia tłuszczy, a jego opary pozwalają na wywoływanie chromatogramów (płytek TLC) w cienkowarstwowej chromatografii cieczowejcienkowarstwowej chromatografii cieczowej.

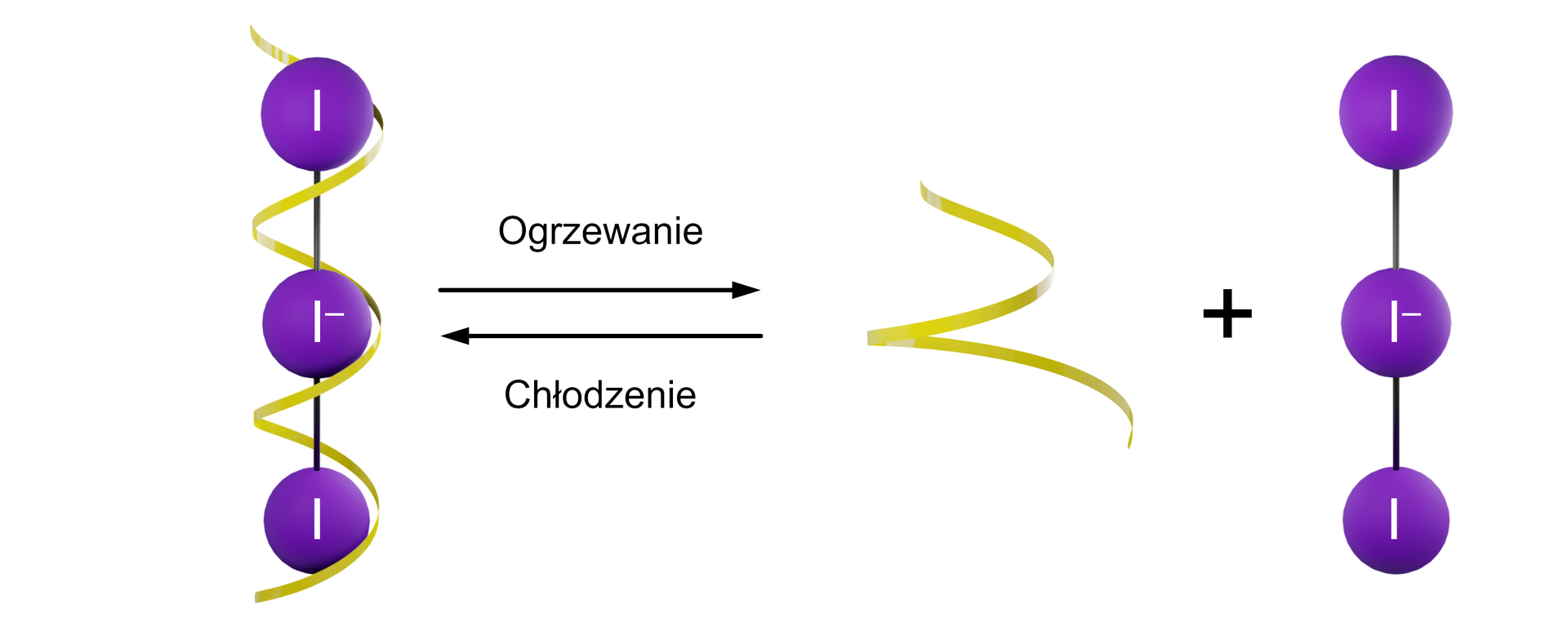
W czasie reakcji jodoskrobiowej tworzy się kompleks skrobi z obecnym w płynie Lugola ( w roztworze ) anionem trójjodkowym – . Ogrzanie roztworu powoduje rozpad kompleksu, co objawia się utratą granatowego zabarwienia. Ponowne ochłodzenie układu powoduje odtworzenie kompleksu i ponowne pojawienie się granatowego zabarwienia.
Jodki metali alkalicznychmetali alkalicznych, np. jodek sodu, znajdują zastosowanie jako detektory w licznikach scyntylacyjnychlicznikach scyntylacyjnych. Jod stosowany jest w metalurgii do produkcji metali przejściowych o wysokiej czystości (np. cyrkonu, chromu, kobaltu, tytanu). Metoda pozyskiwania trudnotopliwych metali za pomocą jodu polega na ogrzaniu rozdrobnionego metalu z parami jodu (), w wyniku czego powstaje gazowy jodek metalu, który następnie, przy użyciu prądu elektrycznego, ulega rozkładowi na druciku wolframowym ogrzanym do . Powstały w reakcji rozkładu metal osadza się na nim, a jod ponownie tworzy jodek z pozostałym nieoczyszczonym metalem (Anton van Arkel i Jan de Boer, ). Metoda ta została wykorzystana w konstrukcji żarówek halogenowych.
gdzie: oznacza metal poddany oczyszczaniu, np.:

Czy wiesz, że jodkiem srebra można modyfikować pogodę?
Jodek srebra stosowany jest do zasiewania chmur – chodzi o proces modyfikacji pogody, pozwalający na zmianę ilości opadów z chmur. Polega na rozpylaniu jodku srebra, który ze względu na krystaliczną budowę spowoduje zarodkowanie krzepnięcia lodu. W efekcie, w chmurach kondensuje para wodna z powietrza, prowadząc tym samym do opadów.
Słownik
(gr. anti „przeciw”, sepsis „gnicie”, dosłownie: „zapobieganie gniciu”) technika stosowana w celu odkażania ran – pozwala na zabicie drobnoustrojów w ranach
reakcja chemiczna, która jest generowana pod wpływem promieniowania elektromagnetycznego, np. światła widzialnego, podczerwieni, ultrafioletu
(ang. thin layer chromatography) technika analityczna pozwalająca na rozdział składników mieszaniny
liczba oznaczająca ilość gramów jodu, jaka została przyłączona do wiązań podwójnych w kwasach tłuszczowych na 100 gramów badanego tłuszczu
(łac. scintillam „iskra”) detektor promieniowania jonizującego, w którym dochodzi do scyntylacji (zjawisko powstania błysku świetlnego) pod wpływem bombardowania niektórych substancji naładowanymi cząstkami; w wyniku jego pracy wytwarzane są jony i elektrony, które emitują fotony (widzialne w postaci błysków świetlnych)
metale pierwszej i drugiej grupy układu okresowego pierwiastków
obraz fotograficzny otrzymywany na płytce metalowej
sól kuchenna z dodatkiem różnych soli zawierających jod
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Christe K., Iodine, online: https://www.britannica.com/science/iodine/Production-and-use, dostęp: 15.04.2021.