Przeczytaj
Czym jest proces denaturacji?
W trakcie smażenia jajka na patelni łatwo zaobserwować zmianę jego zabarwienia i struktury. Pod wpływem wysokiej temperatury pojawia się nowy twór, który właściwościami fizycznymi nie przypomina materii sprzed kilku minut. Sprawcą całego zdarzenia jest denaturacja.
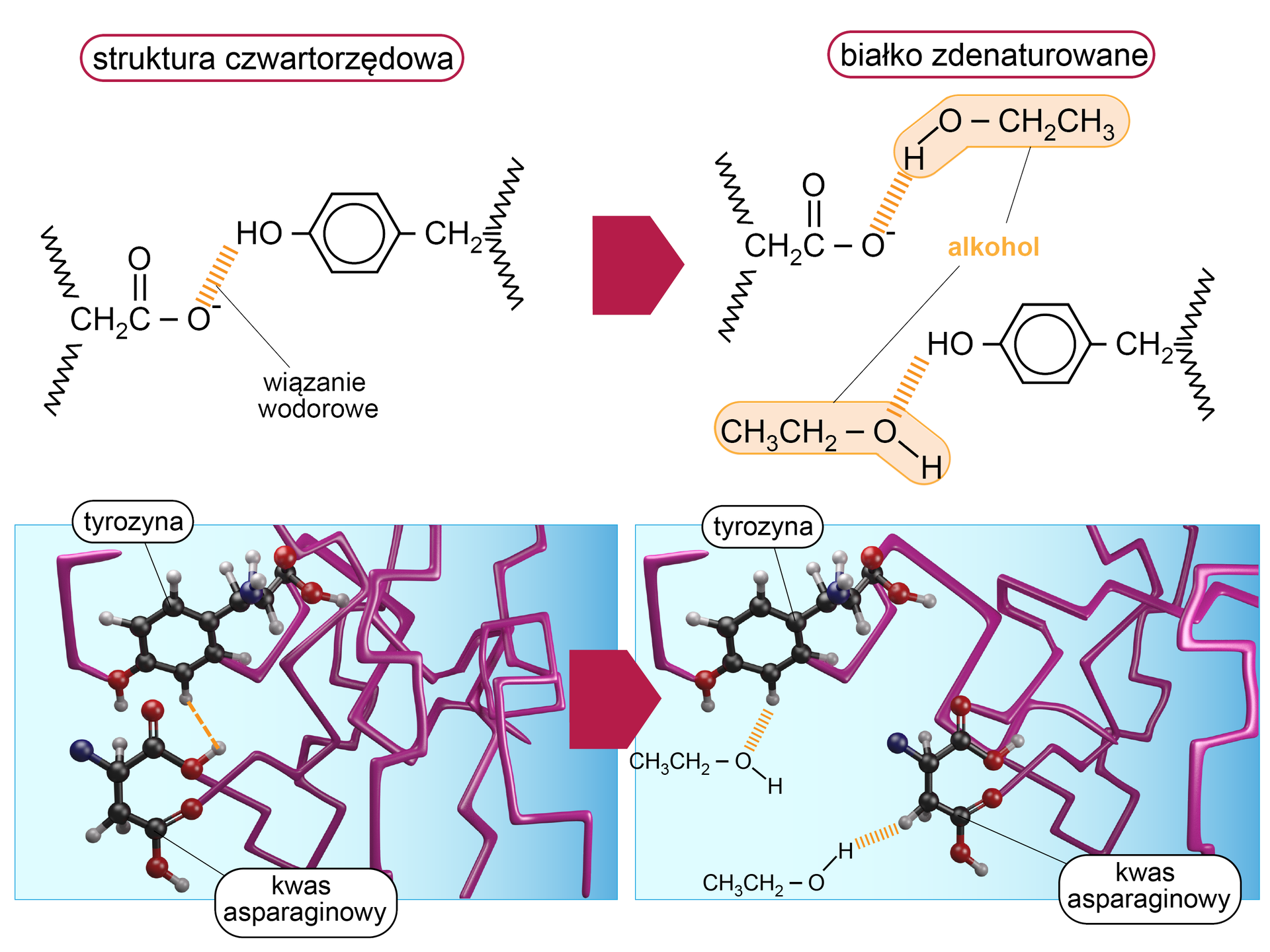
Proces ten polega na utracie aktywności biologicznej oraz zniszczeniu struktur białek: drugo-, trzecio- i czwartorzędowych. Nie zostaje zmieniona jedynie struktura pierwszorzędowa, ponieważ wiązania peptydowe są wystarczająco silne, żeby pozostać nierozerwane. Podczas denaturacji zostają jednak zerwane wiązania stabilizujące pozostałe struktury białka, przez co dochodzi do zmian we właściwościach fizycznych i chemicznych protein. Ogólny schemat denaturacji przedstawiono poniżej.

Czynniki wpływające na denaturację białek
Białka mogą ulegać denaturacji pod wpływem wielu różnych czynników, które ogólnie podzielono na dwie grupy – czynniki fizyczne i chemiczne – co zostało przedstawione na poniższej mapie myśli.
- Nazwa kategorii: Czynniki denaturujące
- Nazwa kategorii: Fizyczne
- Nazwa kategorii: Temperatura
- Nazwa kategorii: Ciśnienie
- Nazwa kategorii: Wytrząsanie
- Nazwa kategorii: Promieniowanie UV i RTG
- Nazwa kategorii: Promieniowanie jonizujące
- Nazwa kategorii: Ultradźwięki Koniec elementów należących do kategorii Fizyczne
- Nazwa kategorii: Chemiczne
- Nazwa kategorii: Sole metali ciężkich
- Nazwa kategorii: Mocne kwasy i zasady
- Nazwa kategorii: Etanol
- Nazwa kategorii: Detergenty
- Nazwa kategorii: Niektóre kwasy organiczne
- Nazwa kategorii: Sole amonowe Koniec elementów należących do kategorii Chemiczne
- Elementy należące do kategorii Czynniki denaturujące
- Elementy należące do kategorii Fizyczne
- Elementy należące do kategorii Chemiczne
Temperatura
Wysoka temperatura (dla niektórych białek wystarczy ) powoduje rozerwanie wiązań wodorowych i oddziaływań hydrofobowych. Dzieje się tak, ponieważ podwyższając temperaturę, dostarczamy do układu dodatkową energię, która zwiększa energię kinetycznąenergię kinetyczną układu. Powoduje to zwiększony ruch cząsteczek. W ten sposób dochodzi do zerwania wiązań. W życiu codziennym takie zjawisko zachodzi podczas gotowania produktów żywnościowych. Zdenaturowane białka są bardziej podatne na działanie licznych enzymów, co ułatwia nam trawienie pożywienia i wchłanianie potrzebnych substancji odżywczych. Również podczas sterylizacjisterylizacji narzędzi czy opatrunków medycznych zwiększa się temperaturę. Tak niszczone są białka, które występują w patogenach, a tym samym zostają unieszkodliwione potencjalne mikroorganizmy, wywołujące choroby.
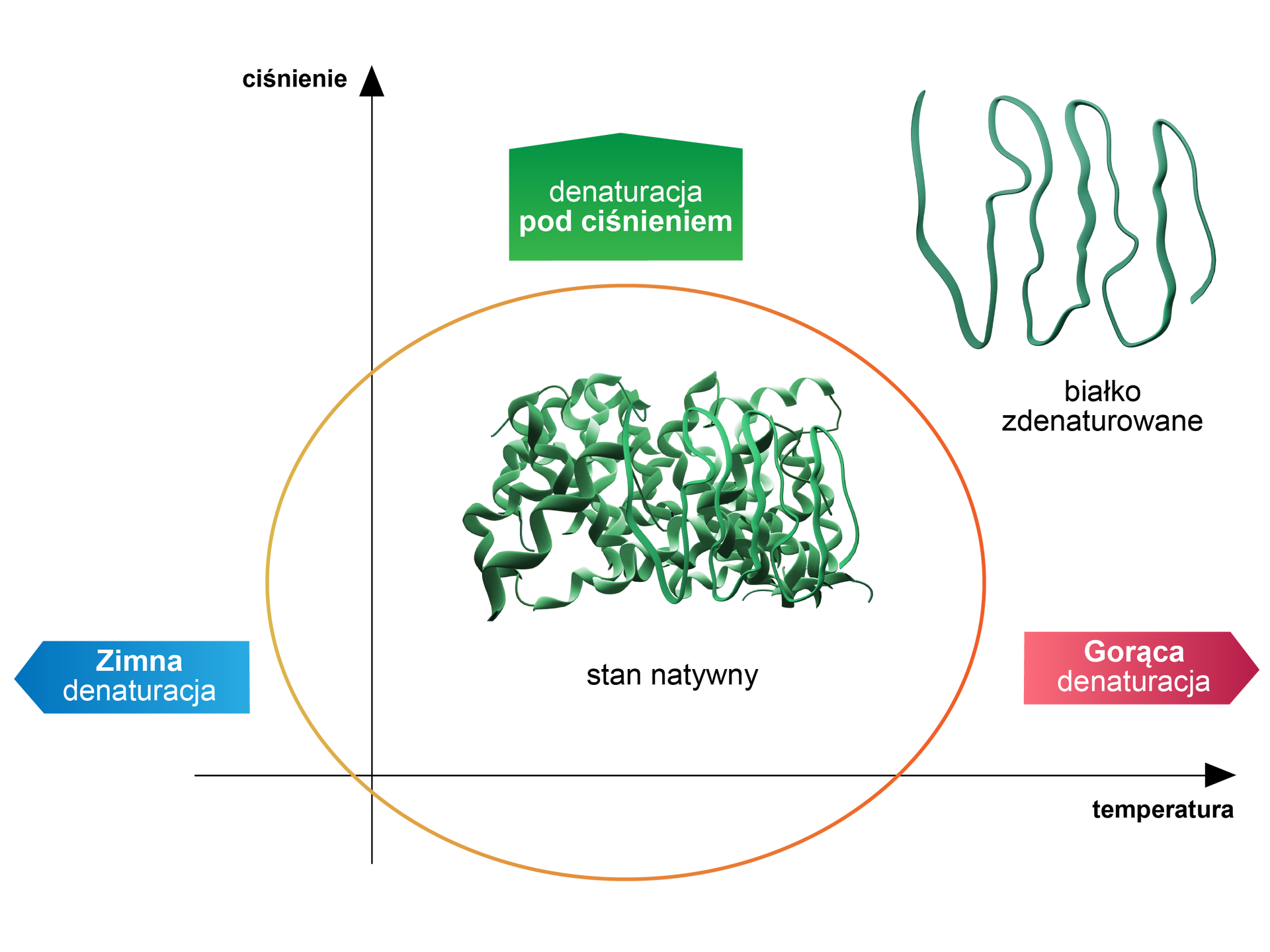
Może także dojść do tzw. zimnej denaturacji, z którą mamy do czynienia przy niskiej temperaturze i wysokim ciśnieniu (powyżej ). Takie warunki sprzyjają zmniejszeniu oddziaływań hydrofobowych, wówczas struktura białka ulega rozwinięciu. Na poniższym wykresie zaprezentowano rodzaje denaturacji i jej zależność od temperatury i ciśnienia.
Promieniowanie UV
Promieniowanie UV, nazywane również promieniowaniem nadfioletowym, to promieniowanie elektromagnetyczne o długości około – . W zależności od długości fali, wyróżnia się promieniowanie UVA, UVB i UVC. Słońce emituje fale we wszystkich trzech zakresach, natomiast na Ziemię dociera tylko część promieniowania UVB i całe UVA, które jest mniej szkodliwe dla człowieka niż pozostałe rodzaje. Promieniowanie UV w dużych dawkach powoduje rozerwanie wiązań wodorowych w białkach, co prowadzi do zniszczenia struktur drugo-, trzecio-, i czwartorzędowych. Dlatego długotrwałe narażanie się na promienie słoneczne nie jest wskazane ze względu na zwiększenie ryzyka zachorowań na nowotwory skóry. Jednak minimalna dawka promieniowania jest potrzebna dla organizmu do produkcji witaminy .
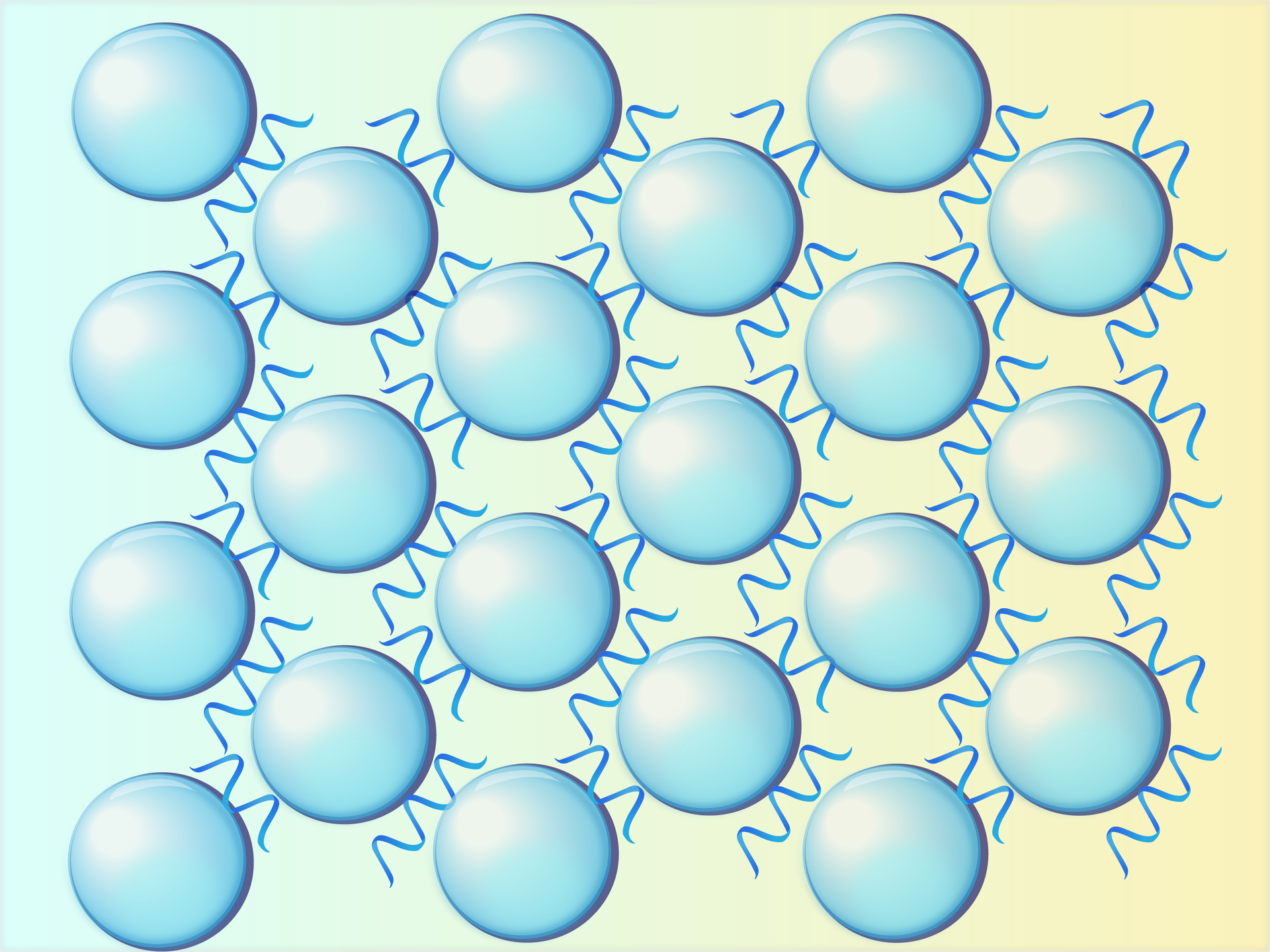
Wytrząsanie
Gwałtowne mieszanie czy ubijanie białka powoduje zerwanie wiązań wodorowych. To właśnie dzieje się w momencie ubijania piany z białek. Dochodzi wtedy do zerwania wiązań i wprowadzenia pęcherzyków gazów do układu. Następnie cząsteczki białek tworzą nowe wiązania, które oplatają cząsteczki gazów, tworząc tym samym strukturę piany. Schemat reakcji zamieszczono poniżej. Proces tworzenia nowych wiązań w białku nosi nazwę koagulacjikoagulacji.
niebieskie tło to cząsteczki wody;
zwinięte kłębki to białko;
fale to zdenaturowane białka;
białe okręgi w środku to pęcherzyki powietrza.
Etanol
Ten związek chemiczny zrywa wiązania wodorowe w białkach i wiążę się z grupami chemicznymi białek. Dla przykładu: etanol ma zdolność do przenikania przez ściany komórkowe bakterii i denaturacji obecnych w mikroorganizmach białek i enzymów, co prowadzi do śmierci komórki. Taka właściwość alkoholu, nazywana bakteriobójczą, jest wykorzystywana do dezynfekcji. Spożywanie etanolu sprawia, że białka, które budują nasz organizm, ulegają denaturacji i przez to nie mogą pełnić swoich funkcji. Etanol znajduje się w piwie, winie czy innych wyrobach alkoholowych.
Sole metali ciężkich
Sole metali ciężkich to związki chemiczne zawierające jony: , , , , i jony innych metali o gęstości większej niż . Niszczą one wiązania jonowewiązania jonowe w białku i prowadzą do zniszczenia mostków solnychmostków solnych i mostków disiarczkowychmostków disiarczkowych. Produktem takiej reakcji jest sól białka i metalu ciężkiego. Taką właściwość wykorzystuje się w przypadku zatrucia organizmu związkami metali ciężkich. Pacjentowi podaje się białko, które wytrąca sól, a następnie wywołuje się wymioty, usuwające z organizmu toksyny. Na przykład osobie zatrutej solami rtęci należy podać do wypicia mleko z białkiem kurzym, by doprowadzić do mdłości. W tym przypadku białka, zawarte w mleku i białku kurzym, wychwytują jony rtęci i są usuwane z organizmu.
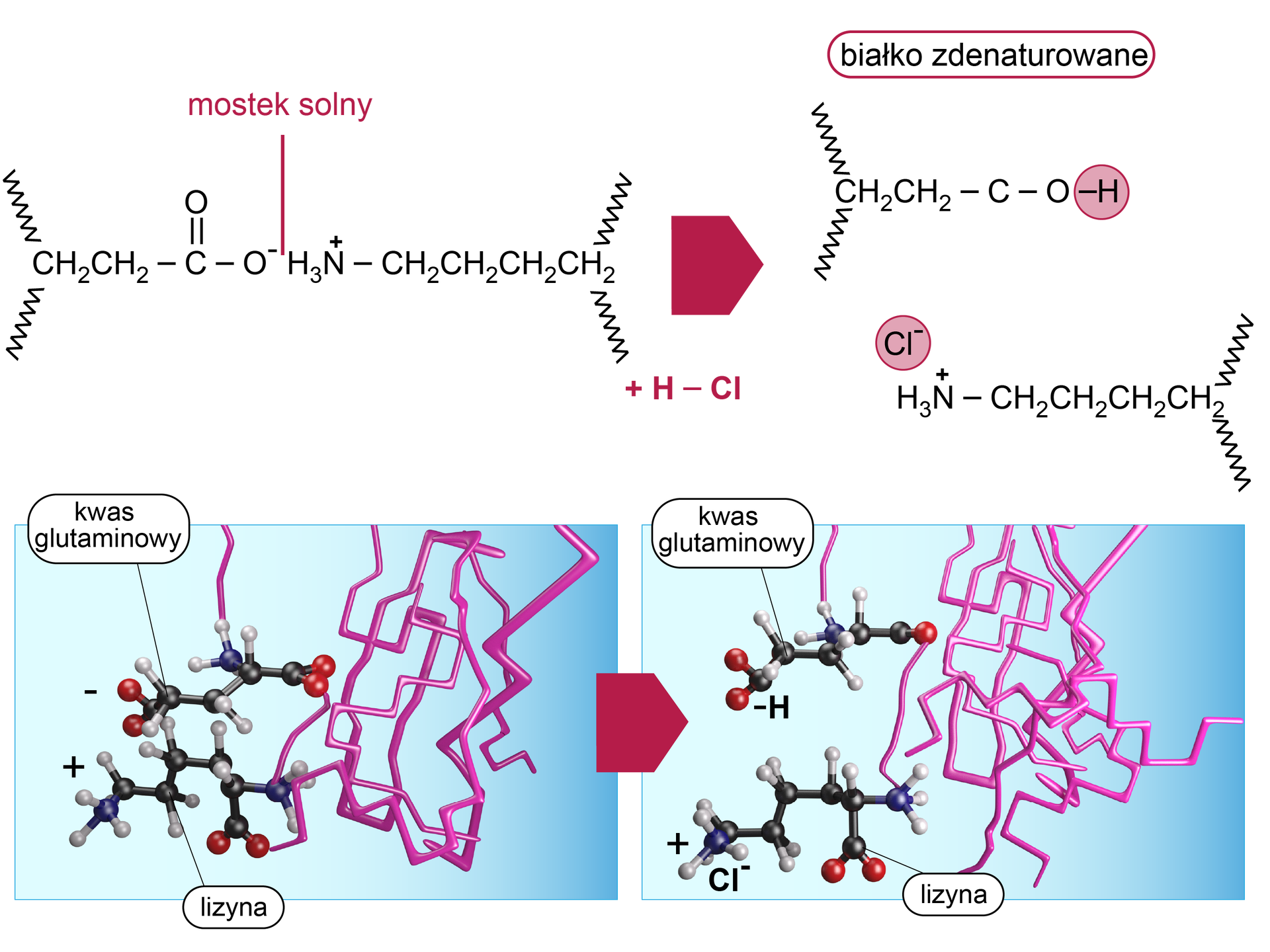
Mocne kwasy i zasady
Mocne kwasy i zasady ulegają dysocjacji elektrolitycznejdysocjacji elektrolitycznej w roztworze rozpuszczalnika. Zaburzają one wiązania jonowe w mostkach solnychmostkach solnych w białku, niszcząc jego strukturę natywnąstrukturę natywną.
Zaprezentowane powyżej przykłady denaturacji nie są wszystkimi możliwymi reakcjami. Wśród związków chemicznych, które powodują zniszczenie struktury natywnej białka, znajdują się m.in.: mocznik, guanidyna, SDS (sól sodowa siarczanu() dodecylu).
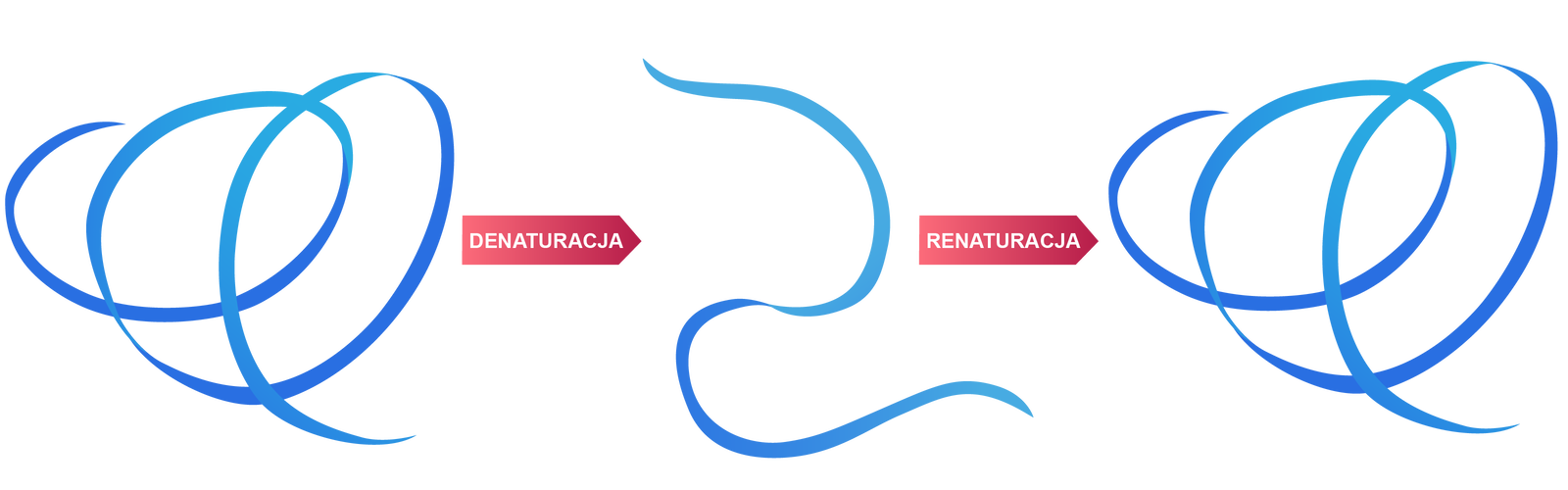
Czy denaturacja białka jest procesem nieodwaracalnym?
Denaturacja nie jest procesem nieodwracalnym. W początkowym jego etapie, po usunięciu czynnika denaturującego, może dojść do odtworzenia struktury natywnej białka. Takie zjawisko nazywa się renaturacją. Schemat został przedstawiony poniżej. Przykładem denaturacji odwracalnej jest zastosowanie soli amonowych, których użycie prowadzi do usunięcia płaszcza wodnego białka i zmiany jego struktury przestrzennej. Po dodaniu wody, białko wraca do struktury wyjściowej. Do czynników fizycznych, przyczyniających się do denaturacji nieodwracalnej, zaliczamy: ogrzewanie, silnie mieszanie, wytrząsanie, naświetlanie promieniowaniem nadfioletowym, rentgenowskimi i jonizującym lub działanie ultradźwiękami. Natomiast denaturacja chemiczna zachodzi w obecności mocznika, chlorku guanidyny, na skutek działania kwasów i zasad, soli metali ciężkich, alkoholi. Wszystkie te czynniki powodują rozerwanie wiązań wodorowych, jonowych, mostków disiarczkowych, czyli niszczą wiązania, które stabilizują strukturę łańcuchów polipeptydowych.
Właściwości zdenaturowanego białka
Białko zdenaturowane posiada inne właściwości fizyczne i chemiczne, ze względu na zmiany w swojej strukturze.
Zdenaturowane białka, oprócz utraty swojej aktywności biologicznej, wykazują również większą podatność na działanie enzymów proteolitycznychenzymów proteolitycznych oraz zmiany w rozpuszczalności i lepkości. Podczas denaturacji dochodzi także do odsłonięcia grup chemicznych, które były dotychczas schowane we wnętrzu białka, co może prowadzić do zwiększenia ich aktywności.
Denaturacja w życiu codziennym
Denaturacja jest sposobem człowieka na walkę z patogenami. Wykorzystywana jest przez nas w codziennym życiu, w kuchni lub łazience. Warto więc wiedzieć, że jajecznica to tak naprawdę zniszczone białko, z którego nie da się już zrobić kogla‑mogla.
Słownik
każdy rodzaj promieniowania, który wywołuje powstanie jonu z danego atomu lub cząsteczki; do takiego promieniowania zalicza się promieniowanie alfa, beta i gamma
energia związana z ruchem danego układu
zniszczenie wszystkich form mikroorganizmów w danym otoczeniu; stosowana m.in.: w medycynie i produkcji żywności
promieniowanie elektromagnetyczne o długości fali około – , niewidzialne dla człowieka
promieniowanie elektromagnetyczne o długości fali około –
zbyt wysokie fale dźwiękowe, aby usłyszał je człowiek; znalazły zastosowanie m. in.: w medycynie – dzięki nim można uzyskać obraz narządów wewnętrznych
proces rozpadu cząsteczek związków chemicznych na jony pod wpływem rozpuszczalnika
połączenia powstające pomiędzy resztami aminokwasowymi naładowanymi dodatnio (np. lizyną) a resztami aminokwasowymi naładowanymi ujemnie (np. asparaginą)
w przypadku białek, to struktura, która umożliwia prawidłowe funkcjonowanie białek
wiązanie chemiczne pomiędzy dwoma różnoimiennymi ładunkami
połączenia utworzone przez dwa atomy siarki, które są częścią tego samego związku chemicznego
proces łączenia się pojedynczych cząstek substancji rozproszonej w większe skupiska (agregaty) oraz wytrącaniu ich z układu w postaci osadu
enzymy, które hydrolizują wiązania peptydowe
Bibliografia
Ban‑Oganowska H. i in. Ćwiczenia laboratoryjne z biochemii i chemii żywności, Wrocław 2006.
Doonan S., Zawadzki Z., Białka i peptydy, tłum. Z. Zawadzki, Warszawa 2008.
Kłyszejko‑Stefanowicz L., Ćwiczenia z biochemii, Warszawa 2003.
Stryer L., Berg J. M., Tymoczko J. L., Biochemia. Część 1. Molekularny wzór życia, Warszawa 2009, wyd. 4.