Przeczytaj
Cukry złożone ulegają hydrolizie pod wpływem konkretnych enzymów lub w środowisku kwasowym. W celu badania hydrolizyhydrolizy cukrów złożonych i wykrywania produktów reakcji, można wykonać kilka doświadczeń chemicznych.
Badanie hydrolizy sacharozy oraz wykrywanie produktów reakcji – próba Trommera
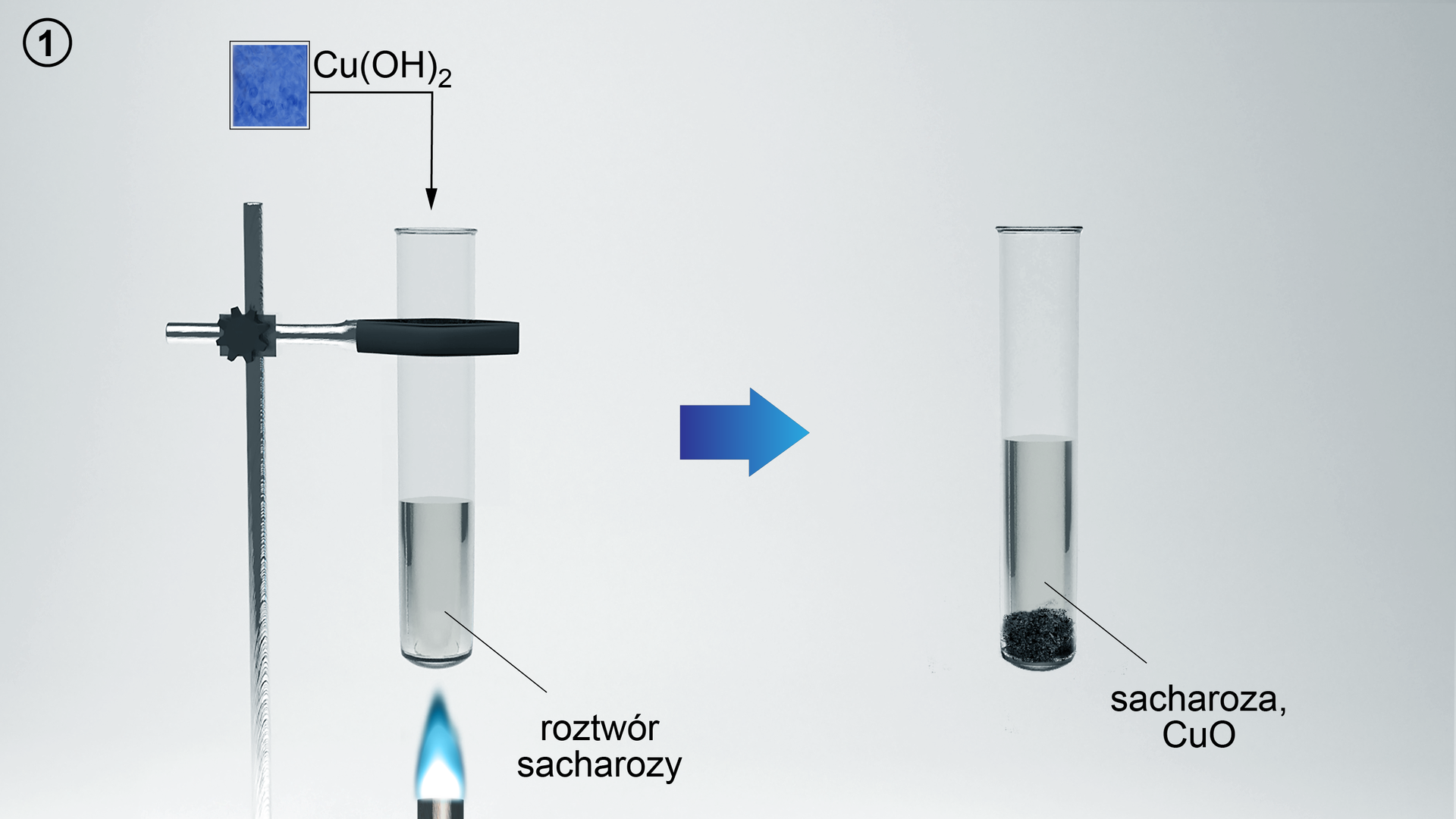
1. W dwóch probówkach umieść 3 cm3 sacharozy.
2. Do drugiej probówki dodaj kilka kropli kwasu chlorowodorowego. Za pomocą palnika ogrzej zawartość probówki. Następnie, kontrolując odczyn roztworu za pomocą uniwersalnego papierka wskaźnikowego, zobojętnij zawartość probówki, dodając do niej wodorotlenek sodu.
3. Do dwóch następnych probówek dodaj siarczan(VI) miedzi(II) oraz wodorotlenek sodu, w celu wytrącenia świeżego wodorotlenku miedzi(II).
4. Do pierwszej i drugiej probówki dodaj świeżo strącony wodorotlenek miedzi(II). Zawartość probówek ogrzej.
5. Obserwuj zmiany.
Schemat doświadczenia:
W probówce pierwszej powstał czarny osad. W probówce drugiej powstał ceglastoczerwony osad.
Sacharoza nie daje pozytywnego wyniku w próbie Trommera. Nie jest cukrem redukującym. W wyniku ogrzewania wodorotlenku miedzi(II) powstaje czarny tlenek miedzi(II) CuO. Sacharoza, pod wpływem kwasu chlorowodorowego oraz ogrzewania, ulega hydrolizie do cukrów prostych (glukozy i fruktozy). Produkty reakcji hydrolizy sacharozy dają pozytywny wynik próby Trommera. Powstaje ceglastoczerwony tlenek miedzi(I) Cu2O.
Równania reakcji chemicznych:


Badanie hydrolizy sacharozy oraz wykrywanie produktów reakcji – próba Tollensa
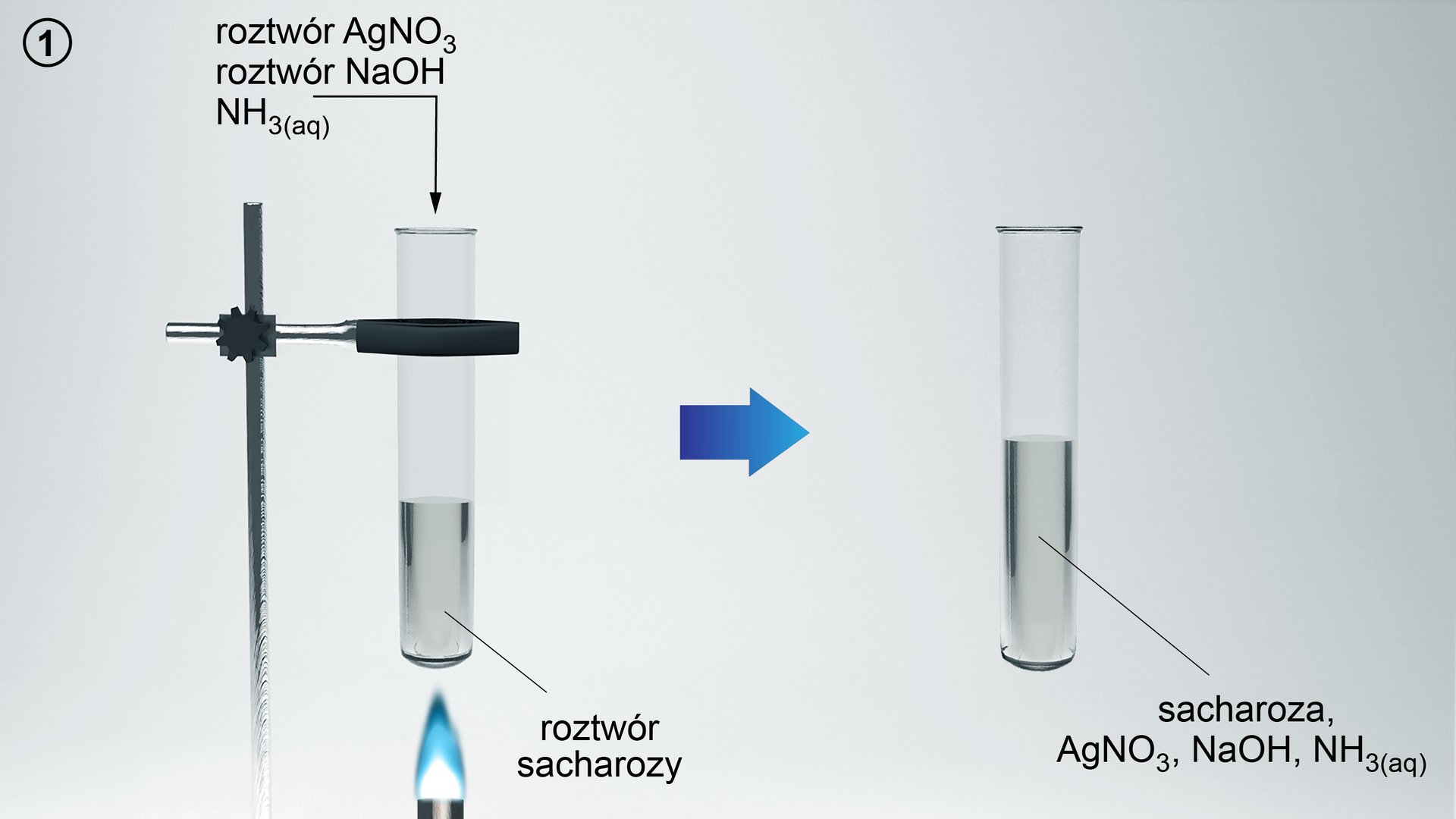
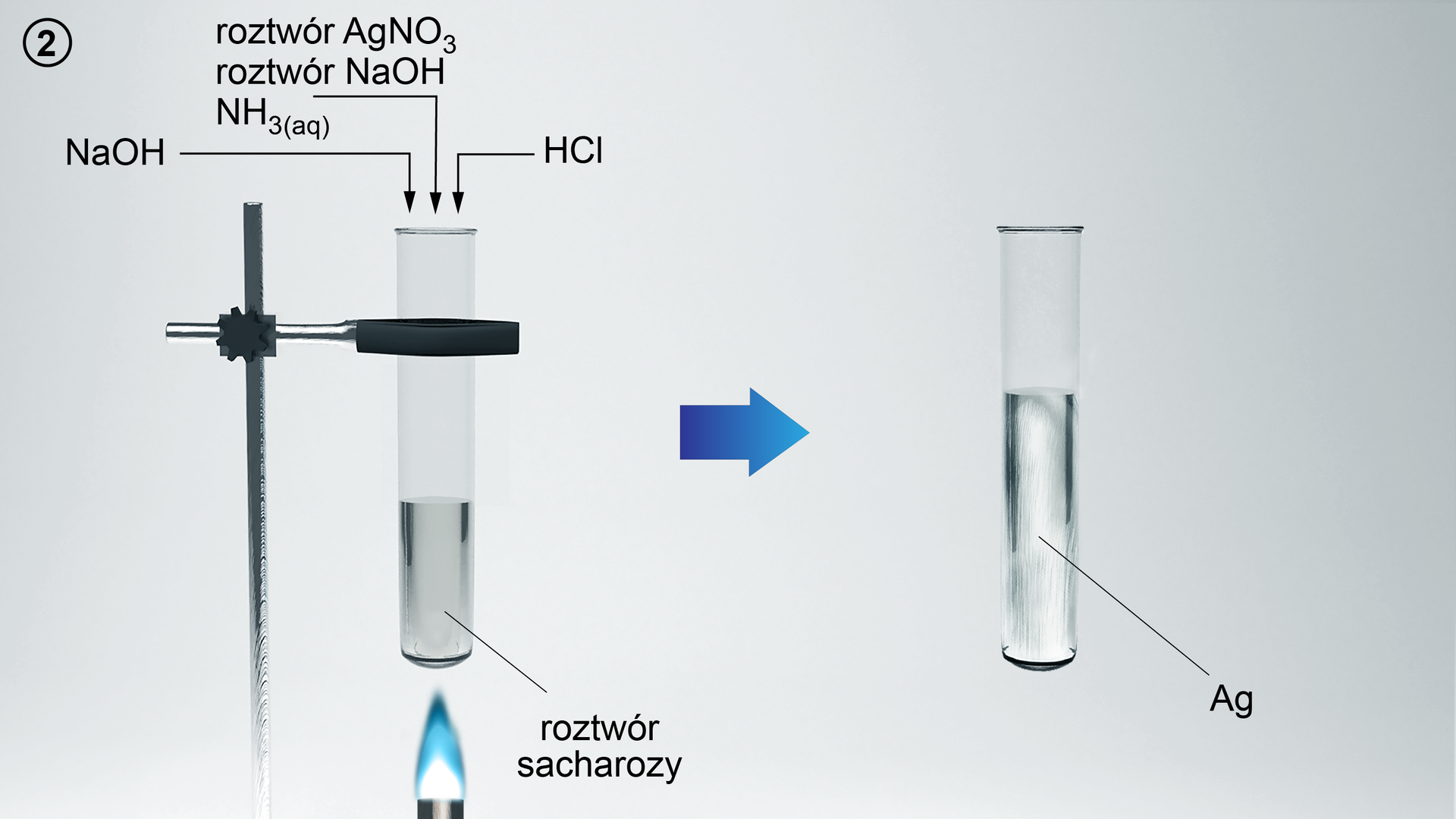
1. W dwóch probówkach umieść 3 cm3 sacharozy.
2. Do drugiej probówki dodaj kilka kropli kwasu chlorowodorowego. Za pomocą palnika ogrzej zawartość probówki. Następnie, kontrolując odczyn roztworu za pomocą uniwersalnego papierka wskaźnikowego, zobojętnij zawartość probówki dodając do niej wodorotlenek sodu.
3. Przygotuj odczynnik Tollensa. Do dwóch następnych probówek dodaj 3 cm3 roztworu azotanu(V) srebra(I), kilka kropli wodorotlenku sodu. Następnie dodaj kroplami wodę amoniakalną do momentu całkowitego rozpuszczenia osadu.
4. Do pierwszej i drugiej probówki dodaj odczynnik Tollensa. Zawartość probówek ogrzej.
5. Obserwuj zmiany.
Schemat doświadczenia:
W probówce 1, po dodaniu odczynnika Tollensa i ogrzaniu, nie ma żadnych zmian. W probówce 2, po dodaniu odczynnika Tollensa i ogrzaniu, na ściankach probówki powstaje srebrny osad.
Sacharoza nie reaguje z odczynnikiem Tollensa. Natomiast pod wpływem kwasu chlorowodorowego oraz ogrzewania ulega hydrolizie do cukrów prostych (glukozy i fruktozy). Produkty reakcji hydrolizy sacharozy dają pozytywny wynik próby Tollensa. Na ściankach probówki osadziło się metaliczne srebro – lustro srebrne.
Równania reakcji chemicznych:
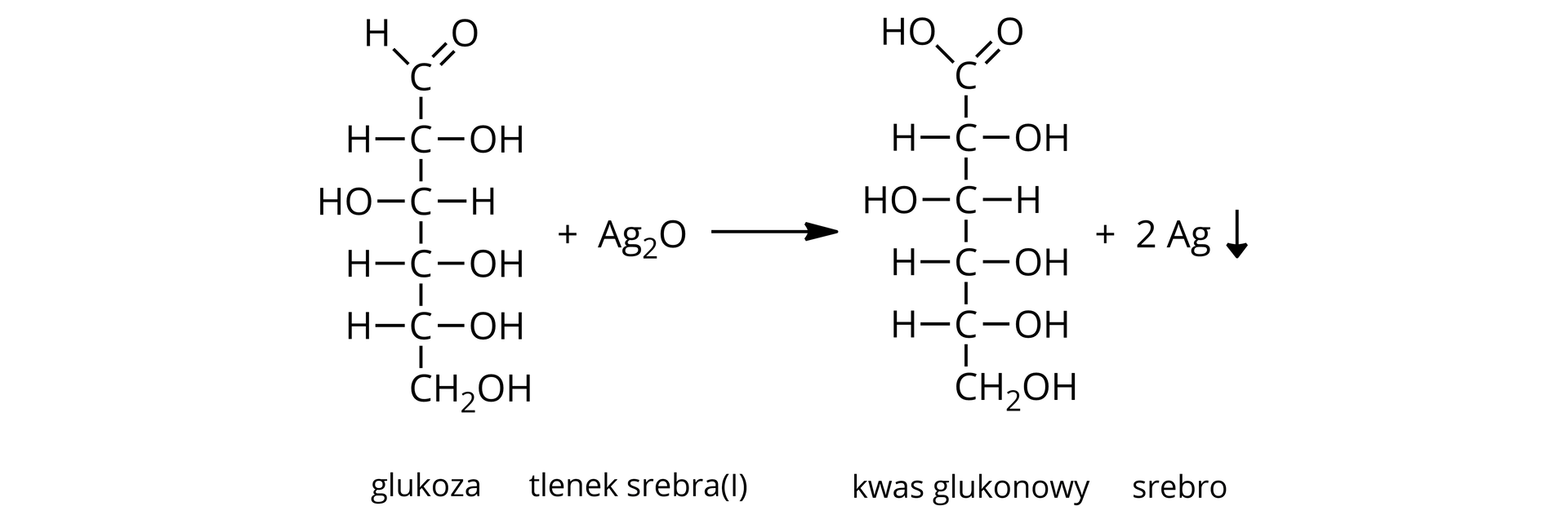

Pozytywny wynik w próbie Trommera i TollensaTollensa dają także cukry złożone, które wykazują właściwości redukujące. Należą do nich celobioza, laktoza, maltoza.
Badanie hydrolizy sacharozy oraz wykrywanie produktów reakcji – metoda polarymetryczna
Hydrolizę cukrów złożonych można badać za pomocą metody polarymetrycznej. Polega ona na pomiarze skręcalności właściwejskręcalności właściwej w danego związku podczas jego hydrolizy. Do pomiaru stosuje się specjalne urządzenie – polarymetr.
Skręcalność właściwa sacharozy wynosi . Produktami hydrolizy sacharozy są glukoza i fruktoza. Taka mieszanina cukrów nazywana jest cukrem inwertowanym. Skręcalność właściwa takiej mieszaniny wynosi , co świadczy o tym, że w wyniku hydrolizy sacharozy doszło do zmiany skręcalności.
Słownik
wielkość skręcania płaszczyzny światła spolaryzowanego przechodzącego przez warstwę roztworu zawierającego związku optycznie czynnego rozpuszczonego w ; wyrażana w stopniach
(gr. hýdōr „woda”, lýsis „rozłożenie”) rozkład substancji pod wpływem wody; polega na podwójnej wymianie pomiędzy substancją rozpuszczaną a wodą
węglowodan zbudowany z –glukozy i –fruktozy należący do disacharydów
reakcja chemiczna, dzięki której możliwe jest wykrycie aldehydów; pozytywna próba Tollensa prowadzi do wytworzenia srebra metalicznego, które osadza się na ścianach naczynia, gdzie zachodzi reakcja, tworząc lustrzaną powłokę
reakcja chemiczna służąca do wykrywania aldehydów; zachodzi przy zastosowaniu wodorotlenku miedzi()
Bibliografia
Klimaszewska M., Chemia Repetytorium od A do Z matura. Egzaminy na wyższe studia, Warszawa 1996.
Litwin M., Styska–zło S., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2018.