Przeczytaj
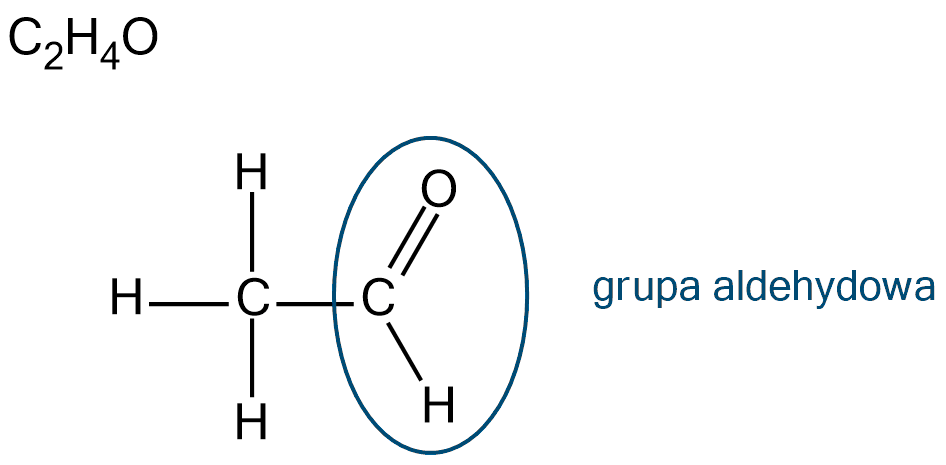
Budowa acetaldehydu (etanalu)
Acetaldehyd (etanal) posiada grupę funkcyjnągrupę funkcyjną – grupę aldehydową (formylową), a więc należy do grupy związków określanych jako aldehydy.
Grupa aldehydowa acetaldehydu (etanalu) jest połączona z grupą alkilową, dlatego związek ten należy do aldehydów alifatycznych.
W jaki sposób otrzymać acetaldehydu (etanal)?
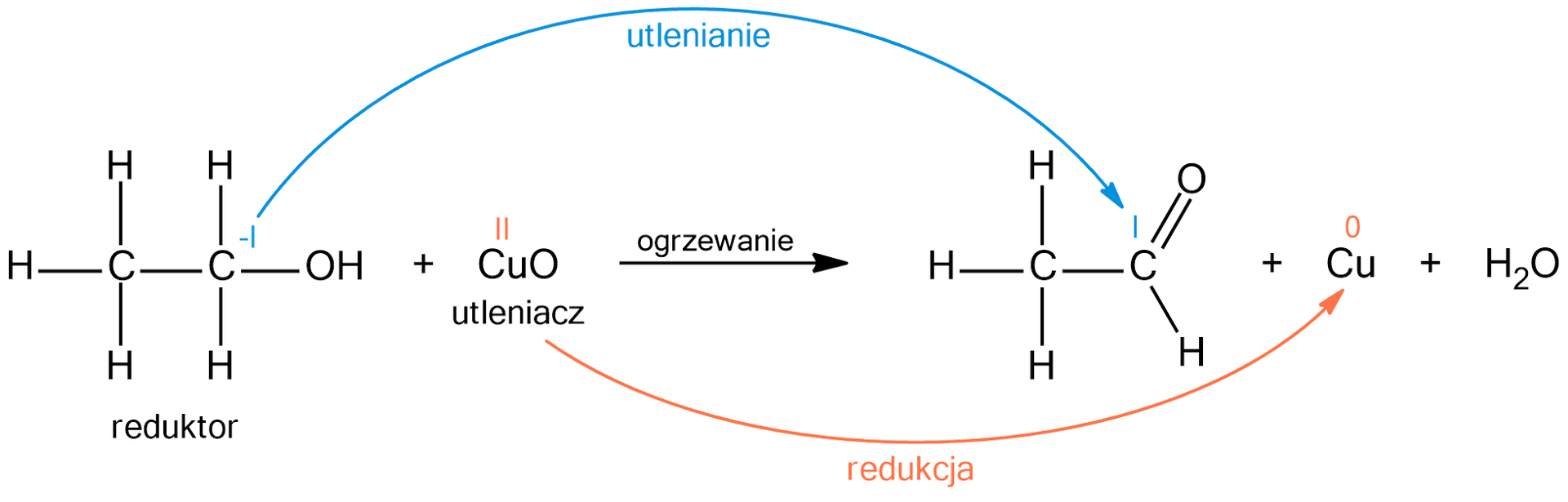
Utlenienie alkoholi pierwszorzędowych łagodnym utleniaczem
Na podstawie podanych poniżej informacji (problemu badawczego, instrukcji oraz wykazu sprzętu i odczynników) przedstaw hipotezę, przewidywane obserwacje oraz wnioski.
Zachowaj środki ostrożności przy wykonywaniu tego doświadczenia, ponieważ w wyniku tej reakcji powstaje produkt, który jest toksyczny, powoduje drażnienie błon śluzowych i łzawienie oczu.
Doświadczenie nr 1
Katalityczne utlenianie alkenów
Reakcja etenu z tlenem w obecności katalizatorówkatalizatorów oraz w odpowiednich warunkach ciśnienia (p) i temperatury (T) prowadzi do otrzymania etanalu. Poniżej przedstawiono równanie reakcji otrzymywania etanalu z etenu.
Katalityczne odwodornienie alkoholi pierwszorzędowych
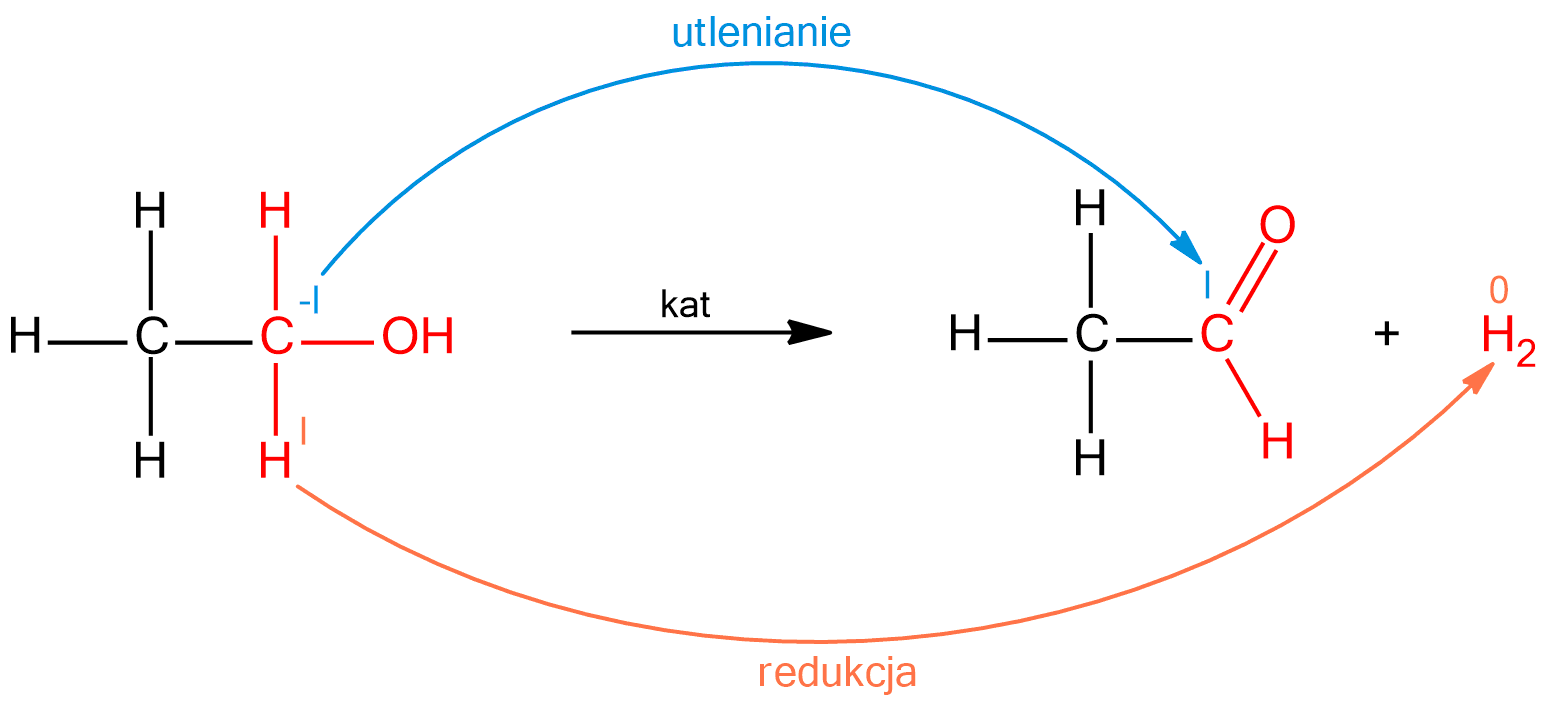
Reakcja odwodornieniaReakcja odwodornienia (dehydrogenacji) alkoholi pierwszorzędowychalkoholi pierwszorzędowych w obecności katalizatorów, prowadzi do otrzymania aldehydów.
Reakcja Kuczerowa
Reakcja addycjiReakcja addycji cząsteczki wody do cząsteczki etynu w obecności odpowiednich katalizatorów – siarczanu(VI) rtęci(II) oraz kwasu siarkowego(VI) – prowadzi do otrzymania etanalu. Poniżej przedstawiono równanie reakcji Kuczerowareakcji Kuczerowa.
Badanie właściwości acetaldehydu (etanalu)
Zbadaj wybrane właściwości fizyczne acetaldehydu: stan skupienia, barwę, rozpuszczalność w wodzie oraz rozpuszczalność w benzynie. Uzupełnij poniższą tabelę, przedstawiającą wybrane właściwości acetaldehydu.
Zbadaj wybrane właściwości chemiczne acetaldehydu: zapach oraz jego wodnego roztworu. OdczynOdczyn zbadaj za pomocą uniwersalnego papierka wskaźnikowego. Uzupełnij poniższą tabelę.
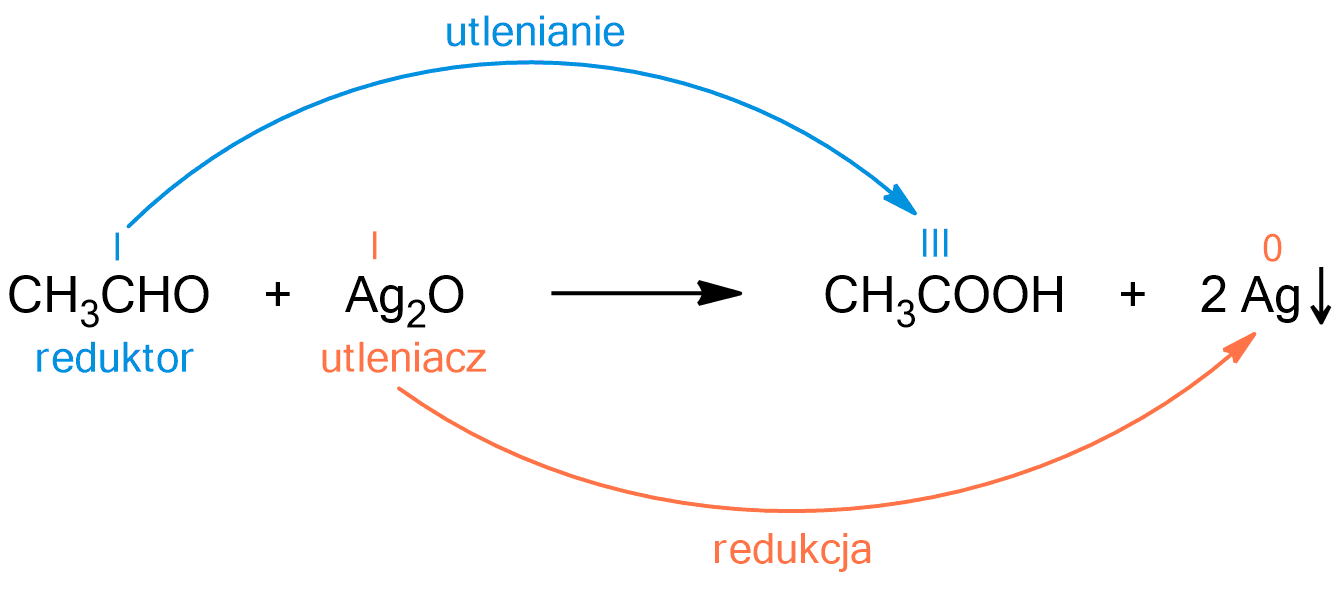
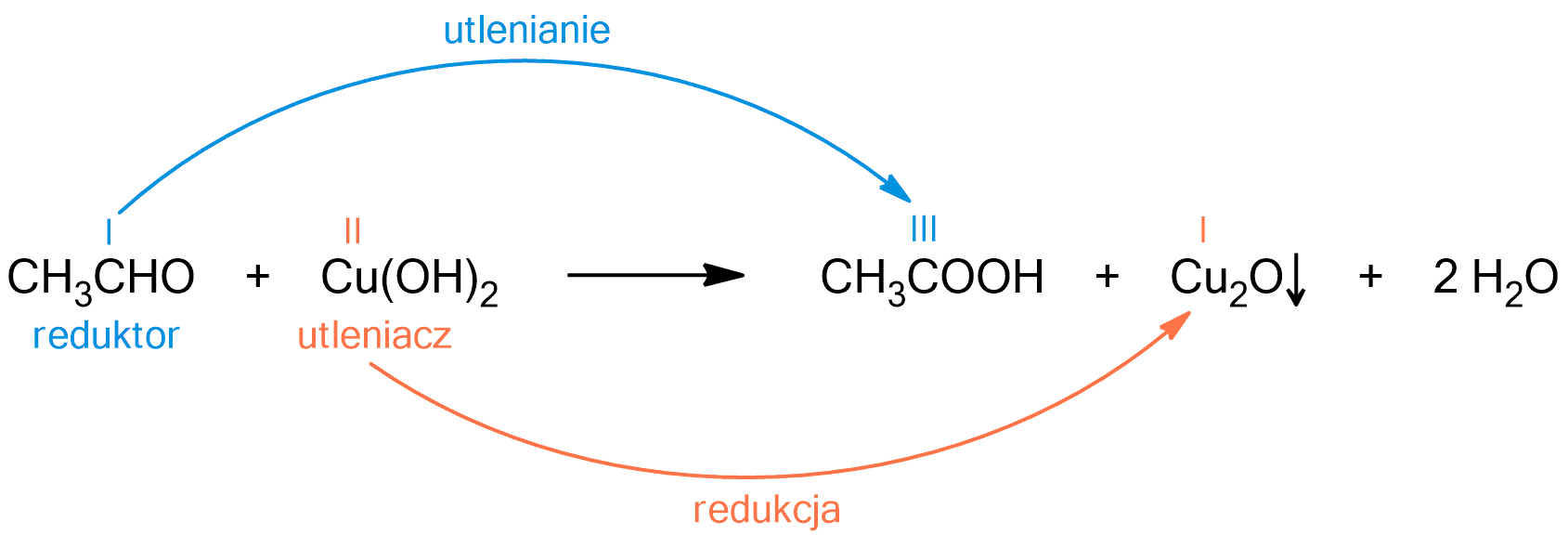
Niektóre substancje organiczne posiadają właściwości redukujące, a wynika to z ich budowy. Substancje, które posiadają właściwości redukujące, są zdolne do redukowania innej substancji, przy utlenianiu samych siebie. Chcąc sprawdzić, czy aldehydy posiadają właściwości redukujące, wykonamy trzy doświadczenia: próbę Tollensa, próbę Trommera oraz próbę Fehlinga.
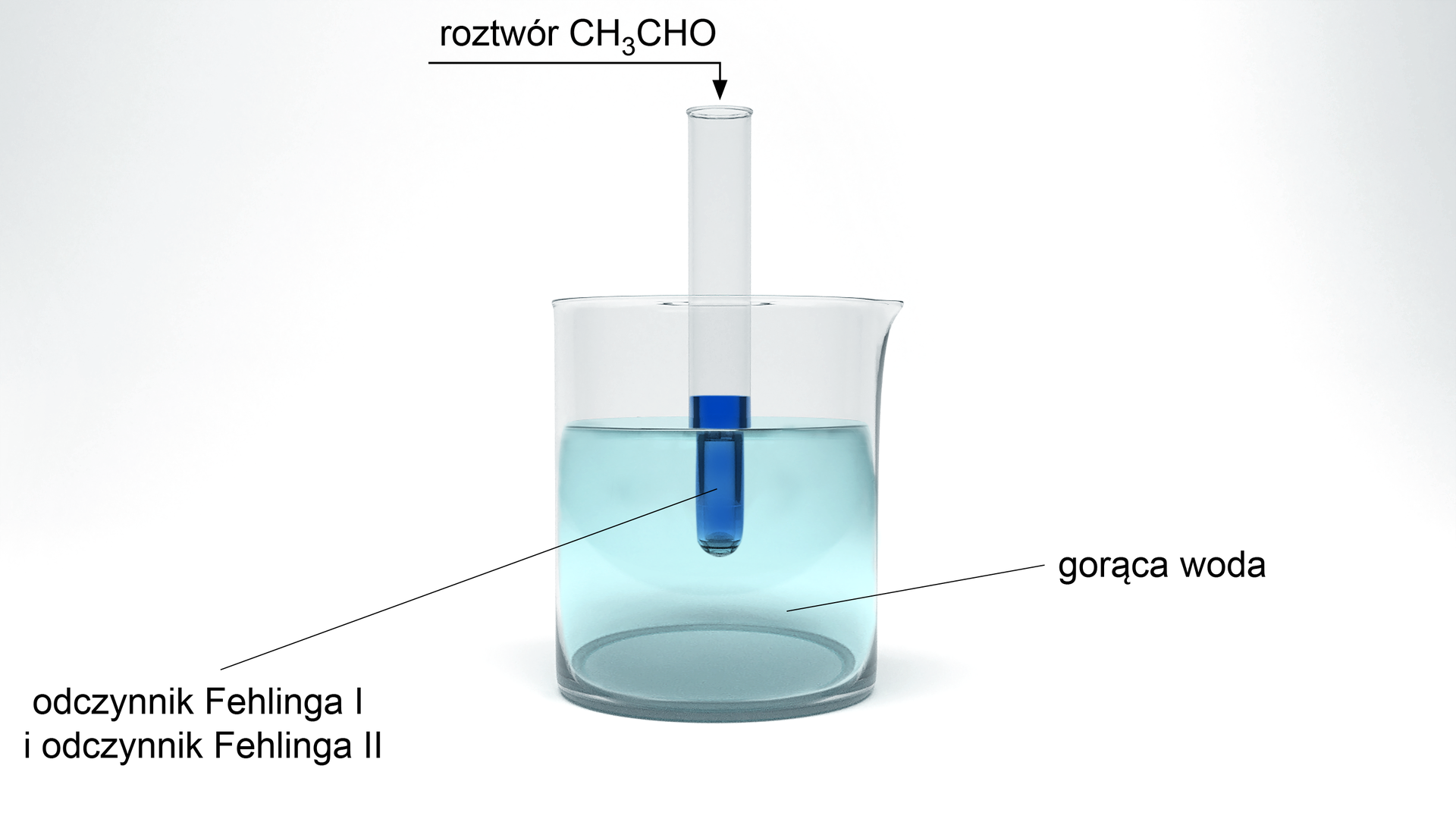
Przeanalizuj poniższe doświadczenie. Na podstawie zawartych informacji podaj hipotezę, obserwacje oraz wnioski.
Doświadczenie nr 2
Zachowaj środki ostrożności przy wykonywaniu tego doświadczenia, ponieważ etanal jest toksyczny, powoduje drażnienie błon śluzowych i łzawienie oczu.
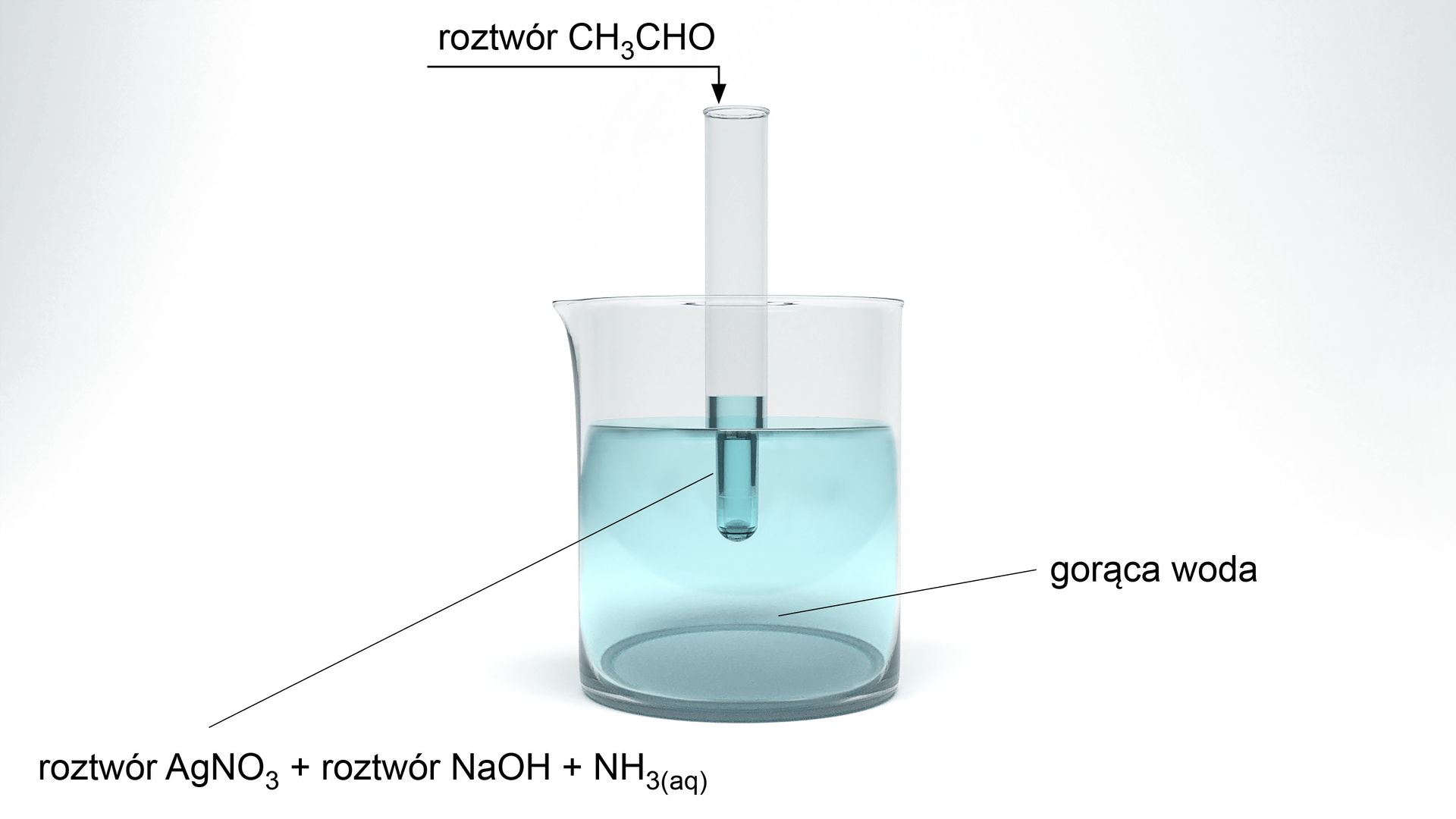
Schemat doświadczenia:
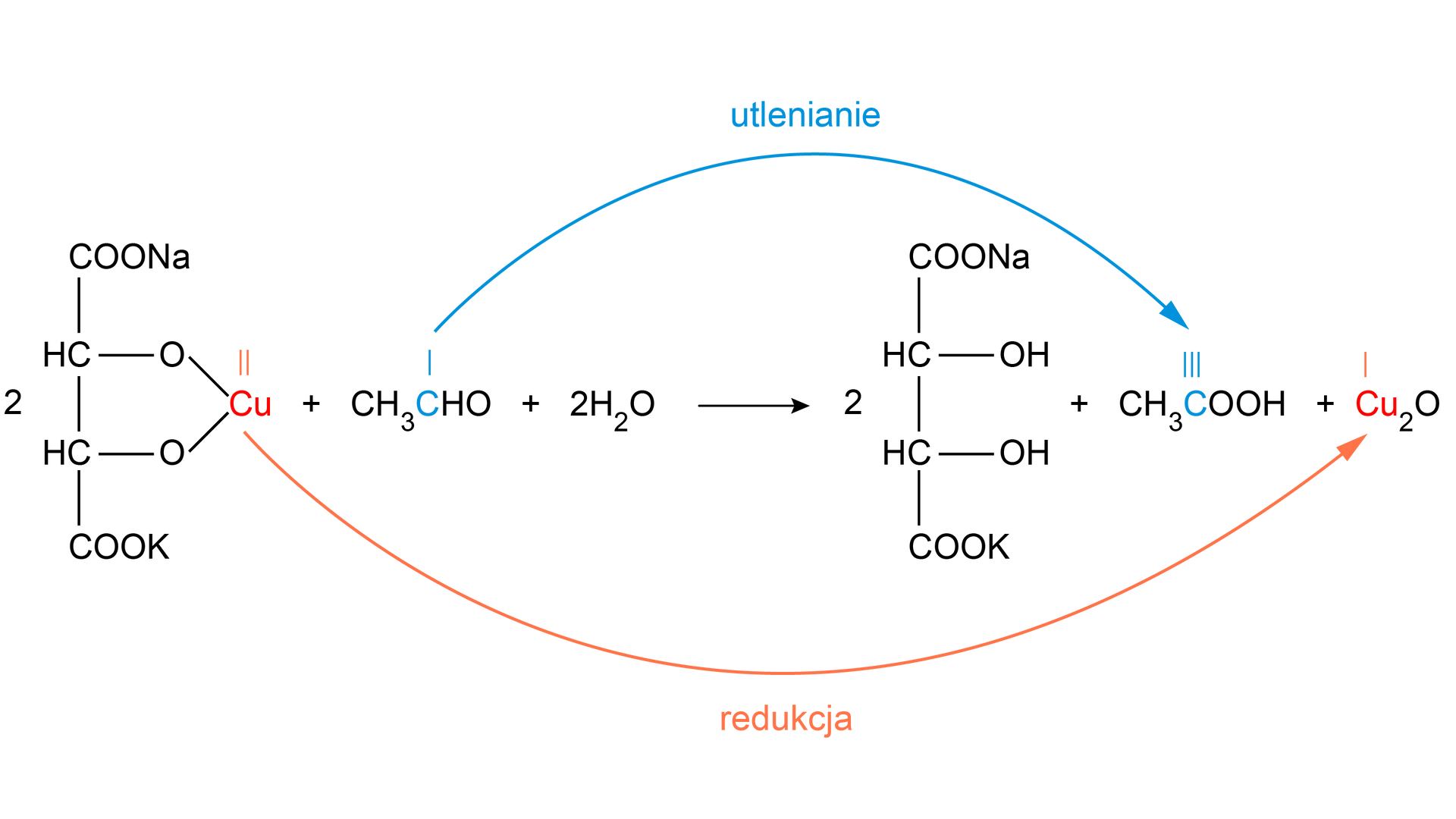
Przeanalizuj poniższe doświadczenie. Na podstawie zawartych informacji podaj hipotezę, obserwacje i wnioski.
Doświadczenie nr 3
Analiza doświadczenia: Badanie właściwości redukujących acetaldehydu (etanalu).
Zachowaj środki ostrożności przy wykonywaniu tego doświadczenia, ponieważ etanal jest toksyczny, powoduje drażnienie błon śluzowych i łzawienie oczu.
Schemat doświadczenia:

Przeanalizuj poniższe doświadczenie. Na podstawie zawartych informacji podaj hipotezę, obserwacje i wnioski.
Doświadczenie nr 4
Analiza doświadczenia: Badanie właściwości redukujących acetaldehydu (etanalu).
Zachowaj środki ostrożności przy wykonywaniu tego doświadczenia, ponieważ etanal jest toksyczny, powoduje drażnienie błon śluzowych i łzawienie oczu.
Schemat doświadczenia:

Podsumowanie
Acetaldehyd (etanal) można otrzymać w następujących reakcjach:
reakcja utlenienia alkoholi pierwszorzędowych łagodnym utleniaczemutleniaczem (np. );
reakcja utlenienia alkenów w obecności katalizatorów;
reakcja odwodornienia alkoholi pierwszorzędowych w obecności katalizatorów;
reakcja Kuczerowa.
Acetaldehyd (etanal) należy do grupy związków – aldehydów. Acetaldehyd jest substancją ciekłą, bezbarwną o charakterystycznym, drażliwym zapachu. Acetaldehyd posiada właściwości redukujące, ponieważ ulega zarówno próbie Tollensa, jak i Trommera.
Słownik
(łac. functio „czynność”) atom lub grupa atomów w związkach organicznych, która decyduje o właściwościach danego związku oraz jego przynależności do danej klasy związków
(łac. dissociātiō „rozdzielenie”) rozpad substancji na jony pod wpływem rozpuszczalnika (najczęściej wody)
(utlenianie, oksydacja: fr. oxygéne dosłownie „kwasoród”, „tlen”) reakcja polegająca na oddawaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest podwyższenie ich stopnia utlenienia
(łac. reductio „cofnięcie”, „,odzyskanie”) reakcja polegająca na przyjmowaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest obniżenie ich stopnia utleniania
(gr. katàlysis „rozwiązanie”, „rozłożenie”) substancja, która, wprowadzona do mieszaniny reakcyjnej, przyspiesza reakcję chemiczną, ale nie zużywa się w niej; katalizator można odzyskać po zakończeniu reakcji chemicznej
alkohol, w którego cząsteczce grupa funkcyjna – grupa hydroksylowa – jest przyłączona do pierwszorzędowego atomu węgla (atom węgla, który jest połączony z jednym atomem węgla w cząsteczce); przykładem alkoholu pierwszorzędowego jest propan‑1-ol
substancja, która posiada właściwości redukujące; substancja ta redukuje inną substancję, sama utleniając się; reduktor oddaje elektrony, przez co podwyższa swój stopień utlenienia
substancja, która utlenia inną substancję, sama redukując się; utleniacz przyjmuje elektrony, przez co obniża swój stopień utlenienia
reakcja odłączenia (eliminacji) cząsteczki wodoru od cząsteczki danego związku chemicznego
cecha roztworu, określająca zależności między stężeniem jonów oksoniowych i jonów wodorotlenkowych (); odczyn roztworu może być:
kwasowy, gdy stężenie jonów oksoniowych [] > stężenie anionów wodorotlenkowych []
zasadowy, gdy stężenie jonów oksoniowych [] < stężenie anionów wodorotlenkowych []
obojętny, gdy stężenie jonów oksoniowych [] = stężenie anionów wodorotlenowych []
zdolność substancji do redukowania innej substancji, przy utlenianiu samej siebie; substancja posiadająca takie właściwości, oddaje elektrony innej substancji, przez co podwyższa swój stopień utlenienia; substancja, która posiada właściwości redukujące, jest nazywana reduktorem
liczba ładunku elementarnego, jaki posiadałby atom, gdyby w danej substancji wszystkie wiązania były jonowe
reakcja przyłączenia cząsteczki wody do cząsteczki etynu w obecności katalizatorów: siarczanu(VI) rtęci(II) oraz kwasu siarkowego(VI)
reakcja, która polega na przyłączeniu atomów pierwiastka lub cząsteczki związku chemicznego do cząsteczki mającej wiązanie nienasycone (podwójne lub potrójne); w reakcji addycji powstaje jeden produkt
związek chemiczny, którego cząsteczka składa się z atomu/jonu tzw. centralnego, połączonego za pomocą wiązań koordynacyjnych z ligandami; ligandem może być jon lub cząsteczka obojętna
Bibliografia
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa, 2016.
Grosch W., Flavour of coffee. A review, „Food/Nahrung” 1998, 6, 42, s. 344‑350.
Grosch W., Key odorants of roasted coffee: evaluation, release, formation, „Proc. of ASIC 18th Colloquium on Coffe” 1999.
Kopaliński W., Słownik wyrazów obcych i zwrotów obcojęzycznych, Warszawa 1983.
Litwin M., Styka–Wlazło S., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
McMurry J., Chemia organiczna 4, Warszawa 2004.
Pazdro K. M., Rola–Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.