Przeczytaj
Właściwości aminokwasów
Aminokwasy są ciałami stałymi, krystalicznymi, o dość wysokich temperaturach topnienia, dobrze rozpuszczają się w wodzie, a słabo w polarnych rozpuszczalnikach organicznych. W stanie stałym występują w postaci soli wewnętrznych, które zawierają tzw. jony obojnaczejony obojnacze, jak na poniższej grafice.
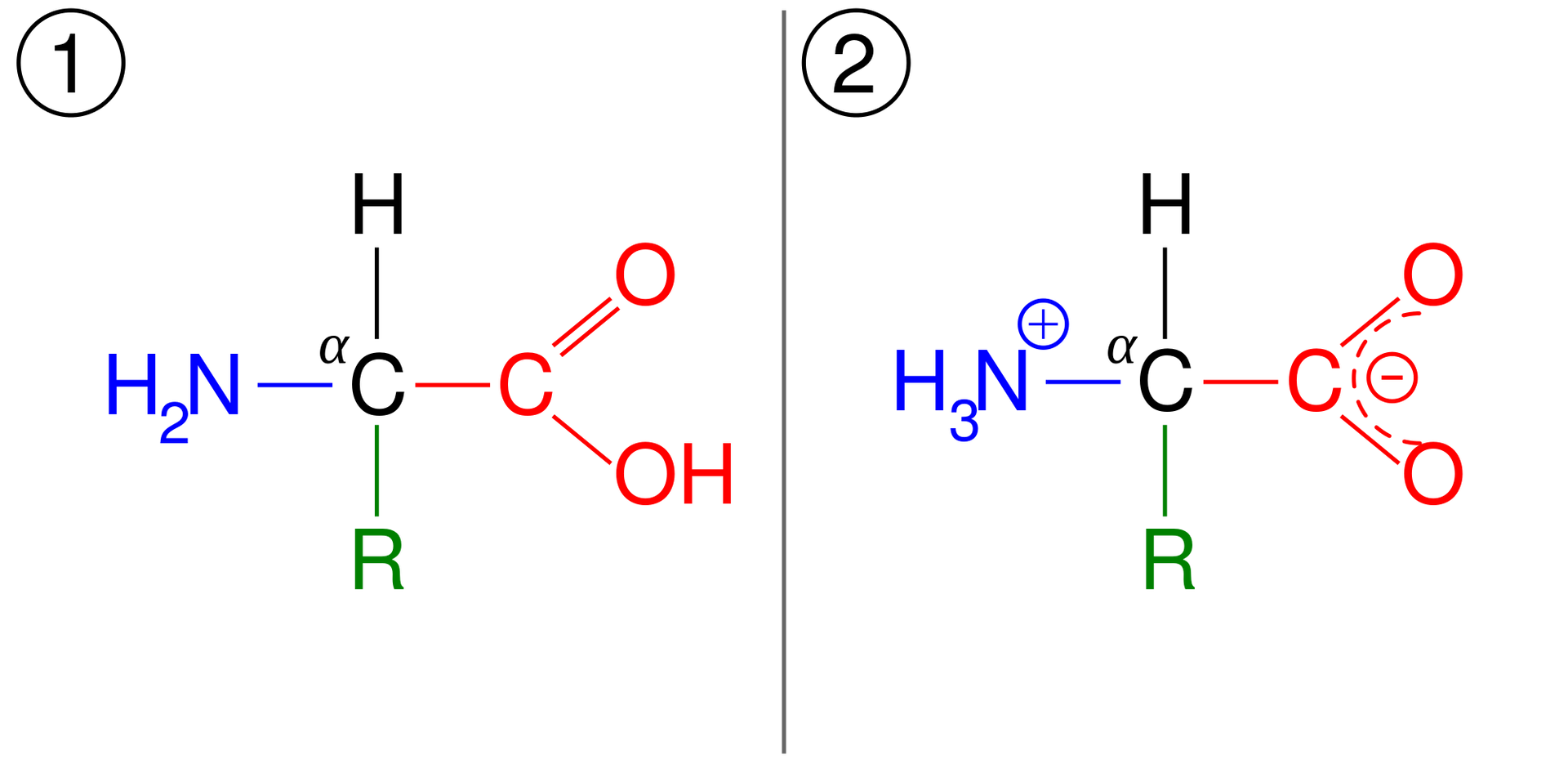
W wodnym roztworze aminokwasu, zawierającego w cząsteczce jedną grupę karboksylową i jedną grupę aminową, ustala się stan równowagi, w którym występują trzy formy jonowe:
pH roztworu | Forma, w jakiej występuje aminokwas |
|---|---|
| |
Punkt izoelektryczny |
|
|
Wartość pHpH roztworu, w którym istnieje dokładna równowaga między formą kationową i anionową (stężenie kationowej i anionowej formy jest minimalne i równe sobie) a stężeniem jonu obojnaczego, nazywamy punktem izoelektrycznympunktem izoelektrycznym (). Zmiana roztworu (alkalizacja lub zakwaszenie roztworu) wywołuje przesunięcie równowagi w stronę anionu lub w stronę kationu .
Możliwość uzyskiwania, w zależności od środowiska, ładunku dodatniego lub ujemnego przez cząsteczki aminokwasu jest podstawą metody rozdzielania i identyfikacji aminokwasów. Polega ona na wywołaniu migracji cząsteczek (a ściślej – jonów) w polu elektrycznym. Różne masy jonów oraz ich ładunki sprawiają, że ich ruch w polu elektrycznym zachodzi z różną prędkością. Taka metoda rozdziału mieszanin związków chemicznych nosi nazwę elektroforezy.
Słownik
(gr. iṓn „idący”) jon dwubiegunowy; amfijon; zwitterjon; jon obdarzony zarówno ładunkiem ujemnym, jak i dodatnim
wartość pH, w której dany aminokwas występuje w postaci jonu obojnaczego – obdarzonego zarówno ładunkiem dodatnim, jak i ujemnym
(łac. potentium hydrogenii „wykładnik wodoru”) wykładnik jonów wodorowych; wielkość stosowana do określania odczynu roztworu
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.