Przeczytaj
Jak możemy podzielić kryształy?
KryształyKryształy tworzą jedną z dwóch podstawowych grup stałego stanu materii. Charakteryzują się uporządkowaną budową, która ma odzwierciedlenie w ich właściwościach. Kryształy można podzielić na cztery grupy ze względu na występujące w nich wiązania, które decydują o właściwościach fizycznych kryształów.
Wyróżniamy:
Podział rozpuszczalników
Rozpuszczalniki natomiast podzielić można:
ze względu na budowę cząsteczek na:
ciecze polarne, w których rozpuszczają się cząsteczki dipolowe oraz związki jonowe;
ciecze niepolarne, rozpuszczające cząsteczki, które nie są dipolami.
ze względu na własności chemiczne na:
protonowe (protyczne) – zawierające w swojej strukturze tzw. kwaśne protonykwaśne protony, które mogą ulec oderwaniu przez cząsteczkę zasady, a także brać udział w tworzeniu wiązań wodorowych;
aprotonowe (aprotyczne) – w strukturze nie posiadające „kwaśnych” protonów.
Reasumując, wszystkie rozpuszczalniki protonowe są też polarne, natomiast aprotonowe mogą być zarówno polarne, jak i niepolarne. Co ostatecznie daje trzy główne grupy rozpuszczalników:
protonowe,
aprotonowe polarne,
aprotonowe niepolarne.
Rozpuszczalniki polarne
Rozpuszczanie zależy od rodzaju rozpuszczalnika, a dokładnie od jego stałej dielektrycznej stałej dielektrycznej . Stałe dielektryczne w wybranych substancji zostały przedstawione w tabeli poniżej:
Rodzaj rozpuszczalnika | Nazwa | Wzór | Stała dielektryczna |
|---|---|---|---|
polarny protyczny | woda | ||
polarny protyczny | metanol | ||
polarny protyczny | etanol | ||
polarny aprotyczny | aceton | ||
polarny aprotyczny | acetonitryl | ||
polarny aprotyczny | tetrahydrofuran |
Indeks górny źródło: Tadeusz Hermann, Podręcznik dla studentów farmacji i analityki medycznej, PZWL, Warszawa 2008. Indeks górny koniecźródło: Tadeusz Hermann, Podręcznik dla studentów farmacji i analityki medycznej, PZWL, Warszawa 2008.
Najbardziej popularnym i najczęściej stosowanym rozpuszczalnikiem jest woda. Cechuje ją mała lepkość, dzięki czemu łatwo penetruje rozpuszczaną substancję oraz stosunkowo niska temperatura wrzenia (około ), dzięki czemu można ją łatwo oddestylować bądź odparować z roztworu. Cząsteczka wody ma tę niezwykłą właściwość, że na skutek jej działania, wiązania spolaryzowane lub jonowe innych związków chemicznych ulegają rozerwaniu i substancja rozpada się (dysocjuje) na jony. Wynika to z faktu, że w cząsteczce wody występują wiązania kowalencyjne (atomowe) spolaryzowane (różnica elektroujemności pomiędzy tlenem a wodorem wynosi ). Bardziej elektroujemny atom (tlen) stanowi biegun ujemny, a mniej elektroujemny (wodór) biegun dodatni. Cząsteczka wody posiada zatem dwa bieguny (dodatni i ujemny) i o takiej cząsteczce mówimy, że jest dipolem.
Podstawową regułą rządząca zjawiskiem rozpuszczania jest reguła stwierdzająca, że podobne rozpuszcza się (miesza się) w podobnym (łac. „similia similibus solventur”). Przez „podobne” rozumiemy tu przede wszystkim polarność cząsteczek mieszających się w roztworze.
Uwzględniając rodzaj wiązań, który decyduje o właściwościach fizycznych kryształów wyróżniamy: kryształy kowalencyjne, kryształy jonowe, kryształy o wiązaniach metalicznychkryształy o wiązaniach metalicznych i kryształy molekularnekryształy molekularne.
W oparciu o powyższe informacje, spróbuj przewidzieć, które kryształy będą cechować się dobrą rozpuszczalnością w wodzie.
Jeśli nie znasz odpowiedzi na powyższe polecenie - czytaj dalej!
Kryształ jonowy, np. to związek co najmniej dwóch indywiduów chemicznych, z których jeden posiada ładunek ujemny, a drugi dodatni. Struktura kryształu jest utrzymywana dzięki oddziaływaniom elektrostatycznym wynikającym z wzajemnego przyciągania dwóch różnoimiennych ładunków. Rozkład ładunku elektrycznego wokół każdego jonu wykazuje z dużym przybliżeniem symetrię kulistą, a jony można traktować jako naelektryzowane sztywne kule.
Kryształy jonowe są dobrze rozpuszczalne w rozpuszczalnikach polarnych takich jak woda. Kryształy molekularne natomiast zawierają wiązania kowalencyjne. Cząsteczki połączone są w sieć za pomocą słabych oddziaływań van der Waalsa (niepolarne) lub poprzez oddziaływania dipol–dipol lub wiązanie wodorowe (cząsteczki polarne). Do tej grupy struktur należą kryształy związków organicznych np. cukier (sacharoza) rozpuszczalny w wodzie jak i nierozpuszczalny fulleren. Z kolei kryształy kowalencyjne, np. kryształy diamentu czy krzemu tworzą sieć krystaliczną, w której węzłach znajdują się atomy pierwiastka połączone wiązaniami kowalencyjnymi i są rozpuszczalne tylko w rozpuszczalnikach niepolarnych.
Kryształy jonowe, np. soli kuchennej, siarczanu() miedzi() – czy siarczanu () żelaza() – są łatwo rozpuszczalne w rozpuszczalnikach polarnych, w przeciwieństwie do kryształów kowalencyjnych, np. kryształu diamentu.
Badanie zachowania się kryształów w wodzie na przykładzie soli i cukru
Większość kryształów jonowych jest dobrze rozpuszczalna w wodzie i rozpuszczalnikach polarnych. Ogólnie rozpuszczalność reguluje pewna zależność. Związki jonowe rozpuszczają się w wodzie, jeśli energia, wydzielana podczas oddziaływania jonów z cząsteczkami wody, kompensuje energię potrzebną do rozbicia wiązań jonowych w ciele stałym i energię potrzebną do oddzielenia cząsteczek wody, aby jony mogły zostać wprowadzone do roztworu.
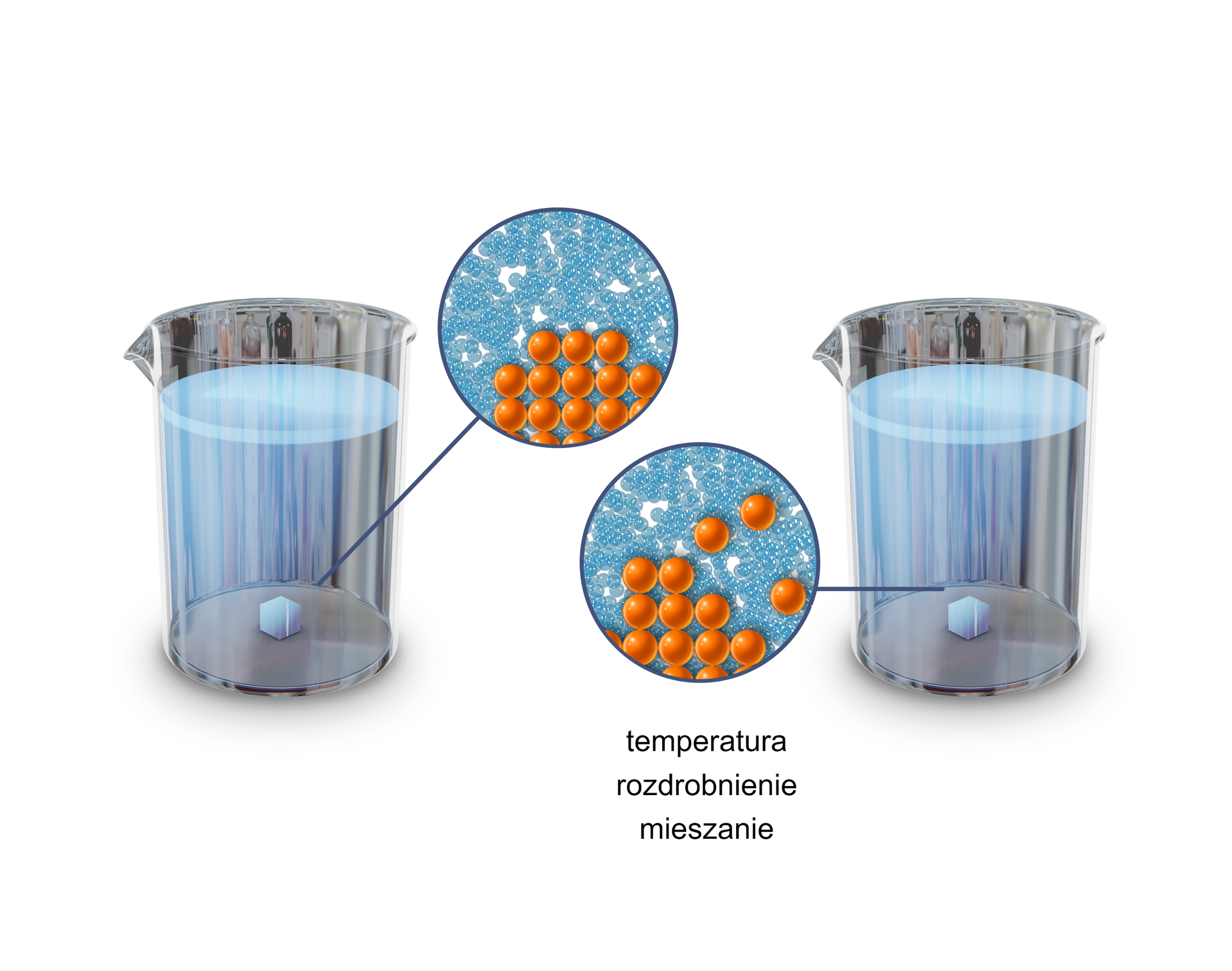
Już wiesz, że szybkość rozpuszczania zależy od rodzaju substancji i rozpuszczalnika, natomiast istotne są również warunki, w jakich przeprowadzony jest proces rozpuszczania.
Z własnego doświadczenia wiesz, że dodając cukier do ciepłej wody szybciej ulegnie on rozpuszczeniu niż w wodzie zimnej. Istnieją trzy sposoby przyspieszenia rozpuszczania kryształów.
Ogrzewanie roztworu: zwiększa to energię kinetyczną rozpuszczalnika, a substancja rozpuszczona jest szybciej „atakowana” przez cząsteczki rozpuszczalnika.
Mieszanie roztworu: zwiększa to interakcję między cząsteczkami rozpuszczalnika i substancji rozpuszczonej.
Rozdrabnianie substancji stałej: zwiększa się powierzchnia oddziaływania pomiędzy substancją rozpuszczaną a rozpuszczalnikiem.
Słownik
tworzenie się i wzrost kryształów (lub krystalitów)
kryształ; równoległościan stanowiący podstawowy, powtarzający się okresowo w przestrzeni element sieci przestrzennej; kształt i rozmiary komórki elementarnej określają stałe sieciowe: długości krawędzi: , , , i kąty: , , między nimi
kryształ, w którym sieć krystaliczną tworzą zdefiniowane cząsteczki powiązane słabymi oddziaływaniami międzycząsteczkowymi (np. siłami van der Waalsa)
kryształy mające w węzłach sieci krystalicznej obojętne elektrycznie atomy; wiązania tworzą pary elektronów walencyjnych pochodzących od dwóch sąsiednich atomów, elektrony te stanowią wspólną własność obydwu atomów; takie wiązania przejawiają wyraźną kierunkowość, a typowym przykładem jest diament; cechy kryształów walencyjnych to duża twardość oraz małe przewodnictwo elektryczne
kryształy w których węzły sieci krystalicznej są obsadzone przez jony – kationy i aniony o równoważnej ilości ładunków elektrycznych (dzięki czemu kryształ jonowy jako całość jest elektrycznie obojętny); kryształy jonowe tworzą głównie sole składające się z pierwiastków o dużej różnicy elektroujemności, np. , – związki o wysokim stopniu jonowości wiązania
kryształy w których elektrony walencyjne są wspólne dla wszystkich jonów w krysztale; w atomach, z których jest zbudowany kryształ metaliczny, swobodne elektrony poruszają się w całym krysztale, są wspólne dla wszystkich jonów i tworzą gaz elektronowy wypełniający przestrzeń pomiędzy dodatnimi jonami; kryształy metaliczne są doskonałymi przewodnikami elektryczności i ciepła; przykładem kryształów metalicznych są kryształy tworzone przez metale alkaliczne
jeżeli wielkość siły wzajemnego oddziaływania ładunków elektrycznych w zależności od ich wielkości (, ) i odległości ( ) dana jest prawem Coulomba:
stała dielektryczna epsilon charakteryzuje ośrodek, w którym powyższe ładunki na siebie oddziaływają
kation (jon dodatni) utworzony z atomu wodoru, poprzez oderwanie jego jednego elektronu – czyli jon wodorowy, który jest wolnym, nietrwałym protonem; w zapisach przebiegu reakcji chemicznych zapisywany jako
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Bogdańska Zarembina A., Matusewicz E. I., Matusewicz J., Chemia dla szkół średnich, Warszawa 1995.
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.