Przeczytaj
Dlaczego wraz ze zmianą stopnia utlenienia metalu bloku d zmienia się charakter kwasowo‑zasadowy jego tlenków?
Jedną z charakterystycznych cech większości pierwiastków d-elektronowych jest zdolność do tworzenia związków, w których występują na kilku różnych stopniach utlenienia. Zazwyczaj najniższy stopień utlenienia metalu bloku d w jego tlenkach to +II. Jednym z wyjątków są w tym względzie miedziowce, które mogą tworzyć tlenki, w których występują na +I stopniu utlenienia. Wraz z utratą elektronów, a co za tym idzie, zwiększaniem się stopnia utlenienia, zmniejsza się promień jonowy pierwiastka. Zmienia się również charakter wiązania tworzonego przez metal z tlenem. W przypadku niższych stopni utlenienia dominującą formę przyjmuje charakter jonowy wiązańjonowy wiązań, natomiast w przypadku wyższych - kowalencyjnykowalencyjny.
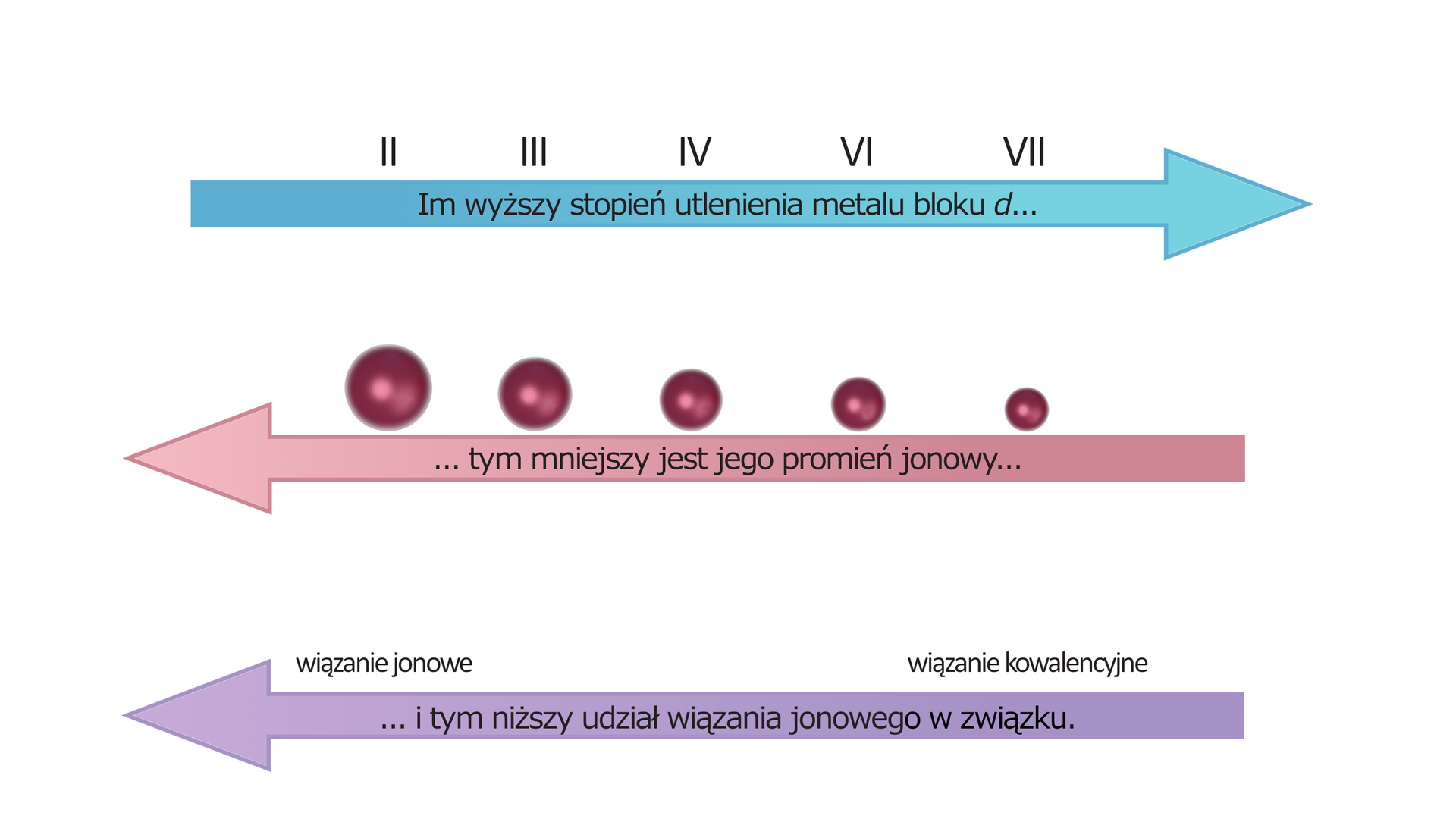
Zmiana charakteru wiązania chemicznego znacznie wpływa na właściwości tlenków metali.
Tlenki możemy podzielić na:
(Kliknij na wybrany kafelek i dowiedz się więcej.)
zasadowe
Wiązanie w tlenkach zasadowych zazwyczaj ma charakter jonowy. Tlenki te mogą ulegać reakcjom chemicznym z kwasami, ale nie reagują z zasadami.
kwasowe
Tlenki kwasowe charakteryzuje obecność wiązania kowalencyjnego, wynikającego z wysokiego stopnia utlenienia pierwiastka. Tlenki kwasowe mogą reagować z zasadami, ale nie ulegają reakcjom z kwasami.
amfoteryczne
Tlenki amfoteryczne charakteryzuje duży stosunek ładunku do promienia. Wiązanie ma zwykle charakter przejściowy pomiędzy wiązaniem jonowym a kowalencyjnym. Tlenki te wchodzą w reakcje chemiczne zarówno z kwasami, jak i z zasadami.
obojętne
Tlenki obojętne są niereaktywne.
Właściwości kwasowo‑zasadowe tlenków na przykładzie chromu
Chrom jest pierwiastkiem znajdującym się w 6 grupie układu okresowego. W stanie podstawowym posiada 6 elektronów walencyjnychelektronów walencyjnych znajdujących się na podpowłokach 4s i 3d.
Konfiguracja powłoki walencyjnej: 3dIndeks górny 5 Indeks górny koniec 54sIndeks górny 11.
Chrom tworzy stabilne tlenki na +II, +III i +VI stopniu utlenienia. Konfiguracja powłoki walencyjnej dla atomu chromu:
w przypadku występowania chromu na +II stopniu utlenienia: 4sIndeks górny 003dIndeks górny 44;
w przypadku występowania chromu na +III stopniu utlenienia: 4sIndeks górny 003dIndeks górny 33;
w przypadku występowania chromu na +VI stopniu utlenienia: 4sIndeks górny 003dIndeks górny 00.
Warto zaznaczyć, że elektrony atomu chromu są oddawane najpierw z orbitalu 4s, a następnie z orbitalu 3d, mimo że energia orbitalu 4s jest niższa niż orbitalu 3d. Wynika to z faktu, że obsadzenie tych orbitali przez elektrony wpływa na ich poziom energetyczny. Gdy na orbitalu 3d znajdzie się elektron, wtedy energia orbitalu 3d staje się niższa od energii obsadzonego elektronami orbitalu 4s. Z tego powodu elektrony orbitalu 4s oddawane są w pierwszej kolejności, a dopiero w drugiej kolejności elektrony orbitalu 3d.
Chrom na +II stopniu utlenienia - konfiguracja podpowłoki walencyjnej: 3dIndeks górny 444sIndeks górny 00
Tlenek chromu(II)
Ze względu na niski stopień utlenienia chromu wiązanie pomiędzy chromem a tlenem ma charakter jonowy, co wpływa na zasadowym charakter chemiczny tego tlenku. Tlenek ten reaguje z kwasami, w wyniku czego otrzymuje się sole chromu(II), np.:
Co ciekawe, tlenek ten, mimo że wykazuje zasadowy charakter chemiczny, to nie jest tlenkiem zasadotwórczym - w normalnych warunkach nie reaguje z wodą z wytworzeniem wodorotlenku.
Chrom na +III stopniu utlenienia - konfiguracja podpowłoki walencyjnej: 3dIndeks górny 334sIndeks górny 00
Tlenek chromu(III)
Wiązanie w tlenku chromu(III) zaliczamy formalnie do jonowych, ale procentowy udział wiązania jonowego jest nieco mniejszy niż w przypadku tlenku chromu(II), a co za tym idzie większy jest udział charakteru kowalencyjnego wiązania. Tlenek chromu(III) wykazuje właściwości amfoteryczne, tzn., że może reagować zarówno z kwasami, jak i zasadami, np.:
Zapamiętaj również, że tlenki amfoteryczne generalnie nie reagują z wodą - w wyniku reakcji tlenku chromu(III) z wodą nie powstaje zatem wodorotlenek chromu(III).

Tlenek chromu(III) ze względu na swoją charakterystyczną barwę był wykorzystywany jako pigment w farbach emaliowych i do barwienia szkła - viridian. Pigemnt ten wykorzystał Van Gogh do namalowania obrau „Café Terrace at Night”. Farbę zawierającą ten tlenek wykorzystano do pomalowania jednego z mostów w Kolonii.
Chrom +VI stopniu utlenienia - konfiguracja podpowłoki walencyjnej: 3dIndeks górny 004sIndeks górny 00
Charakter wiązania – ze względu na wysoki stopień utlenienia chromu wiązanie ma charakter kowalencyjny. To sprawia, że tlenek chromu(VI) posiada charakter kwasowy, co oznacza, że może on reagować z zasadami, ale nie może reagować z kwasami:
Tlenek chromu(VI), oprócz kwasowego charakteru, jest również tlenkiem kwasotwórczym. W wyniku jego reakcji z wodą powstają kwasy: kwas chromowy(VI) i dichromowy(VI):
Wraz ze spadkiem charakteru jonowego wiązania i wzrostem charakteru kowalencyjnego zmienia się charakter tlenków - tlenki metali na niższych stopniach utlenienia wykazują charaktery zasadowe, te na pośrednich charaktery amfoteryczne, a tlenki metali o najwyższych stopniach utlenienia posiadają kwasowy charakter chemiczny.
Słownik
tlenek, który w reakcji z wodą tworzy odpowiedni kwas
elektrony znajdujące się najdalej od jądra w znacznym stopniu odpowiedzialne są za tworzenie wiązań chemicznych
wiązanie polegające na oddziaływaniu pomiędzy jonami o różnych ładunkach
wiązanie tworzone poprzez współdzielenie par elektronowych pomiędzy atomami
Bibliografia
Atkins P., Jones L., Podstawy Chemii, Warszawa 2009.
Bielański A., Podstawy Chemii Nieorganicznej, t. 2, Warszawa 2007.
Pajdowski L., Chemia ogólna, Warszawa 2002.