Przeczytaj
Właściwości fizyczne
Promień atomowy
W sieci krystalicznej, składającej się z uporządkowanych atomów ściśle przylegających do siebie, istnieje możliwość zmierzenia odległości pomiędzy dwoma jądrami sąsiednich atomów tego samego pierwiastka. Połowa tej odległości to promień atomowypromień atomowy.

Spójrzmy na promienie atomowe pierwiastków 2. okresu, które dla danego pierwiastka są umieszczone w zielonym półkolu (w układzie okresowym zamieszczonym poniżej) i wyrażone w pm (pikometr, ). Promień atomowy atomu litu wynosi , kolejnego w okresie atomu, czyli berylu, wynosi . Przechodząc do podpowłoki typu p, promień atomowy boru osiąga wartość , węgla , azotu , tlenu i fluoru . Promień atomowy w okresie maleje. Od reguły tej są jednak wyjątki (zwróć uwagę, że w czasie rozważań bierzemy pod uwagę wyłącznie pierwiastki grup głównych układu okresowego i pomijamy również atomy gazów szlachetnych). Powodem, który sprawia, że atomy kolejnych pierwiastków danego okresu są coraz mniejsze, jest systematyczny wzrost ładunku jądra atomowego. Mocniej naładowane dodatnio jądro silniej przyciąga elektrony chmury elektronowej – skutkuje to przybliżeniem elektronów do jądra, a więc spadkiem wartości promienia atomowego.
Przykładowo atom litu posiada trzy protony w jądrze i trzy elektrony osadzone na dwóch powłokach. Natomiast atom berylu ma w jądrze cztery protony i cztery elektrony umieszczone na dwóch powłokach. W przypadku atomu berylu, przyciąganie elektronów przez jądro jest silniejsze niż w przypadku atomu litu, ponieważ im więcej protonów znajduje się w jądrze, tym większy ładunek jądra i tym silniej przyciągane są elektrony. Wraz ze wzrostem siły przyciągania między protonami a elektronami, promień zmniejsza się. Ten sam efekt zmniejszania się wartości promienia atomowego obserwujemy w przypadku pierwiastków trzeciego okresu.
Przeanalizuj, jak zmieniają się wartości promieni atomowych i jonowych pierwiastków bloku s i p.
Zapoznaj się z opisem ilustracji, jak zmieniają się wartości promieni atomowych i jonowych pierwiastków bloku s i p.
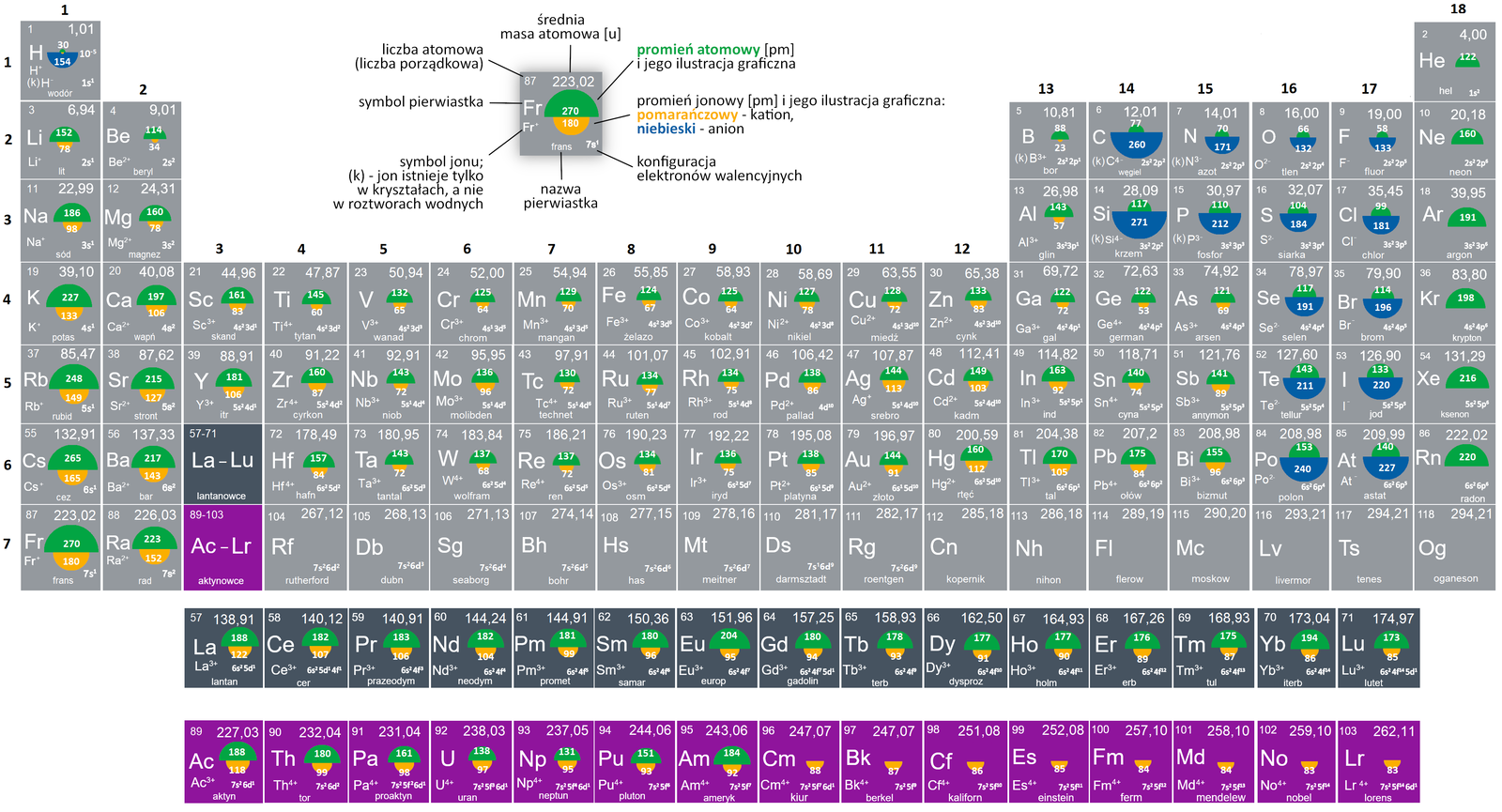
Po przeanalizowaniu zmian wartości promieni atomowych pierwiastków w pozostałych okresach, można wyciągnąć wniosek, że wartość promienia atomowego (wykluczając metale bloku d z rozważań oraz nieliczne wyjątki) maleje w okresie od grupy do . Wynika to z faktu, że każdy kolejny atom w okresie posiada o więcej protonów i elektronów od poprzedniego, w związku z czym występuje silniejsze przyciąganie między protonami a elektronami, co skutkuje zmniejszeniem promienia atomowego.
Energia jonizacji
Energia jonizacji to energia, której należy użyć, aby oderwać elektron od atomu, jonu, ale też cząsteczki. W przypadku atomów wieloelektronowych, elektrony mogą być odrywane po kolei, rozpoczynając od tego, który posiada najwyższą energię. Oznacza to, że pierwsza energia jonizacji to energia potrzebna do oderwania elektronu od obojętnego atomu (potocznie zwana często energią jonizacji z pominięciem wskazania, że jest to pierwsza energia jonizacji). Druga energia jonizacji, to energia potrzebna do oderwania elektronu od jednododatniego kationu, natomiast trzecia jest energią konieczną do oderwania elektronu od dwudodatniego kationu.
Sformułuj wniosek na temat zmian w wartościach (pierwszej) energii jonizacji dla pierwiastków drugiego okresu układu okresowego.
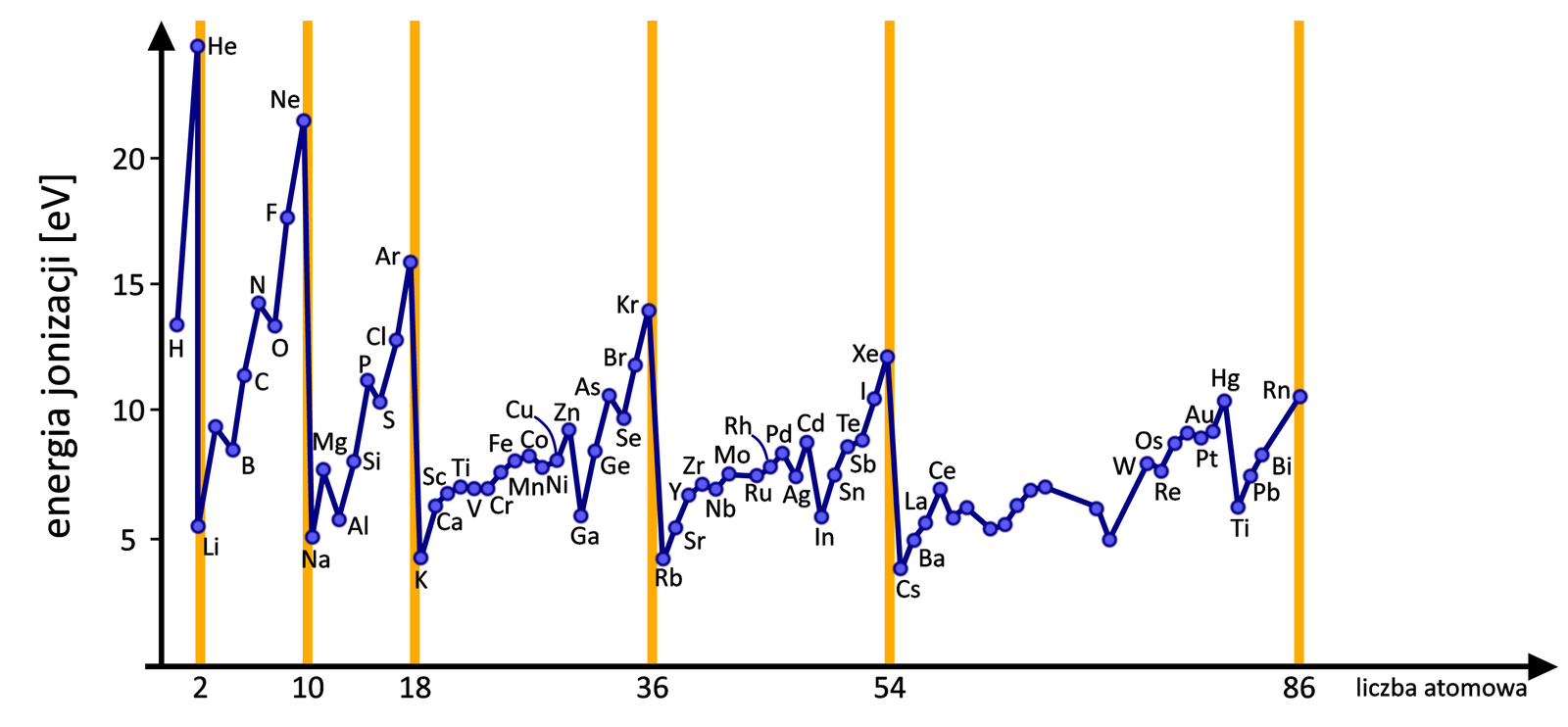
Odpowiedź
Wraz ze wzrostem liczby atomowej pierwiastków, należących do drugiego okresu układu okresowego, energia jonizacji generalnie rośnie. Widoczne są wprawdzie pewne wahania – bor wykazuje nieznacznie niższą energię jonizacji od berylu, a tlen od azotu, niemniej w grupie utrzymuje się tendencja wzrostowa. Wzrost energii jonizacji w okresie jest związany ze zmianą promienia atomowego: im bliżej jądra atomowego znajduje się elektron, tym trudniej go oderwać (bo jest silniej przyciągany), a zatem energia jonizacji jest wyższa.
Pierwszy jest atom litu – jego elektron walencyjny znajduje się na drugiej powłoce elektronowej, a promień wynosi . Energia jonizacji dla atomu litu wynosi . Oznacza to, że dla jednego atomu litu należy dostarczyć , aby oderwać jeden elektron i utworzyć jeden kationów litu:
Kolejny w okresie atom to beryl. Elektron, który oderwany zostanie od atomu, znajduje się również na drugiej powłoce (jak w przypadku litu). Ze względu na silniejsze przyciąganie między jądrem atomowym a elektronami (związane z większą ilością protonów w jądrze i większą ilością elektronów na powłoce drugiej), promień atomu berylu jest mniejszy od promienia atomu litu i wynosi . Oznacza to, że odrywany elektron jest bliżej jądra atomowego, a zatem trudniej go oderwać, ponieważ działa na niego silniejsze przyciąganie od jądra atomowego. Energia jonizacji dla atomu berylu wynosi . Oznacza to, że należy dostarczyć energii do atomu berylu, aby oderwać jeden elektron i utworzyć kation berylu:
Atom boru nieco łatwiej odda elektron niż atom berylu, ponieważ w czasie jonizacji powstaje względnie stabilna konfiguracja elektronowa – jon posiada całkowicie zamkniętą podpowłokę i pustą podpowłokę . Zapamiętaj od teraz, że zamknięcie danej powłoki jest dla atomu korzystne energetycznie.
Zwróć teraz uwagę jak przebiega proces jonizacji atomu tlenu. W czasie oderwania pierwszego elektronu jon zyskuje względnie stabilną konfigurację – powłoka zostaje połowicznie obsadzona. Teraz już wiesz, że stabilne konfiguracje elektronowe gwarantuje nie tylko całkowite zapełnienie danej podpowłoki, ale również jej połowiczne zapełnienie. Jak już wiesz, jest to również szczególnie widoczne w przypadku pierwiastków bloku d. Przypomnij sobie, że atom chromu rozmieszcza swoje elektrony walencyjne w postaci konfiguracji , a nie . Połowiczne zapełnienie podpowłoki d daje bowiem dużo większą stabliność i korzyści energetyczne niż zamknięcie podpowłoki .
Powinowactwo elektronowe
Powinowactwo elektronowePowinowactwo elektronowe to wielkość, która określa, jaka ilość energii wydzieli się na skutek przyłączenia elektronu do atomu lub cząsteczki
Zwróć uwagę, że zgodnie z definicją dodatnie powinowactwo wskazuje energię wydzieloną. Istnieją jednak atomy, dla których pierwsze powinowactwo może przyjmować wartość ujemną. Oznacza to zatem, że na skutek przyłączenia elektronu nie następuje wydzielenie energii, ale energia to zostaje pochłonięta, a więc proces przyłączenia elektronu wymaga dodania energii.
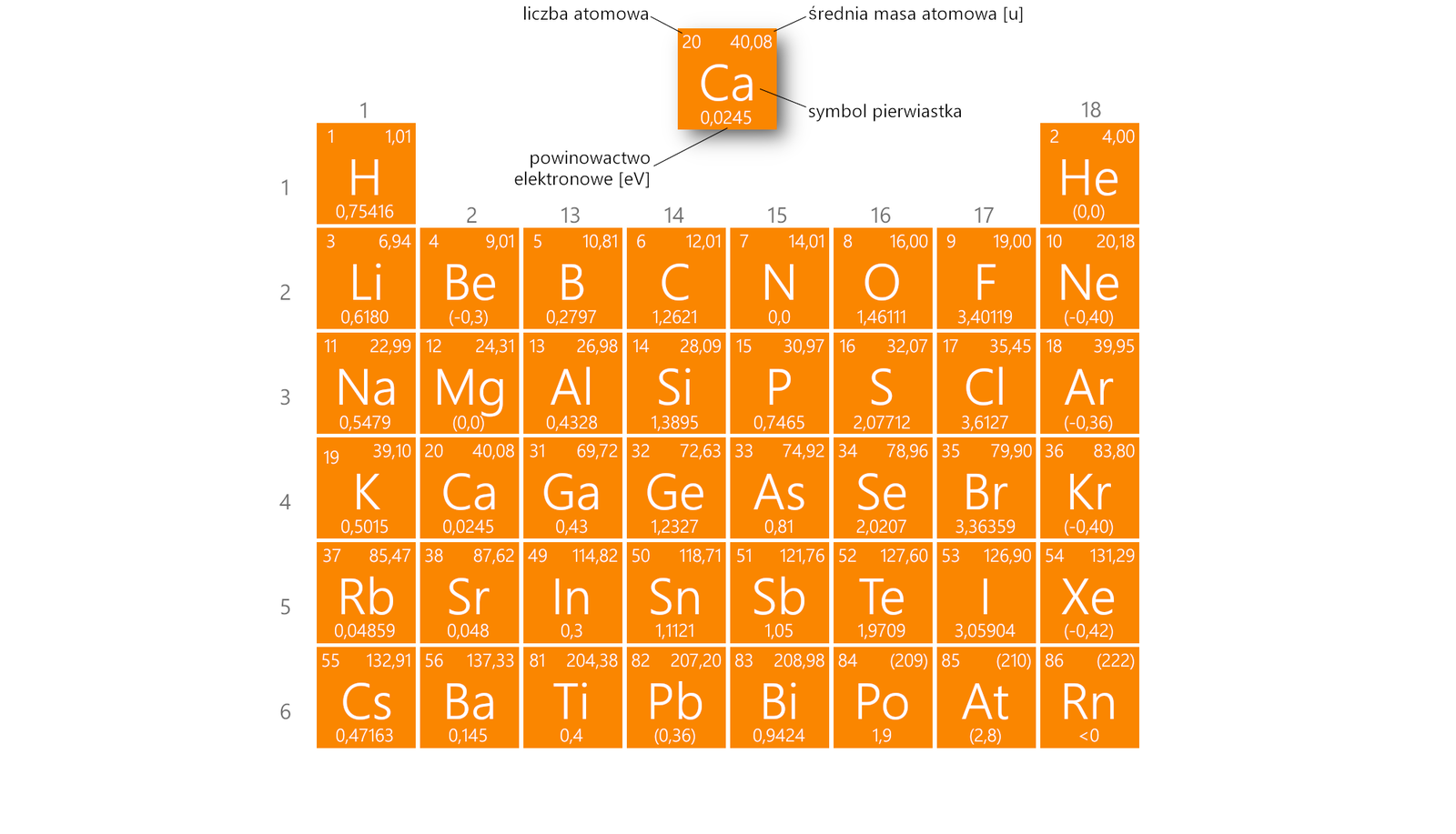
Powinowactwo wskazuje nam zatem, jak „chętnie” anionem stanie się dany atom. Im wyższa, dodatnia wartość powinowactwa, tym większa „chęć” atomu do przyłączenia elektronu. Ujemne powinowactwo spotyka się w przypadku pierwiastków, które nie potrzebują i nie chcą przyłączać elektronu.
Powinowactwa elektronowego nie zmienia się regularnie, ani w grupie, ani w okresie. Możemy wymienić prawidłowość, polegającą na tym, że w sekwencji pierwiastków , i . grupy tego samego okresu powinowactwo rośnie i przyjmuje wysokie wartości. Związane jest to z faktem, że maleje promień atomowy, a im bliżej jądra znajdować się będzie dołączony elektron, tym silniejsze przyciąganie będzie na niego działać.
Elektroujemność
Elektroujemność to zdolność do przyciągania elektronów. Przyjrzyj się poniższemu układowi okresowemu, przedstawiającemu wartości elektroujemności dla pierwiastków, a następnie zastanów się, jak zmienia się elektroujemność w okresie. Weź pod uwagę tylko pierwiastki należące do grup głównych , , od do układu okresowego.
Elektroujemność to zdolność do przyciągania elektronów. Zapoznaj się z opisem układu okresowego, przedstawiającego wartości elektroujemności dla pierwiastków, a następnie zastanów się, jak zmienia się elektroujemność w okresie. Weź pod uwagę tylko pierwiastki należące do grup głównych , , od do układu okresowego.
Elektroujemność pierwiastków rośnie w okresie, co jest konsekwencją malejącej odległości między jądrem atomowym a powłoką walencyjną, na której ma pojawić się nowy elektron. Im bliżej jądra atomowego obecna jest powłoka walencyjna, tym łatwiej umieścić na niej nowy elektron, ze względu na silniejsze przyciąganie elektrostatyczne. Jeśli powłoka walencyjna znajduje się dalej od jądra atomowego, to trudniej umieścić na niej elektron, ponieważ siły przyciągania elektrostatycznego są mniejsze.
Charakter metaliczny
Charakter metaliczny pierwiastków wiąże się ze zdolnością oddawania elektronu lub elektronów walencyjnych. Proces ten zachodzi łatwo, jeśli wymaga dostarczenia niewielkiej energii, a więc dotyczy pierwiastków charakteryzujących się niską wartością energii jonizacji. Jak już ustaliliśmy wcześniej, energia jonizacji (pomijając wyjątki) rośnie w okresie (biorąc pod uwagę tylko gtupy główne), a zatem charakter metaliczny maleje w okresie. Najsilniejsze właściwości metaliczne posiadają pierwiastki bloku s, nieco słabsze pierwiastki bloku d, natomiast najlżejsze pierwiastki bloku p to głównie niemetale.
Charakter niemetaliczny
Charakter niemetaliczny pierwiastków polega na przyłączaniu elektronów do powłoki walencyjnej. Proces ten zachodzi łatwo, jeśli w jego wyniku wydziela się dużo energii, a więc dotyczy pierwiastków charakteryzujących się wysoką wartością powinowactwa elektronowego. Najwyższe wartości powinowactwa elektronowego posiadają pierwiastki grupy. Charakter niemetaliczny rośnie zatem w stronę prawą w okresie, a więc ze wzrostem liczby atomowej.
Słownik
liczba określająca wielkość atomu
(pierwsza) energia potrzebna do oderwania najsłabiej związanego elektronu od obojętnego atomu lub cząsteczki
wielkość określająca zdolność atomu lub cząsteczki do przyłączania elektronu z utworzeniem jonu ujemnego
zdolność do przyciągania elektronów
Bibliografia
Encyklopedia PWN
Pazdro K., Rola – Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2014.