Przeczytaj
Szereg aktywności metali
Szereg aktywności metali jest to zestawienie pierwiastków, będących metalami, w kolejności od najbardziej do najmniej aktywnego metalu. Im metal bardziej aktywny chemicznie, tym położony jest bardziej na początku szeregu aktywności metali (z lewej strony).
Problem badawczy:
Który metal jest bardziej aktywny chemicznie: cynk czy miedź?
Hipoteza:
Przykładowe hipotezy
Cynk jest aktywniejszym metalem niż miedź.
Miedź jest aktywniejszym metalem niż cynk.
Sprzęt i odczynniki:
probówki, papier ścierny
wodny roztwór siarczanu(VI) cynku, wodny roztwór siarczanu(VI) miedzi(II), blaszka cynkowa, blaszka miedziana.
Wykonanie:
W pierwszej probówce umieść 3 wodnego roztworu siarczanu(VI) miedzi(II), a w drugiej 3 wodnego roztworu siarczanu(VI) cynku.
Blaszki, cynkową i miedzianą, oczyść (przetrzyj) papierem ściernym.
W pierwszej probówce umieść blaszkę cynkową, a w drugiej miedzianą.
Obserwuj zmiany.
Schemat doświadczenia:
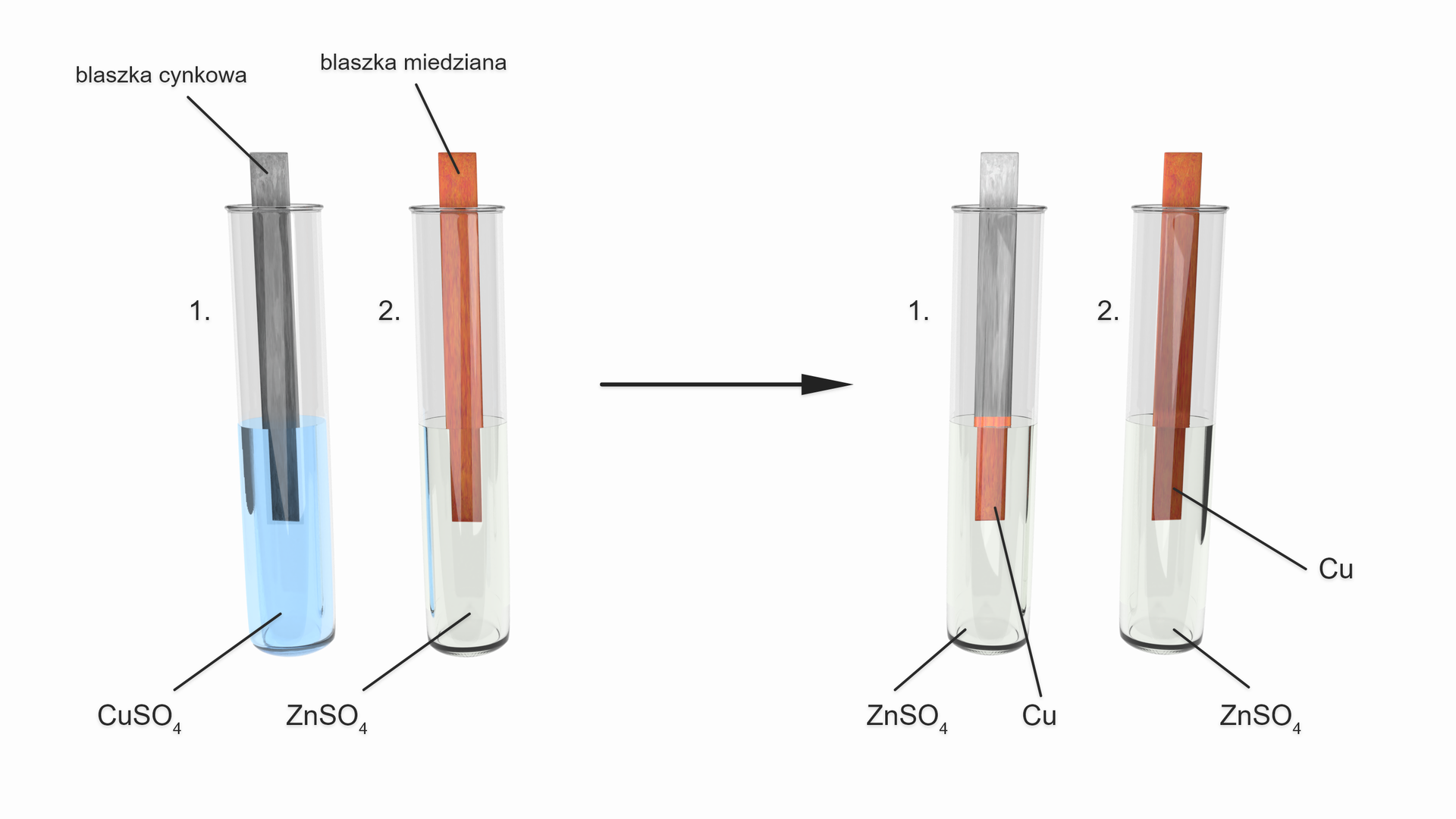
Obserwacje:
W probówce pierwszej blaszka pokrywa się różowym nalotem, a roztwór zmienia barwę z niebieskiej na bezbarwną. W probówce drugiej nie obserwuje się żadnych zmian.
Równania reakcji chemicznych:

Im bardziej na początku (z lewej strony) w szeregu aktywności znajduje się dany metal, tym jest bardziej aktywny chemicznie, łatwiej się utlenia, czyli jest silniejszym reduktoremreduktorem.
Im bardziej na końcu (z prawej strony) w szeregu aktywności znajduje się dany metal, tym jest mniej aktywny chemicznie, łatwiej się redukuje, czyli jest silniejszym utleniaczemutleniaczem.
W szeregu aktywności metali występuje wodór, który zaliczany jest do niemetali.
Jaką rolę odgrywa wodór w szeregu aktywności metali?
Wodór dzieli szereg aktywności metali na dwie części. Metale, znajdujące się w jednej części, mogą wypierać wodór z kwasów, natomiast metale, znajdujące się w drugiej części, nie mają takich właściwości. Zastanówmy się, o które metale chodzi? Które metale będą wypierały wodór z kwasów?
Problem badawczy:
Które metale wypierają wodór z kwasów?
Hipoteza:
Przykładowe hipotezy
Metale, znajdujące się w szeregu aktywności metali przed wodorem, wypierają go z kwasów.
Metale, znajdujące się w szeregu aktywności metali za wodorem, wypierają go z kwasów.
Sprzęt i odczynniki:
probówki, palące się łuczywko;
wodny roztwór kwasu chlorowodorowego, rozcieńczony wodny roztwór kwasu siarkowego(VI), oczyszczona wstążka magnezowa, oczyszczone: drucik cynkowy, drucik żelazny, drucik niklowy, drucik miedziany.
Wykonanie:
W probówkach od 1 do 5 umieść 3 kwasu chlorowodorowego, a w probówkach od 6 do 10 umieść 3 rozcieńczonego kwasu siarkowego(VI).
W probówkach 1 i 6 umieść wstążki magnezowe, 2 i 7 - drucik cynkowy, 3 i 8 -drucik żelazny, 4 i 9 - drucik niklowy, a w probówkach 5 i 10 - drucik miedziany.
Obserwuj zmiany.
Do każdej probówki przyłóż zapalone łuczywko.
Schemat doświadczenia:

Obserwacje:
W probówkach, zawierających kwasy, wstążki magnezowe oraz druciki cynkowe żelaza i niklu wydzielają pęcherzyki gazu. Najbardziej intensywne wydzielanie gazu występuje w probówkach zawierających wstążki magnezowe (1 i 6). Następnie wydziela się coraz mniej pęcherzyków gazu kolejno od probówek z cynkiem, żelazem i niklem. W probówkach, zawierających miedź, nie są widoczne żadne zmiany. Po przyłożeniu palącego się łuczywka do probówek, w których wydziela się gaz, słychać charakterystyczny dźwięk.
Równania reakcji chemicznych:
reakcja nie zachodzi
reakcja nie zachodzi
Podsumowanie doświadczenia:
Magnez, cynk, żelazo i nikiel reagują z kwasem chlorowodorowym oraz rozcieńczonym kwasem siarkowym(VI). Metale te wypierają wodór z kwasu i powstaje sól oraz wodór. Po przyłożeniu palącego się łuczywka do wylotu probówek, słychać charakterystyczny dźwięk. Dźwięk ten spowodowany jest reakcją wodoru z tlenem. Im intensywniejsze wydzielanie pęcherzyków gazu, tym aktywniejszy metal. Oznacza to, że najbardziej aktywnym pierwiastkiem jest magnez, następnie cynk, żelazo i nikiel.
W probówce z miedzią nie zaobserwowano wydzielania się gazu. Oznacza to, że miedź nie wypiera wodoru z kwasu chlorowodorowego oraz rozcieńczonego kwasu siarkowego(VI). Ponadto miedź jest najmniej aktywna chemicznie z metali zastosowanych w doświadczeniu.
Metale, znajdujące się w szeregu aktywności metali przed wodorem, wypierają go z kwasów. Noszą nazwę metali nieszlachetnych. Metale, znajdujące się za wodorem, nie wypierają go z kwasów. Nazywane są metalami szlachetnymi.

Słownik
inaczej nazywana reakcją utleniania‑redukcji; reakcja chemiczna, w trakcie której dochodzi do zmiany stopnia utlenienia pierwiastków po stronie substratów i produktów
(łac. reductio „zmniejszenie”) przyjmowanie elektronów przez jony lub atomy pierwiastków, w wyniku czego dochodzi do obniżenia stopnia utlenienia
pierwiastek podwyższający swój stopień utlenienia (utleniający się)
pojęcie umowne, które określa ładunek danego pierwiastka chemicznego
to pierwiastek obniżający swój stopień utlenienia (redukujący się)
oddawanie elektronów przez jony lub atomy pierwiastków, w wyniku czego dochodzi do podwyższenia stopnia utlenienia
Bibliografia
Jelińska‑Kazimierczuk M., Megiel E., Teraz matura. Chemia. Vademecum, Warszawa 2018.
Litwin M., Styska‑Wlazło S., Szymońska J., To jest chemia 1. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2012.
