Przeczytaj
Charakterystyka tlenu
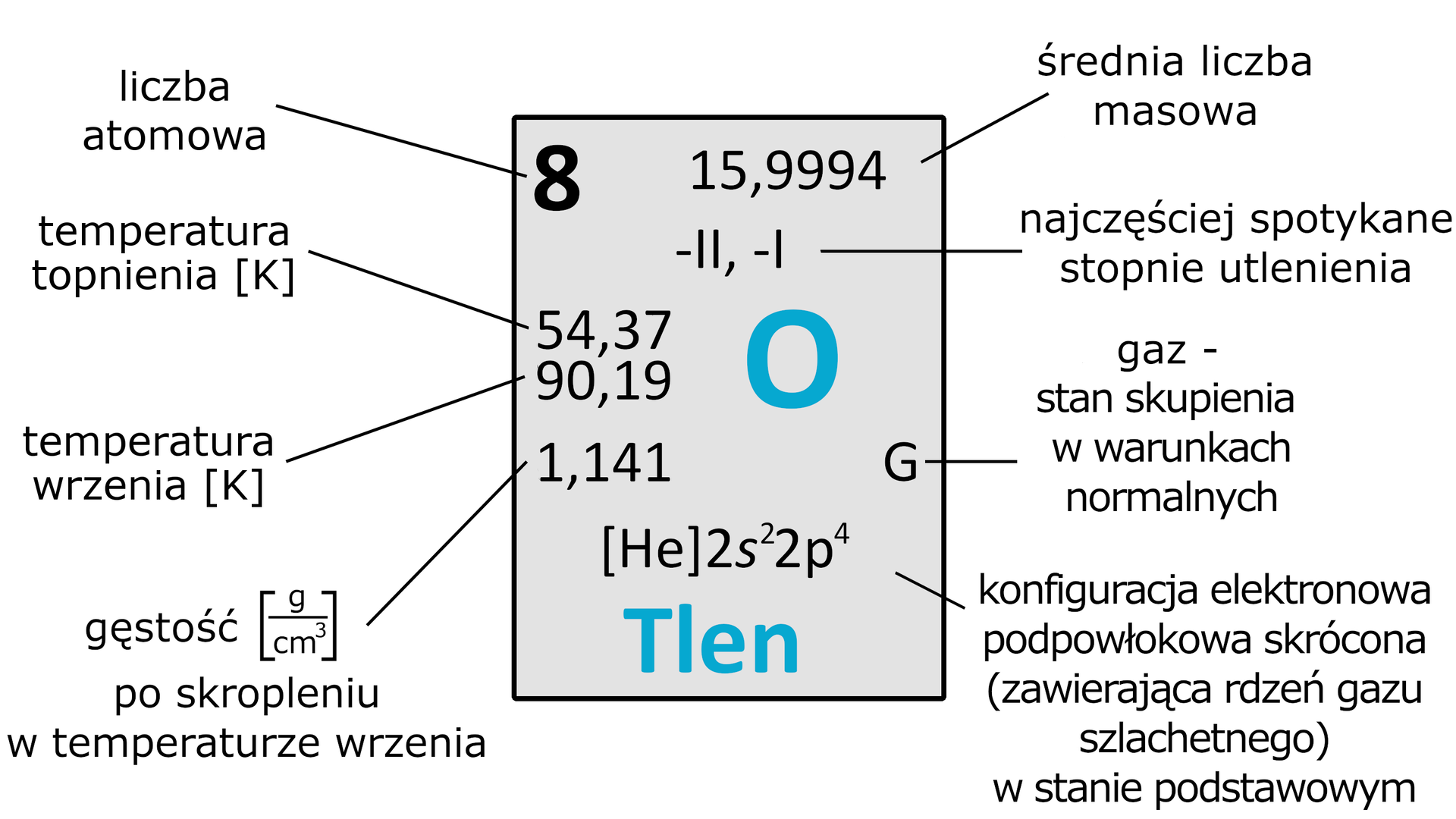
Tlen jest niemetalem, który znajduje się w grupie układu okresowego jako pierwszy przedstawiciel grupy tlenowców. W warunkach standardowych (wg. IUPACIUPAC , ) jest bezwonnym i bezbarwnym gazem. Stanowi zwykle ok. objętości powietrza i jest niezbędny do prawidłowego funkcjonowania większości organizmów żywych. Ponadto ma bardzo niską temperaturę topnienia i wrzenia – wynoszą one odpowiednio: i ( i ). To właśnie ze względu na niską temperaturę wrzenia, przez wiele lat tak problematyczne było skroplenie tlenu.
Przyjęto, że tlen został odkryty w roku przez Carla Scheelego, metodą prażenia tlenku rtęci(). Jednak odkrycie to nie zostało opublikowane do roku, dlatego przez dwa lata za odkrywcę uważano Josepha Priestleya, który marca roku ogłosił swoje odkrycie w towarzystwie naukowym Royal Society.
Alotropia tlenu
Tlen występuje w trzech odmianach alotropowych i jest to jedyny przykład alotropiialotropii w stanie gazowym.
Ditlen – cząsteczka dwuatomowa. Ditlen jest bezbarwnym i bezwonnym gazem, którego gęstość jest większa od gęstości powietrza.
Ozon – trójatomowa cząsteczka. W stanie gazowym jest bezbarwny lub ma niebieskawą barwę oraz zapach przypominający woń powietrza po burzy. Jest on bardzo silnym utleniaczem i bardzo reaktywnym alotropem tlenu.
Tetratlen – czteroatomowa cząsteczka. Tetratlen jest bardzo nietrwałą cząsteczką – rozpada się, tworząc dwie cząsteczki dwuatomowego tlenu (). Dowód na istnienie tetratlenu zdobyto dopiero poprzez zastosowanie wysokiego ciśnienia rzędu na . Wówczas ditlen ma tendencję do występowania w postaci czteroatomowych cząsteczek. Tetratlen ma jasnoczerwoną barwę.
Ciekły tlen

Ciekły tlen jest cieczą o gęstości (ok. ), o charakterystycznym bladoniebieskim zabarwieniu. Znajduje szereg zastosowań jako utleniacz, np. paliwa rakietowego.
Diagram fazowy tlenu
Poniżej przedstawiono diagram fazowy tlenu – wykres przedstawiający warunki (ciśnienie i temperaturę), w których badana substancja występuje w danym stanie skupienia. Obrazuje także, że temperatura wrzenia cieczy zależy od ciśnienia.
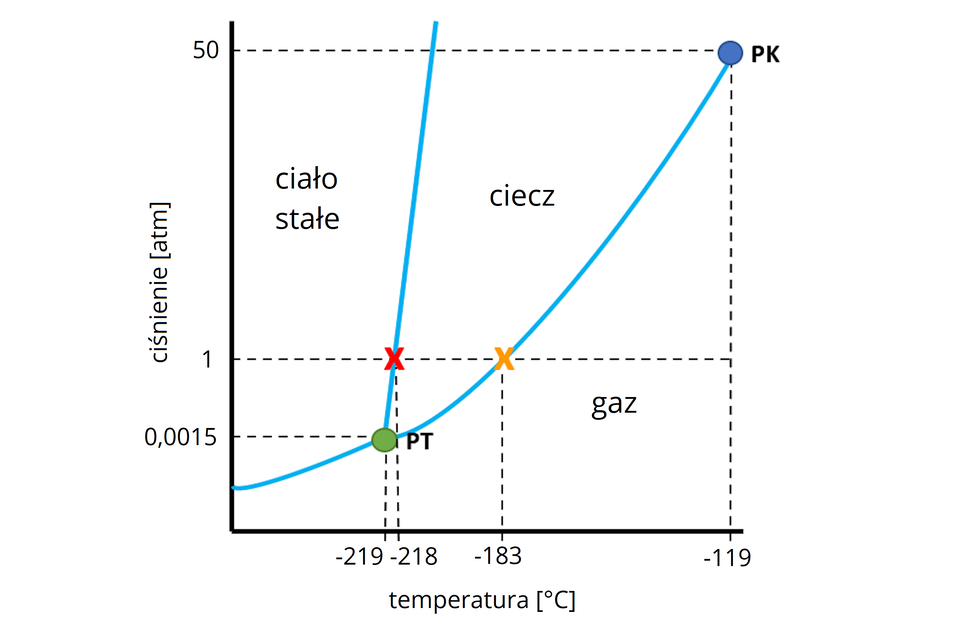
PK to tzw. punkt krytyczny – punkt końcowy krzywej współistnienia cieczy i pary. PT to punkt potrójny, opisuje warunki, w których substancja współistnieje w trzech stanach skupienia (stałym, ciekłym i gazowym).
Otrzymywanie tlenu z powietrza
kwietnia roku dwójka polskich uczonych – Karol Olszewski i Zygmunt Wróblewski – jako pierwsi na świecie skraplają tlen. Wykorzystali do tego metodę kaskadową. Polega ona na wykorzystaniu wrzących, pod zmniejszonym ciśnieniem, gazów, które obniżają temperaturę układu, pozwalając przy tym na skroplenie kolejnych substancji w niższych temperaturach.
Olszewski i Wróblewski skonstruowali odpowiednią aparaturę, która pozwoliła na skroplenie tlenu.
a – butla z ciekłym etylenem (etenem), b – zbiornik z mieszaniną Thiloriera, c – termometr wodorowy, d – szklany zbiornik z ciekłym etylenem, e – grubościenna ampuła szklana, w której skrapla się gaz, f – stalowa butla z gazowym tlenem ()
Gazowy tlen, wypuszczany ze stalowej butli (f) pod wysokim ciśnieniem trafia do grubościennej rurki (e). Tam kosztem swojej energii wewnętrznej, rozpręża się, obniżając swoją temperaturę. Kolejnym etapem jest tłoczenie tlenu w dół pod dużym ciśnieniem, w efekcie czego rozpręża się on ponownie do ciśnienia (). Oziębiony gaz zaczyna się skraplać w rurce.
Taka przemiana nazywana jest rozprężaniem adiabatycznymadiabatycznym. Korzystając z niej, Olszewskiemu i Wróblewskiemu jako pierwszym na świecie udało się skroplić tlen. Kilka dni później skroplili kolejny składnik powietrza – azot.
W dzisiejszych czasach ciekły tlen pozyskiwany jest z powietrza, którego jest w nim około . Proces ten odbywa się w specjalnych kolumnach.

Opis metody przemysłowego otrzymywania ciekłego tlenu i ciekłego azotu
W pierwszym etapie powietrze jest filtrowane z kurzu oraz innych stałych zanieczyszczeń. Ponadto z powietrza usuwane są inne niepożądane składniki występujące w nim w niewielkich ilościach, takie jak węglowodory czy tlenki azotu.
Następnie powietrze jest sprężane. W tym etapie woda, obecna w powietrzu jako para wodna, jest skraplana w odpowiednich chłodnicach.
Dalej sprężone powietrze jest przepuszczane przez sita molekularne, które wychwytują pozostałości pary wodnej oraz tlenku węgla().
Oczyszczone powietrze zaczyna się skraplać na dno kolumny. Powstała mieszanina charakteryzuje się dużą zawartością ciekłego tlenu (około ). Innymi składnikami mieszaniny jest argon oraz azot. U szczytu kolumny znajduje się mieszanina gazów – głównie azotu, ale także argonu. Mieszanina ta jest następnie destylowana do czystego azotu.
Otrzymane w ten sposób gazy są odpowiednio przechowywane i, w zależności od przeznaczenia, pakowane do butli lub pompowane do cysterny izolowanej termicznie.
Słownik
Międzynarodowa Unia Chemii Czystej i Stosowanej; organizacja zajmująca się standaryzacją symboliki, nazewnictwa i wzorców stosowanych w chemii
stały tlenek węgla(), sublimujący w temperaturze oraz wykorzystywany do chłodzenia
przemiana termodynamiczna, w której w izolowanym układzie nie dochodzi do wymiany ciepła z otoczeniem, a całość energii jest dostarczana lub odbierana z niego jako praca
(gr. állos „obcy, inny”, trópos „sposób, postać”) występowanie tego samego pierwiastka chemicznego w dwóch lub więcej odmianach, znajdujących się w tym samym stanie skupienia
Bibliografia
Encyklopedia PWN
Pigoń K., Ruziewicz Z., Chemia fizyczna, cz. 1, Warszawa 1986.