Przeczytaj
Substytucja elektrofilowa w benzenie
Pierścień aromatyczny benzenu posiada zdelokalizowaną chmurę elektronów i ze względu na obecność sześciu elektronów pi w cyklicznym, sprzężonym układzie, charakteryzuje się znaczną gęstością elektronową. Jest więc donorem (dawcą) elektronów dla czynników elektrofilowych, które mają ich niedomiar. Można zatem stwierdzić, że benzen, ze względu na swoją budowę, łatwo ulega reakcjom podstawienia elektrofilowego.
Na poniższym schemacie reakcji substytucji elektrofilowejsubstytucji elektrofilowej, czynnik elektrofilowy (elektrofilelektrofil), oznaczony schematycznie jako , zostaje podstawiony za jeden z dowolnych atomów wodoru.
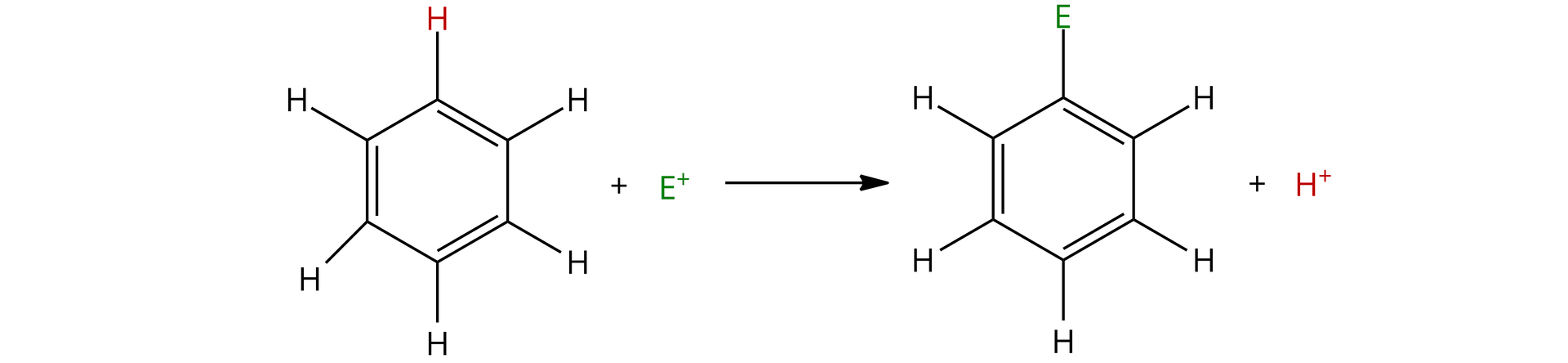
Tego typu podstawienie jest możliwe, ponieważ pierścień aromatyczny benzenu, dzięki dużej gęstości elektronowej, pełni w tej reakcji funkcję nukleofilanukleofila.
Do reakcji substytucji elektrofilowej należą reakcje nitrowania, halogenowania (bromowania, chlorowania), alkilowania, acylowania czy sulfonowania. Najważniejsze reakcje substytucji elektrofilowej dla benzenu zostały schematycznie przedstawione na poniższym rysunku.
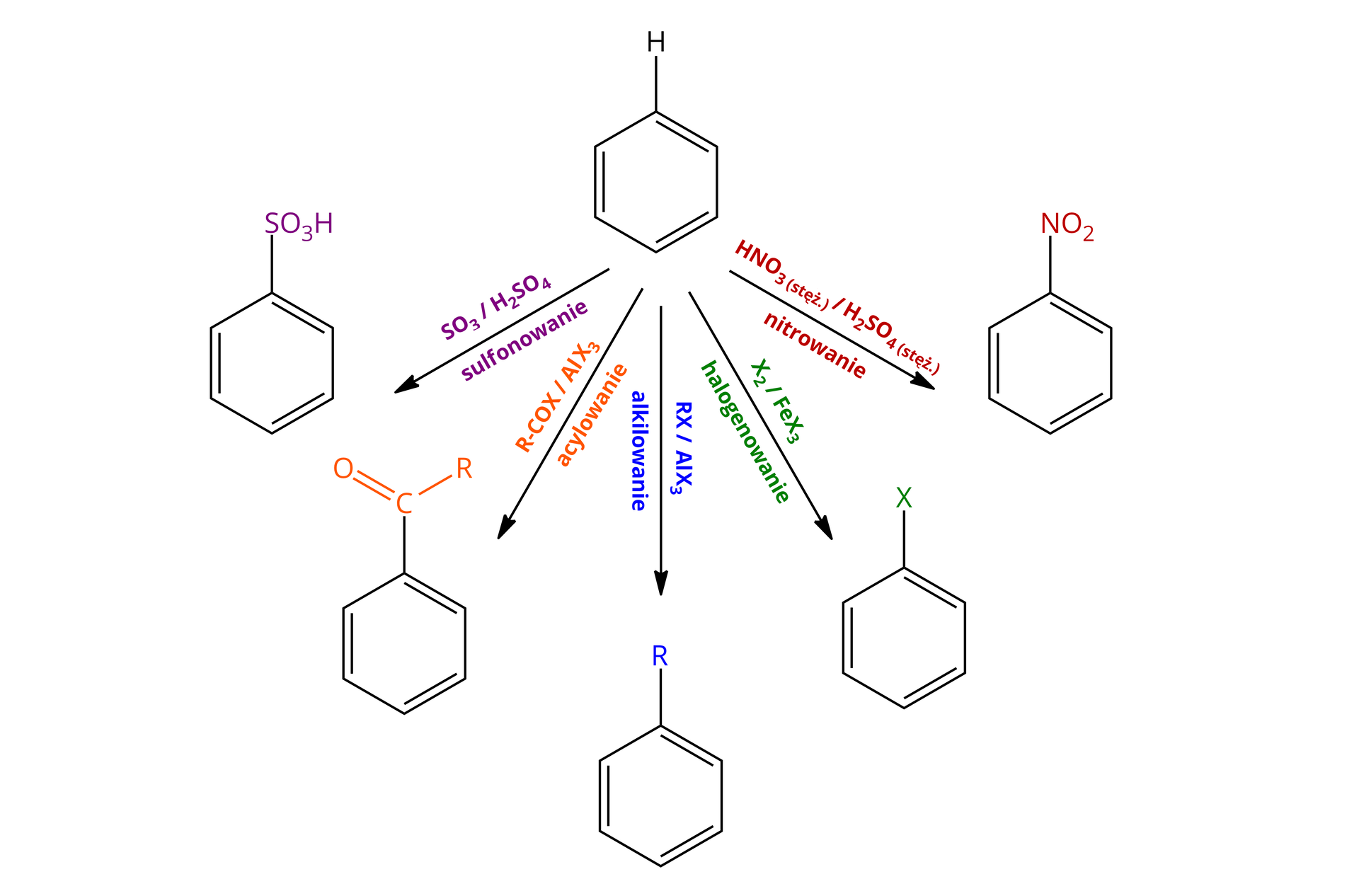
Wszystkie wymienione reakcje zachodzą wg podobnego mechanizmu. Poniżej przedstawiono szczegółowy mechanizm każdej z reakcji podstawienia benzenu.
Nitrowanie
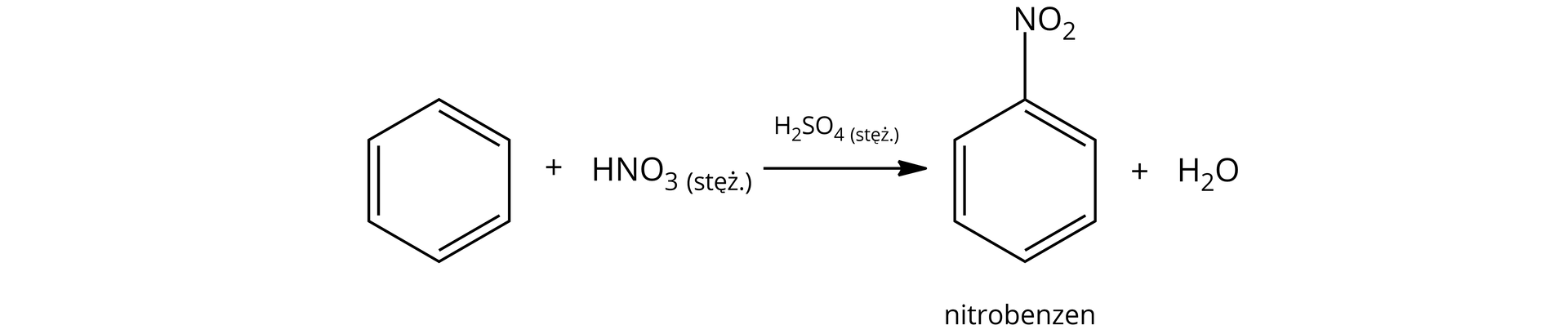
Reakcja nitrowania benzenunitrowania benzenu polega na podstawieniu za atom wodoru grupy nitrowej (). Reakcja ta zachodzi tylko w obecności mieszaniny nitrującej, czyli stężonych kwasów: azotowego(V) oraz siarkowego(VI), przy czym ten ostatni jest katalizatoremkatalizatorem reakcji.
W pierwszym etapie następuje reakcja pomiędzy stężonymi kwasami. Proton zostaje przeniesiony z kwasu siarkowego(VI) na kwas azotowy(V). Powstaje wówczas protonowany kwas azotowy(V) oraz anion wodorosiarczanowy(VI) (1). Następnie protonowany kwas traci wodę, tworząc odczynnik elektrofilowy w postaci kationu nitroniowego () (2). Elektrofil atakuje pierścień aromatyczny, wytwarzając cykliczny karbokation – nietrwały produkt pośredni (3). Indywiduum to występuje w trzech strukturach rezonansowych, ze względu na tworzony przez benzen sprzężony układ wiązań. Następnie karbokation traci proton w wyniku oddziaływania z cząsteczką wody i powstaje obojętny produkt – nitrobenzen oraz kation oksoniowy (4). W wyniku reakcji, utworzonego w pierwszym etapie anionu wodorosiarczanowego(VI) z jonem oksoniowym, następuje odtworzenie katalizatora w postaci kwasu siarkowego(VI) oraz utworzenie cząsteczki wody jako produktu ubocznego (5).
Reakcję tę można zapisać sumarycznie w następujący sposób:
Halogenowanie
Do reakcji halogenowaniahalogenowania zalicza się m.in. bromowanie oraz chlorowanie, czyli podstawienie za atom wodoru atomu bromu lub chloru. Poniżej przedstawiono mechanizm halogenowania na przykładzie bromowania.
Bromowanie benzenu wymaga użycia katalizatora. Jest nim np. lub . W pierwszym etapie następuje reakcja pomiędzy bromkiem żelaza(III) a cząsteczką bromu, prowadząca do polaryzacji wiązania i powstania czynnika elektrofilowego w postaci oraz kompleksu (1). Czynnik elektrofilowy w kolejnym etapie atakuje pierścień aromatyczny, prowadząc do powstania cyklicznego karbokationu (2), czyli nietrwałego związku przejściowego, występującego w trzech strukturach rezonansowychstrukturach rezonansowych. Pośredni karbokation traci następnie proton w wyniku oddziaływania z kompleksem (3). Wówczas elektrony z wiązania odtwarzają układ aromatyczny utworzonej cząsteczki bromobenzenu. Jednocześnie następuje odtworzenie katalizatora oraz utworzenie produktu ubocznego w wyniku reakcji kompleksu z kationem wodoru.
Reakcję tę można zapisać sumarycznie w następujący sposób:

Alkilowanie
Reakcja alkilowania benzenualkilowania benzenu to reakcja podstawienia za atom wodoru dowolnej grupy alkilowej, czyli jednowartościowej grupy, utworzonej przez oderwanie atomu wodoru od alkanu. Reakcja ta nazwana została alkilowaniem Friedla Craftsa, od nazwisk odkrywców tej najbardziej użytecznej ze wszystkich substytucji elektrofilowych reakcji podstawienia benzenu. Katalizatorem reakcji alkilowania jest , reagujący z dowolnym halogenkiem alkilu. Dla przykładu, w poniższym mechanizmie, jako halogenku alkilu, użyto chlorometanu.
W pierwszym etapie następuje reakcja pomiędzy katalizatorem a chlorometanem. Chlorek glinu ułatwia jonizację chlorometanu i analogicznie, jak w przypadku halogenowania, przez oderwanie anionu chlorkowego tworzy się czynnik elektrofilowy w postaci (będący jednocześnie karbokationem alkilowym) oraz kompleks (1). Karbokation atakuje parę elektronową z pierścienia aromatycznego, tworząc wiązanie , prowadząc do nietrwałego, pośredniego i cyklicznego karbokationu, występującego w trzech strukturach rezonansowych (2). Związek ten traci następnie proton w wyniku oddziaływania z kompleksem (3). Wówczas elektrony z wiązania odtwarzają układ aromatyczny utworzonej cząsteczki metylobenzenu (toluenu). Jednocześnie następuje odtworzenie katalizatora oraz utworzenie produktu ubocznego , w wyniku reakcji kompleksu z kationem wodoru
Reakcję tę można zapisać sumarycznie w następujący sposób:

Acylowanie
Mechanizm reakcji acylowania jest podobny do mechanizmu alkilowania Friedla Craftsa i również nazwany, od nazwisk odkrywców, acylowaniemacylowaniem Friedla Craftsa. Reakcja katalizowana jest analogicznie chlorkiem glinu, z tą różnicą, że reagentem nie jest halogenek alkilu, a halogenek kwasu karboksylowego – najczęściej chlorek kwasowy. Dzięki temu do pierścienia można wprowadzić grupę acylową, czyli , otrzymując odpowiedni keton. Dla przykładu, w poniższym mechanizmie, jako halogenku kwasowego, użyto chlorku acetylu (chlorku kwasu octowego).
W pierwszym etapie następuje reakcja pomiędzy katalizatorem a chlorkiem acetylu. Tworzy się wówczas czynnik elektrofilowy w postaci (kationu acyliowego) oraz kompleks (1). Elektrofil atakuje parę elektronową z pierścienia aromatycznego, tworząc wiązanie i dając nietrwały, pośredni i cykliczny karbokation, który występuje w trzech strukturach rezonansowych (2). Związek ten traci następnie proton, w wyniku oddziaływania kompleksu (3). Wówczas elektrony z wiązania odtwarzają układ aromatyczny utworzonej cząsteczki ketonu: 1‑fenyloetan‑1-onu. Jednocześnie następuje odtworzenie katalizatora AlClIndeks dolny 33 oraz utworzenie produktu ubocznego w wyniku reakcji kompleksu z kationem wodoru.
Reakcję tę można zapisać sumarycznie w następujący sposób:

Sulfonowanie
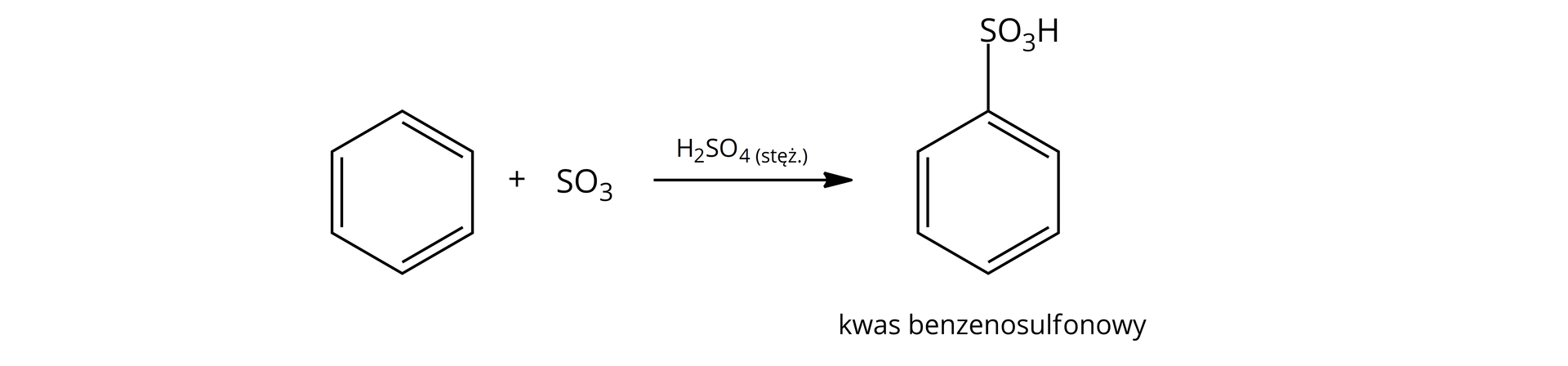
Benzen ulega reakcji sulfonowaniasulfonowania, polegającej na podstawieniu za atom wodoru grupy sulfonowej w reakcji m. in. z **mieszaniną i , czyli tzw. dymiącym kwasem siarkowym(VI). W pierwszym etapie następuje reakcja pomiędzy składnikami mieszaniny. Tlenek siarki(VI) zostaje uprotonowany, tworząc elektrofil . Jednocześnie cząsteczka kwasu siarkowego(VI) ulega deprotonacji, wytwarzając anion wodorosiarczanowy(VI) (1). W kolejnym etapie następuje atak elektrofila na pierścień aromatyczny, prowadząc do nietrwałego i cyklicznego karbokationu, tworzącego trzy struktury rezonansowe (2). Karbokation w kolejnym etapie traci proton w wyniku reakcji z anionem wodorosiarczanowym(VI), dając główny produkt – kwas benzenosulfonowy – oraz odtwarzając katalizator w postaci kwasu siarkowego(VI) (3).
Reakcję tę sumarycznie zapisuje się najczęściej w następujący sposób:
Słownik
reakcja substytucji (podstawienia), w której czynnikiem atakującym jest elektrofil
indywiduum chemiczne obdarzone ładunkiem dodatnim (w reakcji bromowania jest to , w reakcji nitrowania , w reakcji chlorowania , w reakcji metylowania itd.)
indywiduum chemiczne obdarzone ładunkiem ujemnym (np. , , ) lub cząsteczka obojętna, posiadająca wolne pary elektronowe (np. , , )
struktury związków chemicznych i innych indywiduów chemicznych przedstawione za pomocą tzw. struktur granicznych. Faktyczna struktura cząsteczki jest opisywana przez kombinację liniową tych struktur
substancja chemiczna, którą dodaje się do układu w celu zwiększenia szybkości reakcji chemicznej; katalizator nie zużywa się podczas trwania reakcji. W przypadku substytucji elektrofilowej jest czynnikiem niezbędnym do utworzenia elektrofilu
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu grupy nitrowej do cząsteczki benzenu w wyniku podstawienia atomu wodoru
reakcja substytucji elektrofilowej, polegająca na wprowadzaniu atomu fluorowca (najczęściej lub ) do cząsteczki benzenu w wyniku podstawienia atomu wodoru
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu do cząsteczki benzenu grupy sulfonowej w wyniku podstawienia atomu wodoru
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu do cząsteczki benzenu grupy alkilowej w wyniku podstawienia atomu wodoru
reakcja substytucji elektrofilowej, polegająca na wprowadzeniu do cząsteczki benzenu grupy alkilowej w wyniku podstawienia atomu wodoru
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
McMurry J., Chemia organiczna, Warszawa 2000.