Przeczytaj
Jak odróżnić alkohole monohydroksylowe od alkoholi polihydroksylowych?
Przypomnijmy sobie, jakim reakcjom ulegają alkohole monohydroksylowealkohole monohydroksylowe i alkohole polihydroksylowealkohole polihydroksylowe.
alkohole monohydroksylowe | alkohole polihydroksylowe | |
|---|---|---|
dysocjacja elektrolitycznadysocjacja elektrolityczna | nie | nie |
przewodnictwo wodnego roztworu | nie | nie |
odczyn wodnego roztworu | obojętny | obojętny |
reakcja z metalem aktywnym | tak | tak |
reakcja z zasadą | nie | nie |
reakcja dehydratacji | tak | tak |
reakcja utlenienia | tak | tak |
reakcja z fluorowcowodorem | tak | tak |
reakcja estryfikacjiestryfikacji | tak | tak |
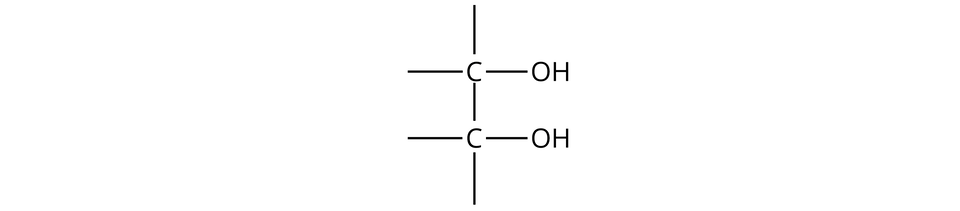
Istnieje jednak reakcja pozwalająca na odróżnienie alkoholi monohydroksylowych od alkoholi polihydroksylowych, które posiadają przynajmniej dwie grupy hydroksylowe przy sąsiadujących atomach węgla – jest to reakcja ze świeżo strąconym wodorotlenkiem miedzi.
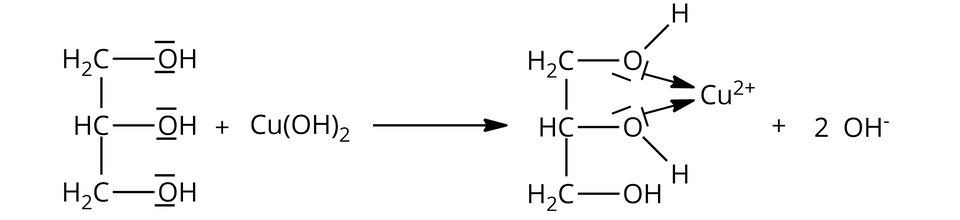
Charakterystyczny fragment budowy cząsteczek alkoholi polihydroksylowych ulegających wspomnianej reakcji chemicznej:
W celu odróżnienia alkoholu monohydroksylowego od alkoholu polihydroksylowego posiadającego przynajmniej dwie grupy hydroksylowe przy sąsiadujących atomach węgla, należy przeprowadzić poniżej opisane doświadczenie chemiczne.
Wykonanie:
Do dwóch probówek z roztworem siarczanu miedzi należy dodać wodny roztwór wodorotlenku sodu.
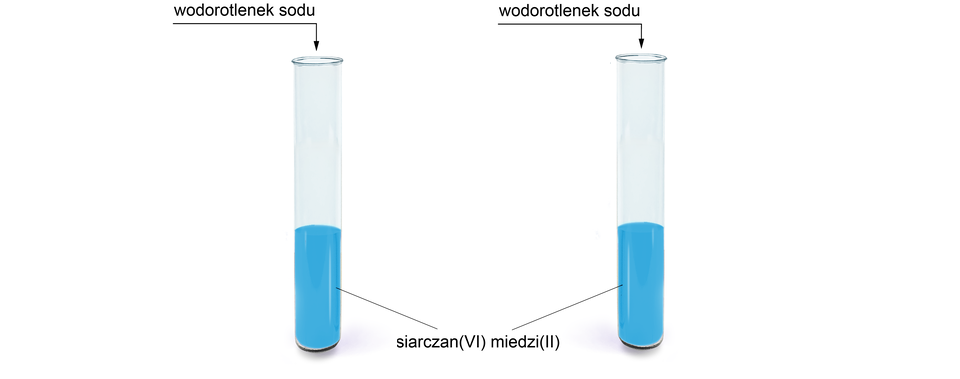
W wyniku zachodzącej reakcji chemicznej powstaje wodorotlenek miedzi, będący niebieską, galaretowatą zawiesiną.
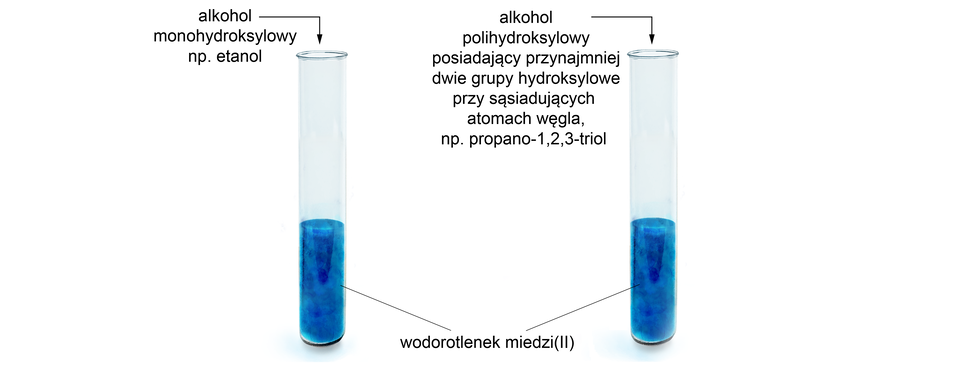
Do pierwszej probówki z otrzymanym wodorotlenkiem miedzi należy wprowadzić alkohol monohydroksylowy (np. etanol), do drugiej alkohol polihydroksylowy, posiadający przynajmniej dwie grupy hydroksylowe przy sąsiadujących atomach węgla (np. propano-,,-triol).
Obserwacje:
W probówce z alkoholem monohydroksylowym (np. etanolem) zaobserwowano brak objawów reakcji.
W probówce z alkoholem polihydroksylowym posiadającym przynajmniej dwie grupy hydroksylowe przy sąsiadujących atomach węgla (np. propano-,,-triolem), niebieska, galaretowata zawiesina roztworzyła się, a roztwór zabarwił się na szafirowo.

Wnioski:
Reakcja alkoholu monohydroksylowego (np. etanolu) z wodorotlenkiem miedzi nie zachodzi.
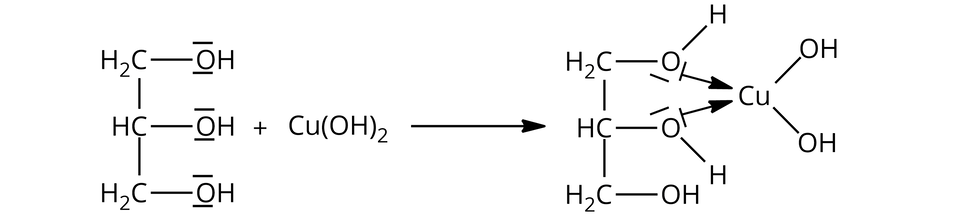
Alkohol polihydroksylowy, zawierający przynajmniej dwie grupy hydroksylowe przy sąsiadujących atomach węgla (np. propano-,,-triol), reaguje z wodorotlenkiem miedzi, w wyniku czego powstaje rozpuszczalny związek kompleksowy o szafirowym zabarwieniu (np. glicerolan miedzi).
Równania reakcji:
Słownik
alkohol zawierający jedną grupę hydroksylową
alkohol zawierający kilka grup hydroksylowych
(łac. dissociatio „rozdzielenie”) samorzutny proces rozpadu cząsteczek elektrolitów w roztworach na dodatnio i ujemnie naładowane cząstki, tj. kationy i aniony
reakcja otrzymywania estru z alkoholu lub fenolu, a także kwasu karboksylowego lub nieorganicznego
Bibliografia
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2, Warszawa 2016.