Wirtualne laboratorium – I
Przeprowadź doświadczenie w laboratorium chemicznym. Rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz swoje obserwacje i wyniki, a następnie sformułuj wnioski.
Szafa laboratoryjna
Analiza doświadczenia: Odróżnianie alkoholu monohydroksylowego od polihydroksylowego.
Problem badawczy: W jaki sposób można odróżnić alkohol monohydroksylowy od polihydroksylowego?
Hipoteza: Za pomocą próby Trommera można odróżnić alkohol monohydroksylowy od polihydroksylowego.
Odczynniki chemiczne: gliceryna (propano-,,-triol), siarczan miedzi – woda , wodorotlenek sodu, etanol, woda destylowana.
Sprzęt laboratoryjny:
dwie zlewki – naczynie szklane o kształcie cylindrycznym, stosowane do przeprowadzania prostych reakcji chemicznych;
dwie probówki – podłużne naczynie szklane do przeprowadzania prostych reakcji chemicznych;
pipety Pasteura – wąska rurka do pobierania i przenoszenia niewielkiej ilości cieczy przy pomocy ssawki.
Przebieg doświadczenia:
Przygotowano w dwóch zlewkach -molowy roztwór wodorotlenku sodu oraz -molowy roztwór siarczanu miedzi. Masa molowa hydratu wynosi . Masa molowa jest równa .
Otrzymano wodorotlenek miedzi. W tym celu: przygotowano dwie probówki. Wlano do obu probówek po 5 centymetrów sześciennych -molowego roztworu wodorotlenku sodu. Następnie wlano do obu probówek kilka kropli -molowego roztworu siarczanu miedzi.
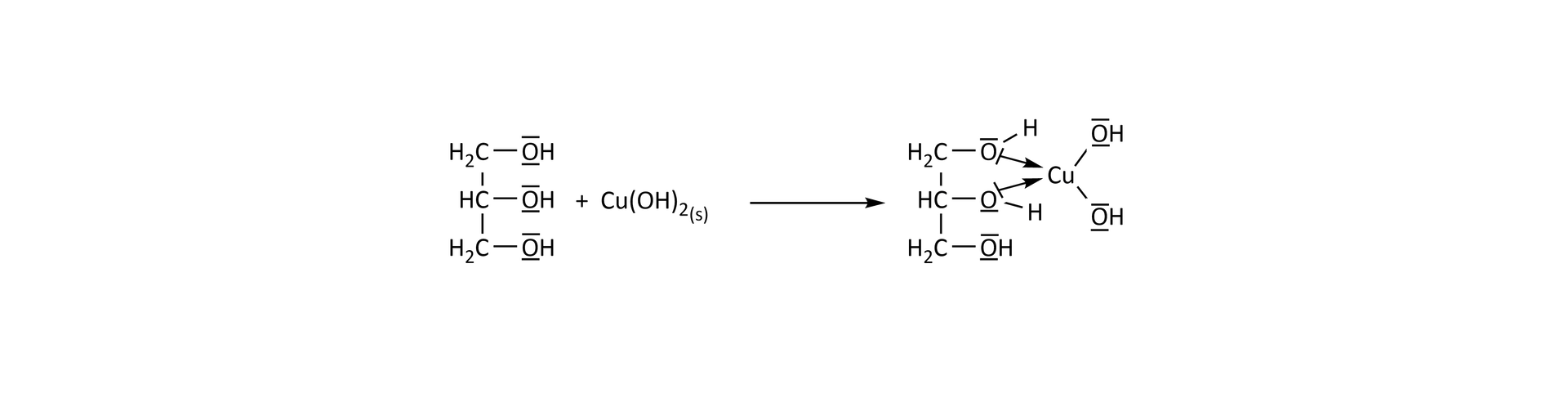
Do otrzymanego osadu w probówce numer 1 wlano 3 centymetry sześcienne propano-,,-triolu i wstrząśnięto.
Do drugiej probówki wlano 3 centymetry sześcienne etanolu i wstrząśnięto probówką.
Obserwacje:
Przygotowany wodorotlenek miedzi wytrącił się w postaci galaretowatego niebieskiego osadu. W probówce z gliceryną następuje zmiana zabarwienia z błękitnego na szafirowy oraz roztworzenie osadu wodorotlenku miedzi. W probówce z etanolem nie zaobserwowano objawów reakcji – wciąż widoczny jest niebieski osad.
Wyniki:
Gliceryna reaguje z wodorotlenkiem miedzi tworząc glicerynian miedzi. Grupy hydroksylowe gliceryny są donorami par elektronowych. Między tymi grupami a atomami miedzi powstają wiązania koordynacyjne. Utworzony kompleks jest łatwo rozpuszczalny w wodzie.
Wnioski:
Jest to reakcja charakterystyczna dla alkoholi polihydroksylowych. Etanol jest alkoholem monohydroksylowym i nie reaguje z wodorotlenkiem miedzi. Za pomocą próby Trommera można odróżnić alkohol monohydroksylowy od polihydroksylowego – hipoteza potwierdziła się.
Zaznacz wzory półstrukturalne alkoholi, które po dodaniu do świeżo strąconego wodorotlenku miedzi spowodują jego roztworzenie, a roztwór przyjmie szafirowe zabarwienie.
Poniższy schemat przedstawia moment doświadczenia, w którym drugi z reagentów nie został jeszcze dodany do probówki. Pod każdą probówką umieść odpowiednie obserwacje po dodaniu drugiego reagenta.