Sprawdź się
Korzystając z tabeli rozpuszczalności, zaznacz, które związki są praktycznie nierozpuszczalne w wodzie.

Przeanalizuj poniższe pary substratów. Ustal, która para jest odpowiednia do zajścia reakcji strąceniowej. Zapisz w zeszycie cząsteczkowe równania reakcji oraz pełne i skrócone równanie jonowe dla reakcji strąceniowej.
Korzystając z tabeli rozpuszczalności, sprawdź, czy jony tworzące produkt powodują wytrącenie się nierozpuszczalnego osadu. Pamiętaj, że jest to reakcja wymiany podwójnej.
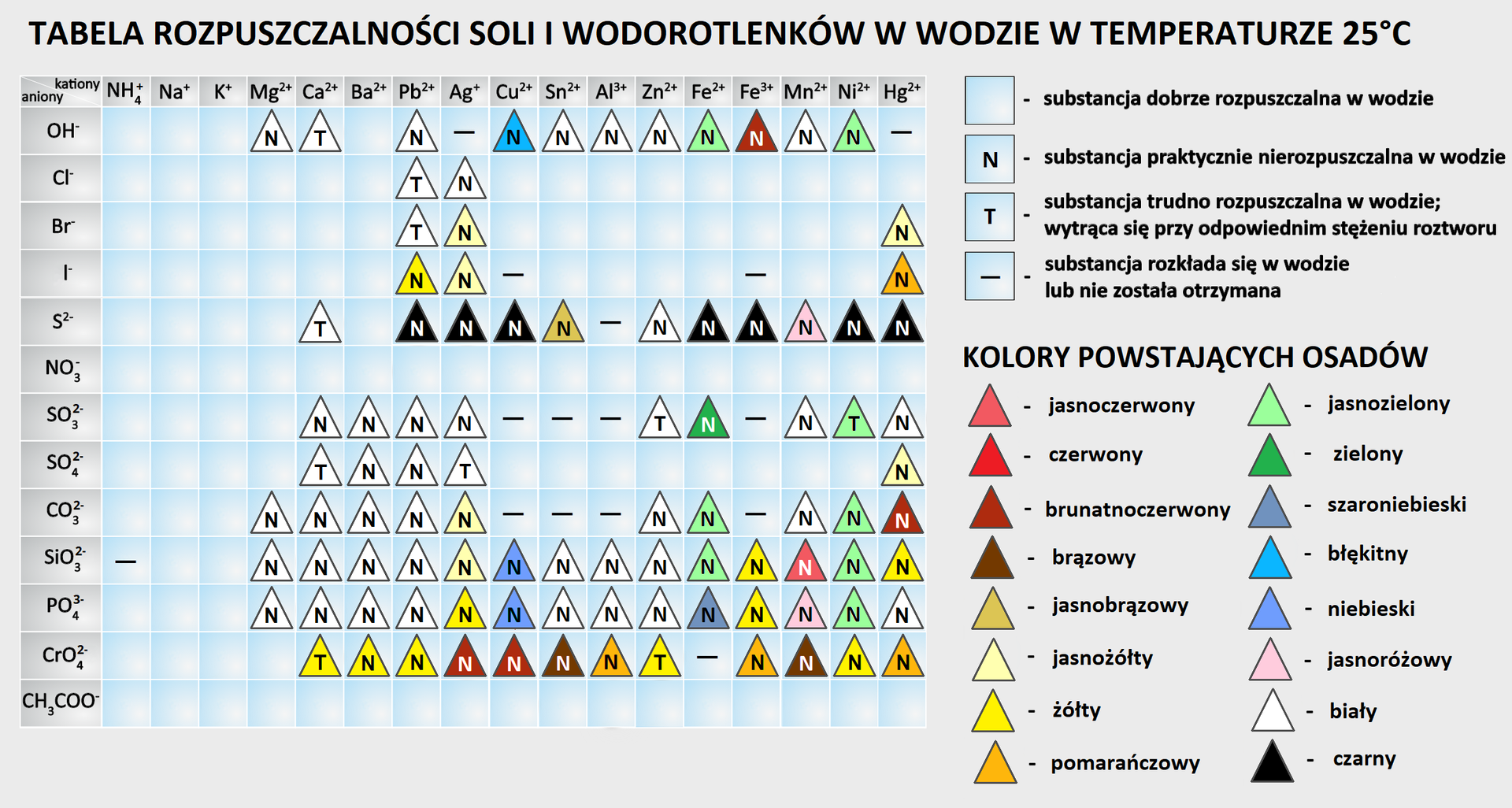
Tylko w wyniku reakcji siarczku baru z chlorkiem żelaza(III) następuje wytrącenie się osadu siarczku żelaza(III).
Pełne równanie cząsteczkowe
Pełne równanie jonowe:
Skrócone równanie jonowe:
Do brązowego roztworu zawierającego chlorek żelaza(III) dodano roztworu chromianu(VI) potasu. Napisz, co możesz zaobserwować. Zapisz równania cząsteczkowe oraz jonowe (pełne i skrócone) zachodzącej reakcji chemicznej.
Skorzystaj z tabeli rozpuszczalności, która pozwoli Ci określić wzory substratów, a także produktów.

Nastąpi wytrącenie się czerwonego osadu chromianu(VI) żelaza(III).
Równanie cząsteczkowe:
Równanie pełne jonowe:
Równanie jonowe skrócone:
Mając do dyspozycji wodny roztwór amoniaku, roztwór chlorku żelaza(III), siarczek żelaza(III) i wodorotlenek niklu, zaproponuj metodę otrzymania wodorotlenku żelaza(III). Co zaobserwujesz w trakcie reakcji? Zapisz równanie cząsteczkowe, jonowe pełne oraz skrócone.
Nie każdy odczynnik jest potrzebny, niektóre są praktycznie nierozpuszczalne w wodzie. Skorzystaj z tabeli rozpuszczalności.

Należy użyć wodnego roztworu amoniaku i chlorku żelaza(III).
Równanie cząsteczkowe:
Równanie jonowe pełne:
Równanie jonowe skrócone:
W wyniku reakcji wytrąci się brunatny osad wodorotlenku żelaza(III).
Uczeń chce strącić chlorek ołowiu(II). Dysponuje roztworem chlorku magnezu o stężeniu oraz azotanem(V) ołowiu(II) w stanie stałym. Jaką naważkę azotanu(V) ołowiu(II) na wody powinien przygotować, aby po zmieszaniu całej objętości powstałego roztworu ze roztworu chlorku magnezu o stężeniu zaszła reakcja strąceniowa? Iloczyn rozpuszczalności dla wytrącającego się związku wynosi .
Skorzystaj z tabeli rozpuszczalności. Dla związku, który ulega strąceniu zapisz wzór na iloczyn rozpuszczalności i wykorzystaj go do obliczenia masy azotanu(V) ołowiu(II).

W reakcji wytrąca się chlorek ołowiu(II):
Aby doszło do wytrącenia się chlorku ołowiu, iloczyn stężeń poszczególnych jonów, podniesionych do potęgi równej ich współczynnikom, musi być większy, co do wartości, od iloczynu rozpuszczalności. A zatem:
Całkowita objętość końcowa roztworu będzie wynosić 200 cmIndeks górny 33 (czyli 0,2 dmIndeks górny 33), zatem możemy wyliczyć końcową wartość stężenia jonów chlorkowych w tym roztworze, która będzie równa:
Teraz możemy obliczyć stężenie jonów ołowiowych(II), jakie musi być osiągnięte w roztworze, aby doszło do wytrącenia się osadu z roztworu:
Z kolei znając minimalne stężenie jonów ołowiowych(II) oraz objętość roztworu, możemy wyznaczyć liczność jonów:
W tym przypadku, liczności jonów ołowiowych(II) odpowiada liczności azotanu(V) ołowiu(II). Można zatem, korzystając z masy molowej azotanu(V) ołowiu(II), obliczyć minimalną masę związku, jaką należy użyć w doświadczeniu, aby doszło do reakcji strąceniowej:
Uczeń powinien odważyć więcej niż 0,45 g azotanu(V) ołowiu(II).
Jedną z metod analitycznych, stosowanych w chemii, jest analiza grawimetryczna. Polega ona na usunięciu z analizowanej próbki oznaczanego jonu w postaci nierozpuszczalnego osadu, następnie jego wysuszeniu i zważeniu. W pewnym laboratorium analizowano stężenie jonów chlorkowych w roztworze, poprzez wytrącenie nierozpuszczalnego osadu chlorku srebra(I). Metoda ta polegała na strąceniu jonów chlorkowych azotanem(V) srebra(I), następnie odsączeniu osadu i wysuszeniu go w temperaturze 120°C. W wyniku analizy otrzymano 3,218 g chlorku srebra. Zapisz równanie reakcji w formie jonowej skróconej oraz oblicz masę jonów chlorkowych w analizowanej próbce. Wynik podaj w gramach z dokładnością do trzech miejsc po przecinku.
Zapisz równanie jonowe. Oblicz masę molową chlorku srebra. Korzystając z proporcji, oblicz, ile gramów jonów chlorkowych znajduje się w badanej próbce.
W analizowanej próbce znajduje się 0,796 g jonów chlorkowych.
Przygotowano dwie probówki – w jednej z nich znajduje się chlorek cynku, a w drugiej azotan(V) srebra(I). Oba roztwory są bezbarwne. Do obu wprowadzono jeden z odczynników: kwas siarkowy(VI), manganian(VII) potasu, chlorek sodu, fosforan(V) sodu. Zaobserwowano, że w probówkach wytrąciły się osady, które różniły się miedzy sobą barwą. Wskaż, który z odczynników wprowadzono do obu probówek oraz zapisz równania reakcji (w formie cząsteczkowej, jonowej pełnej oraz jonowej skróconej), prowadzące do powstania osadów.
Skorzystaj z tablicy rozpuszczalności. Znajdź aniony, które dają osad z jonami cynku i srebra(I), a które różnią się od siebie barwą.
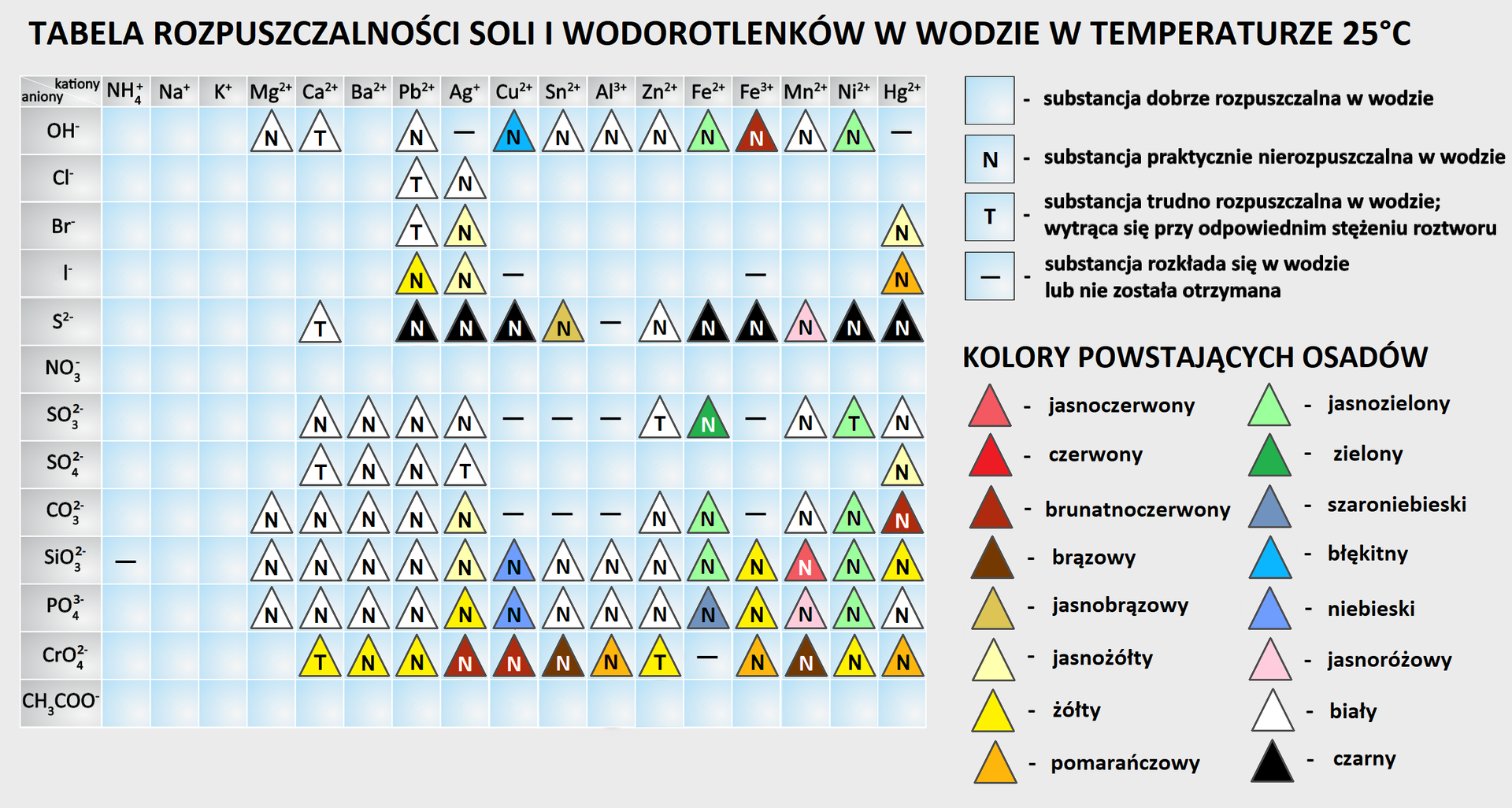
Do probówek wprowadzono fosforan(V) sodu. Wytrącił się biały osad fosforanu(V) cynku oraz żółty osad fosforanu(V) srebra(I).
Równania cząsteczkowe:
Równania pełne jonowe:
Równania jonowe skrócone: