Sprawdź się
Uzupełnij poniższe zdanie, zaznaczając wyrazy tak, aby utworzyły prawidłowe zdanie.
Wskaż, które z poniższych reakcji nie zachodzą.
Dokończ poniższe równania reakcji kwasów z solami.
luka do uzupełnienia luka do uzupełnienia
luka do uzupełnienia luka do uzupełnienia
Zapisz w zeszycie w formie jonowej skróconej poniższe równania reakcji. Jeżeli uznałeś, że dana reakcja nie zachodzi, pozostaw puste miejsce.
Zapisz w formie jonowej skróconej poniższe równania reakcji. Jeżeli uznałeś, że dana reakcja nie zachodzi, pozostaw puste miejsce.
a)
b)
c)
d)
e)
Przygotowano zestaw doświadczalny, zgodnie z poniższymi schematycznym rysunkiem.
Przygotowano zestaw doświadczalny, zapoznaj się z jego opisem.
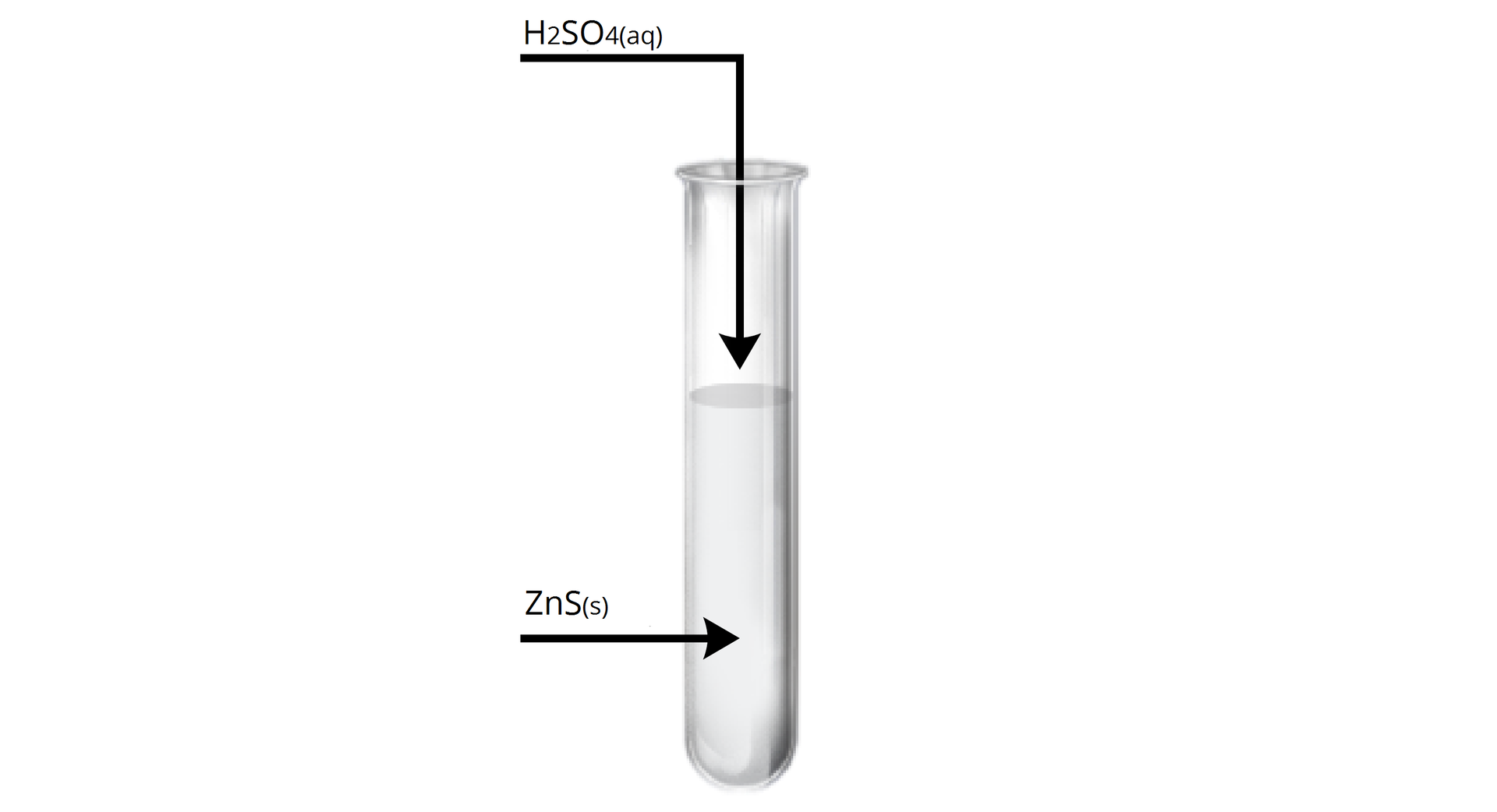
Oceń, czy można za pomocą tego doświadczenia wykazać, że kwas siarkowodorowy jest kwasem słabszym od kwasu siarkowego(). Odpowiedź uzasadnij. Zapisz w formie jonowej skróconej równanie reakcji zachodzącej w doświadczeniu. Zapisz obserwacje towarzyszące temu doświadczeniu chemicznemu, a następnie wyciągnij wniosek.
Zaprojektuj doświadczenie chemiczne, w którym wykażesz, że kwas octowy (etanowy) jest słabszym kwasem od kwasu chlorowodorowego. W tym celu uzupełnij brakujące informacje.