Sprawdź się
Przeprowadzono doświadczenie, schematycznie przedstawione na poniższym rysunku.
Przeprowadzono doświadczenie. Zapoznaj się z jego opisem.
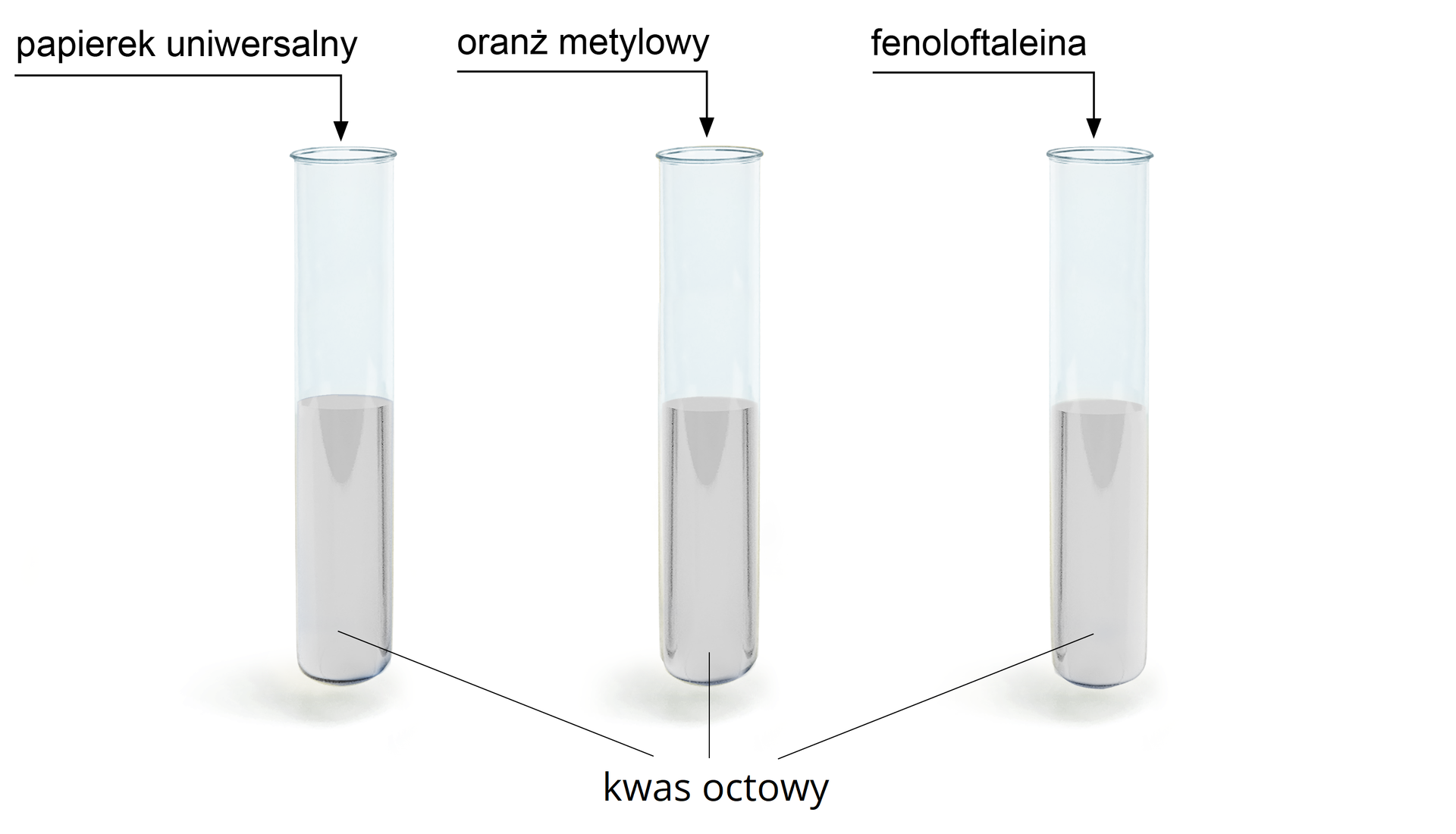
A. Uzupełnij poniższe zdania, wpisując obserwacje po przeprowadzeniu doświadczenia.
Barwa roztworu po dodaniu kilku kropli oranżu metylowego do probówki 2: Tu uzupełnij.
Barwa roztworu po dodaniu kilku kropli fenoloftaleiny do probówki 3: Tu uzupełnij.
B. Uzupełnij wniosek z przeprowadzonego doświadczenia.
W roztworze kwasu p‑chlorobenzoesowego stężenie jonów , pochodzących z jego dysocjacji elektrolitycznej, wynosi 0,001 , natomiast stężenie niezdysocjowanych cząsteczek kwasu osiąga wartość 0,01 . Oblicz wartość stałej dysocjacji kwasowej opisanego kwasu. Zapisz odpowiedź.
Monokarboksylowe kwasy alkanowe należą do słabych elektrolitów, z których najmocniejszy jest kwas mrówkowy. Ich moc można zwiększyć poprzez przyłączenie do cząsteczki kwasu atomu (lub atomów) fluorowca. Efekt zwiększenia mocy kwasu jest tym większy, im:
więcej atomów fluorowca znajduje się w cząsteczce kwasu;
mniejsza odległość dzieli atom fluorowca od grupy karboksylowej;
bardziej elektroujemny jest atom fluorowca.
Korzystając z powyższych informacji, przyporządkuj kwasom karboksylowym odpowiednie wartości stałych dysocjacji kwasowej .
W poniższej tabeli podano wartości stałej dysocjacji czterech kwasów karboksylowych w temperaturze 25℃.
Nazwa kwasu | |
|---|---|
Kwas octowy (etanowy ) | 1,8 · 10Indeks górny -5-5 |
Kwas chlorooctowy (chloroetanowy) | 1,4 · 10Indeks górny -3-3 |
Kwas benzoesowy (benzenokarboksylowy) | 6,3 · 10Indeks górny -5-5 |
Kwas 3‑chlorobenzoesowym (3‑chlorobenzenokarboksylowy) | 1,5 · 10Indeks górny -4-4 |
Indeks górny Źródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.; J .Sawicka, A. Janich‑Kilian, W. Cejner‑Maria, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001. Indeks górny koniecŹródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.; J .Sawicka, A. Janich‑Kilian, W. Cejner‑Maria, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
W czterech probówkach znajdują się wodne roztwory wymienionych kwasów karboksylowych, które zapomniano podpisać. W celu identyfikacji substancji probówki, oznaczono symbolami: HX, HY, HZ, HW. Za pomocą pH‑metru zmierzono, że najwyższą wartość pH posiada ciecz w probówce HW. Pomiędzy pozostałymi substancjami przeprowadzono następujące reakcje:
A. Na podstawie powyższych informacji, dokonaj identyfikacji zawartości probówek, podając nazwy systematyczne znajdujących się w nich kwasów karboksylowych: HW, HX, HY, HZ.
B. Napisz, jaki wpływ na moc kwasu chloroetanowego miałoby wprowadzenie kolejnego podstawnika .
Moc kwasu charakteryzowana jest za pomocą stałej dysocjacji kwasowej lub w oparciu o wartość ().
Wzór kwasu | p |
|---|---|
2,59 | |
3,12 | |
4,19 | |
4,76 | |
4,87 |
Indeks górny Źródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.; J .Sawicka, A. Janich‑Kilian, W. Cejner‑Maria, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001. Indeks górny koniecŹródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.; J .Sawicka, A. Janich‑Kilian, W. Cejner‑Maria, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
Ocet spirytusowy to 10% roztwór kwasu octowego o gęstości 0,950 . Pani Kasia używa jego rozcieńczonej postaci jako środek odkamieniający. Przygotowała roztwór poprzez zmieszanie 100 octu spirytusowego ze 150 wody (d = 1 ). Uzyskany roztwór do prac porządkowych w domu posiadał gęstość 0,980 . Stała dysocjacji kwasowej kwasu octowego wynosi .
A. Oblicz stężenie procentowe otrzymanego roztworu kwasu octowego.
B. Przelicz obliczone stężenie procentowe na stężenie molowe.
C. Oblicz pH otrzymanego roztworu.