Sprawdź się
Dopasuj typ reakcji do odpowiedniego równania reakcji.
Uzupełnij poniższe schematy równań reakcji.
Na podstawie równania odpowiedniej reakcji chemicznej udowodnij zasadowy odczyn roztworu amoniaku. Nazwij powstałe jony.
Amoniak jest słabą zasadą, natomiast jon amonu jest słabym kwasem Brønsteda. Na podstawie reakcji z siarczanem(VI) amonu () wybierz z poniższych związków wszystkie te, które będą potwierdzać właściwości kwasowe jonów amonu.
Mając do dyspozycji: kwas azotowy(V), kwas siarkowy(VI), amoniak, hydrazynę, zaproponuj reakcję chemiczną, w której otrzymasz saletrę amonową. Zapisz równanie tej reakcji oraz określ jej typ.
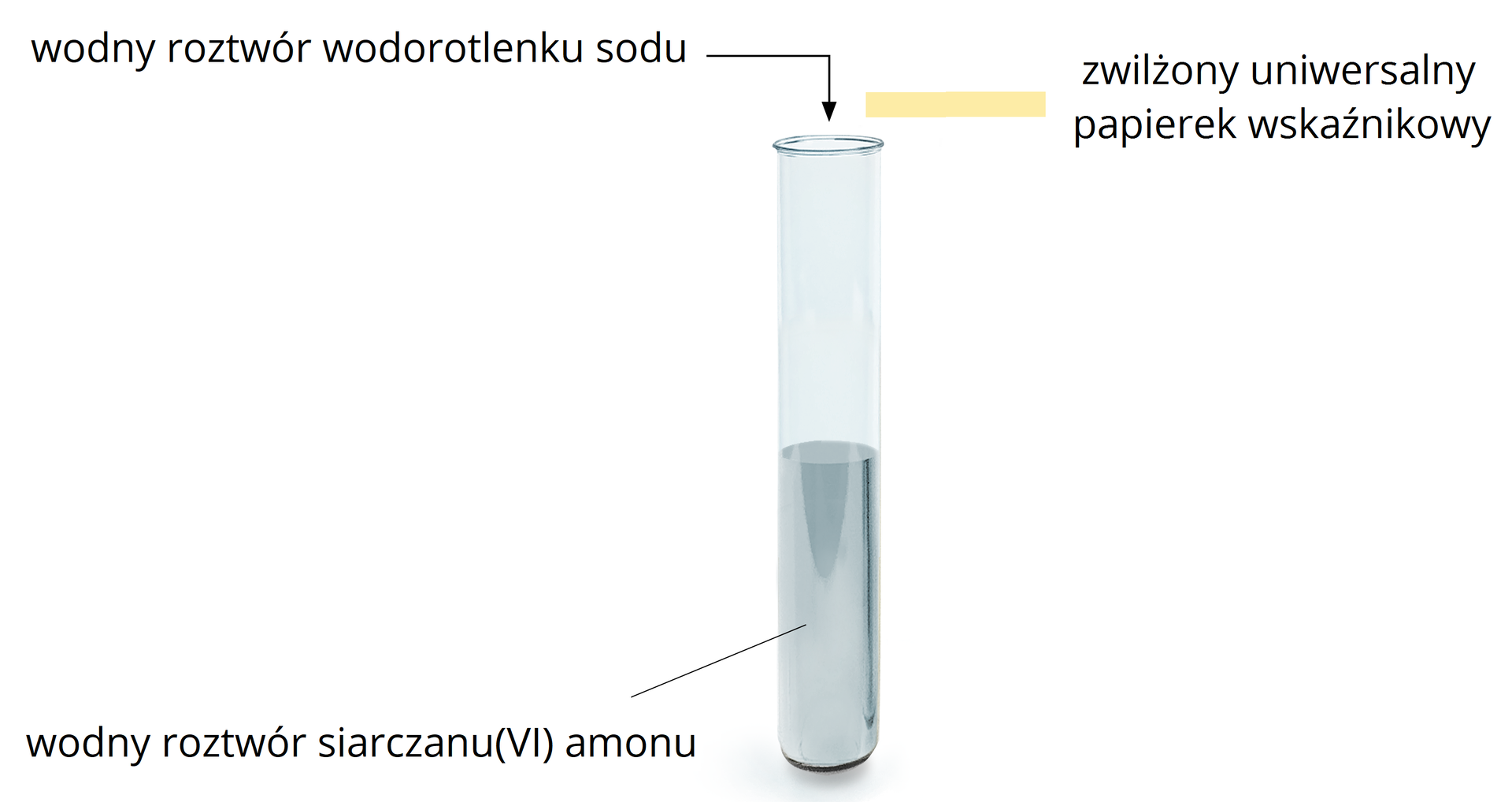
Zaproponuj doświadczenie chemiczne, w którym udowodnisz, że pod wpływem odpowiedniego związku chemicznego, z siarczanu(VI) amonu wydziela się amoniak. Przedstaw schemat doświadczenia, zapisz odpowiednie równania reakcji chemicznych oraz obserwacje.
Odczynniki:
woda destylowana, wodny roztwór siarczanu (VI) amonu; uniwersalny papierek wskaźnikowy; roztwór kwasu siarkowego (VI); wodny roztwór wodorotlenku sodu.
Podstawienie jednego atomu wodoru atomem metalu w cząsteczce amoniaku powoduje powstanie amidków o wzorze ogólnym , gdzie to symbol metalu bloku s. W przypadku postawienia dwóch atomów wodoru atomami metalu otrzymujemy imidki, a podstawienie trzech atomów wodoru powoduje powstanie azotków.
Uzupełnij poniższe równania reakcji (wiedząc, że w reakcji z metalicznym litem podstawieniu ulega jeden atom wodoru, a w reakcji z metalicznym magnezem trzy atomy wodoru). Zakwalifikuj główny produkt reakcji do amidków, imidków lub azotków.