Sprawdź się
Dopasuj definicje do pojęć.
masa atomowa pierwiastka, która jest obliczona z mas wszystkich izotopów danego pierwiastka, z uwzględnieniem obfitości ich występowania, jednostka liczności (ilości) materii, podstawowa w układzie SI, masa 1 mola substancji, liczona jako stosunek masy substancji do liczby moli substancji zawartych w tej masie
| mol | |
| masa molowa | |
| średnia masa atomowa |
Wybierz prawidłowe stwierdzenie.
- 0,2 mola to 3 g substancji.
- W 8 g tlenku siarki(VI) jest tyle atomów tlenu, ile atomów azotu zawiera 0,1 mola amoniaku.
- Masa molowa wynosi 63 .
Oblicz masy molowe podanych związków:
A.
B. .
Oblicz, jaką liczbę moli stanowi związku o wzorze . Masa molowa wynosi .
Oblicz, ile gramów potasu znajduje się w tlenku potasu?
Masa molowa wynosi .
Wskaż poprawne zdania.
- Masa jednego mola cząsteczek substancji jest równa liczbowo jej masie cząsteczkowej.
- Masa molowa, to masa w gramach jednego mola substancji.
- Jednostką masy molowej jest .
- Symbolem masy molowej jest N.
Sprawdź masę molową wybranego pierwiastka lub związku chemicznego.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DFJvyHR1p
Wstaw odpowiednie wartości do tabeli. Kilka odpowiedzi zostało podanych dodatkowo.
, , , 2, 1,1, , , 0,87, 101,74
| Substancja |
Masa molowa [] |
Masa [g] | Liczba moli [mol] | Liczba cząsteczek/jednostek formalnych* |
|---|---|---|---|---|
| 2 | ||||
| 1,1 | ||||
Masa molowa związku o wzorze wynosi . Wykonując odpowiednie obliczenia, podaj symbol i nazwę pierwiastka .
Studenci na zajęciach laboratoryjnych przeprowadzili doświadczenie, którego przebieg zilustrowano poniżej.
Studenci na zajęciach laboratoryjnych przeprowadzili doświadczenie. Zapoznaj się z jego opisem.
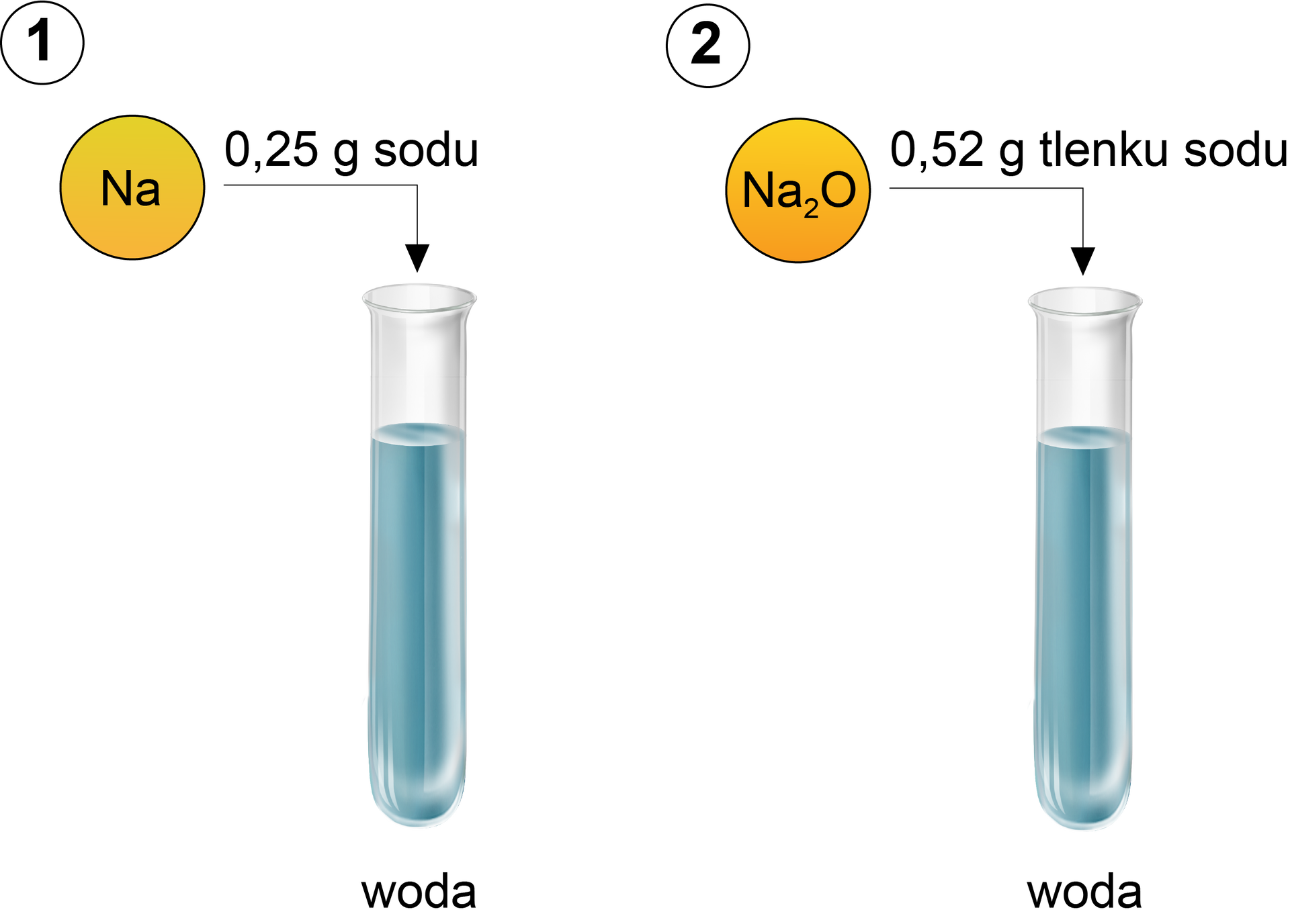
Następnie studenci odparowali otrzymane roztwory.
Napisz i uzgodnij równania reakcji chemicznych przedstawionych eksperymentów oraz oblicz, w której probówce powstało więcej gramów produktu (poza produktami gazowymi).
W przyrodzie występuje kilka minerałów tytanu. Najważniejsze z nich to ilmenit () i rutyl (). Czysty metal otrzymuje się z rutylu podczas ogrzewania z węglem i chlorem, w wyniku czego powstaje chlorek tytanu() i tlenek węgla(). W drugim etapie chlorek tytanu() ogrzewa się w odpowiednich warunkach z magnezem. Czysty tytan lub jego stop, o składzie masowym: , , , stosowany jest np. do wytwarzania implantów.
Na podstawie opisu napisz i uzgodnij równania reakcji przebiegających podczas otrzymywania czystego tytanu oraz oblicz, ile moli tytanu i ile moli glinu zawiera tzw. gwóźdź ortopedyczny o masie , wykonany ze stopu tytanu o podanym wyżej składzie.
Indeks górny zadanie na podstawie: Arkusze egzaminacyjne, Chemia, Wydawnictwo Szkolne OMEGA, Kraków 2008 Indeks górny konieczadanie na podstawie: Arkusze egzaminacyjne, Chemia, Wydawnictwo Szkolne OMEGA, Kraków 2008