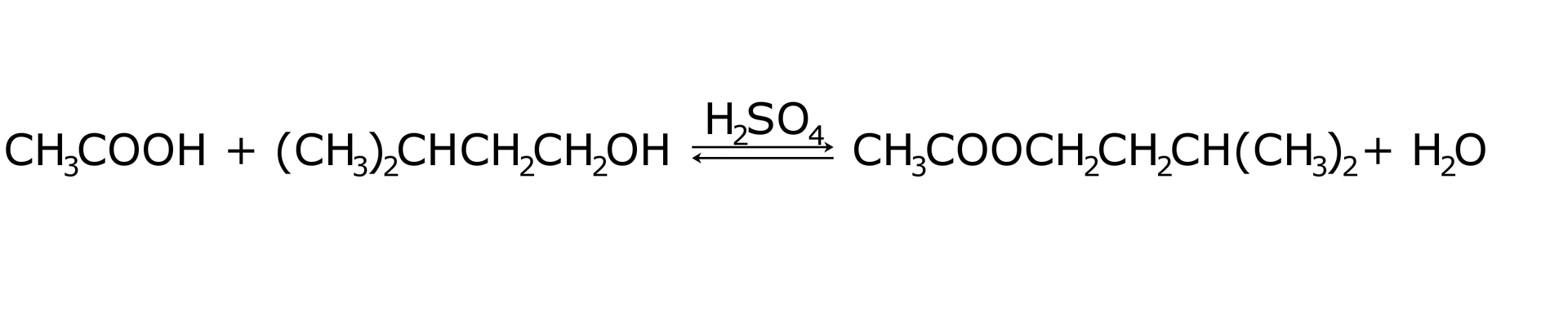Sprawdź się
Zaznacz poprawną odpowiedź.
Równowaga chemiczna zachodzi gdy:
- Prędkość estryfikacji jest równa prędkości hydrolizy estrów.
- Prędkość estryfikacji jest większa niż prędkość hydrolizy estrów.
- Prędkość estryfikacji jest mniejsza niż prędkość hydrolizy estrów.
Uzupełnij ogólne równanie reakcji chemicznej, które przedstawi zależność pomiędzy estryfikacją a hydrolizą.
woda, kwas karboksylowy, ester, alkohol
..................................+....................................................................+..................................
Synteza octanu izoamylu (octan -metylo--butylu) jest przykładem klasycznej reakcji estryfikacji typu kwas karboksylowy plus alkohol. Tego związku używa się jako rozpuszczalnika dla wielu substancji organicznych oraz w perfumerii. Zapisz równanie estryfikacji, pamiętając o zastosowaniu związku chemicznego przyspieszającego osiągnięcie stanu równowagi.
Synteza octanu izoamylu jest przykładem klasycznej reakcji estryfikacji typu kwas karboksylowy plus alkohol. Tego związku używa się jako rozpuszczalnika dla wielu substancji organicznych oraz w perfumerii. Wybierz substraty reakcji estryfikacji, w której powstaje jedna cząsteczka octanu izoamylu i jedna cząsteczka wody.
- Jedna cząsteczka kwasu octowego dodać jedna cząsteczka alkoholu izoamylowego
- Jedna cząsteczka kwasu octowego dodać dwie cząsteczki alkoholu izoamylowego
- Dwie cząsteczki kwasu octowego dodać jedna cząsteczka alkoholu izoamylowego
Wybierz, jaki związek chemiczny przyspiesza osiągnięcie stanu równowagi w reakcji otrzymywania octanu izoamylu.
- chlorowodór
- kwas siarkowy
- wodorotlenek miedzi
Z podanych elementów skonstruuj zestaw, który pozwoli zwiększyć skuteczność estryfikacji poprzez odprowadzanie jednego z produktów.
Zastanów się i wybierz, z jakich elementów należałoby skonstruować zestaw, który pozwoliłby zwiększyć skuteczność estryfikacji poprzez odprowadzanie jednego z produktów.
- Zestaw składający się z dwóch kolb, termometru, kosza grzejnego, podnośnika, łącznika destylacyjnego i nasadki destylacyjnej
- Zestaw składający się z dwóch kolb, czterech probówek, reaktora, podnośnika
- Zestaw składający się z szalki Petriego, termometru, kosza grzejnego, szkiełka zegarkowego
- Zestaw składający się z termometru, kosza grzejnego, podnośnika, łącznika destylacyjnego i nasadki destylacyjnej
Reakcja odwracalna została przedstawiona równaniem:
Substraty i produkty reakcji w stanie równowagi były odpowiednio:
Oblicz:
stałą równowagi;
stężenia wyjściowe substancji A i B.
równowagi chemicznej, reguły przekory, stałej równowagi, równowagi chemicznej, stałej równowagi
Wzrost temperatury przesuwa położenie ........................................... Zgodnie z brzmieniem .........................................., następuje równoczesna zmiana wartości .......................................... Kc. W przypadku zmiany stężenia, następuje zmiana .......................................... przy zachowaniu tej samej wartości .......................................... Kc.
Mieszanina równowagowa () została otrzymana w wyniku reakcji mola kwasu i mola alkoholu. Przykłady zawartości estru wynoszą odpowiednio:
alkohol | kwas | zawartość estru | |
|---|---|---|---|
metylowy | octowy | ||
etylowy | octowy | ||
allilowy | octowy | ||
izobutylowy (‑metylopropylowy) | mrówkowy | ||
izobutylowy (‑metylopropylowy) | piwalowy | ||
izobutylowy (‑metylopropylowy) | ‑toluilowy |
W oparciu o powyższą tabelę oraz zdobytą wiedzę podaj trzy przykłady działań praktycznych, zwiększających ilość uzyskanego estru.
Jeżeli w zamkniętym reaktorze, o stałej objętości, zostanie przeprowadzona reakcja chemiczna, w której bierze udział po jednym molu substratów A oraz B, to po pewnym czasie ustali się stan równowagi chemicznej:
Wówczas liczbę moli reagentów na różnych etapach reakcji można obliczyć, korzystając z zależności zamieszczonych w tabeli poniżej.
reagent | liczba moli początkowych | liczba moli zużytych w reakcji | liczba moli w stanie równowagi |
|---|---|---|---|
A | |||
B | |||
C | |||
D |
Prowadzono estryfikację w zamkniętym pojemniku o objętości . Użyto mole oraz mole . Oblicz masę powstałego estru, jeżeli stała równowagi reakcji wynosiła . Podaj jego nazwę.
Równanie reakcji:
Reakcja estryfikacji zaszła zgodnie z równaniem:
Wiadomo, że w reakcji użyto kwasu octowego i etanolu. Po osiągnięciu stanu równowagi otrzymano octanu etylu. Oblicz stałą równowagi tej estryfikacji.