Sprawdź się
Statua Wolności, będąca symbolem wolnej Ameryki, jest wykonana z miedzi. Napisz jakie czynniki mogą wpływać na proces pasywacji wspomnianego pomnika.
Cynk reaguje ze stężonym kwasem chlorowodorowym (). Podczas reakcji probówka nagrzewa się i wydziela się bezbarwny, nierozpuszczalny w wodzie gaz. Schemat doświadczenia przedstawia poniższa ilustracja.
Cynk reaguje ze stężonym kwasem chlorowodorowym. Podczas reakcji probówka nagrzewa się i wydziela się bezbarwny, nierozpuszczalny w wodzie gaz. Zapoznaj się z opisem schematu doświadczenia.

Oblicz, ile gram cynku znajdowało się w probówce, skoro ilość zebranego gazu w przeliczeniu na warunki normalne oceniono na 0,0224 . Wynik podaj z dokładnością do trzeciego miejsca po przecinku. Załóż, że w doświadczeniu użyto nadmiaru kwasu chlorowodorowego.
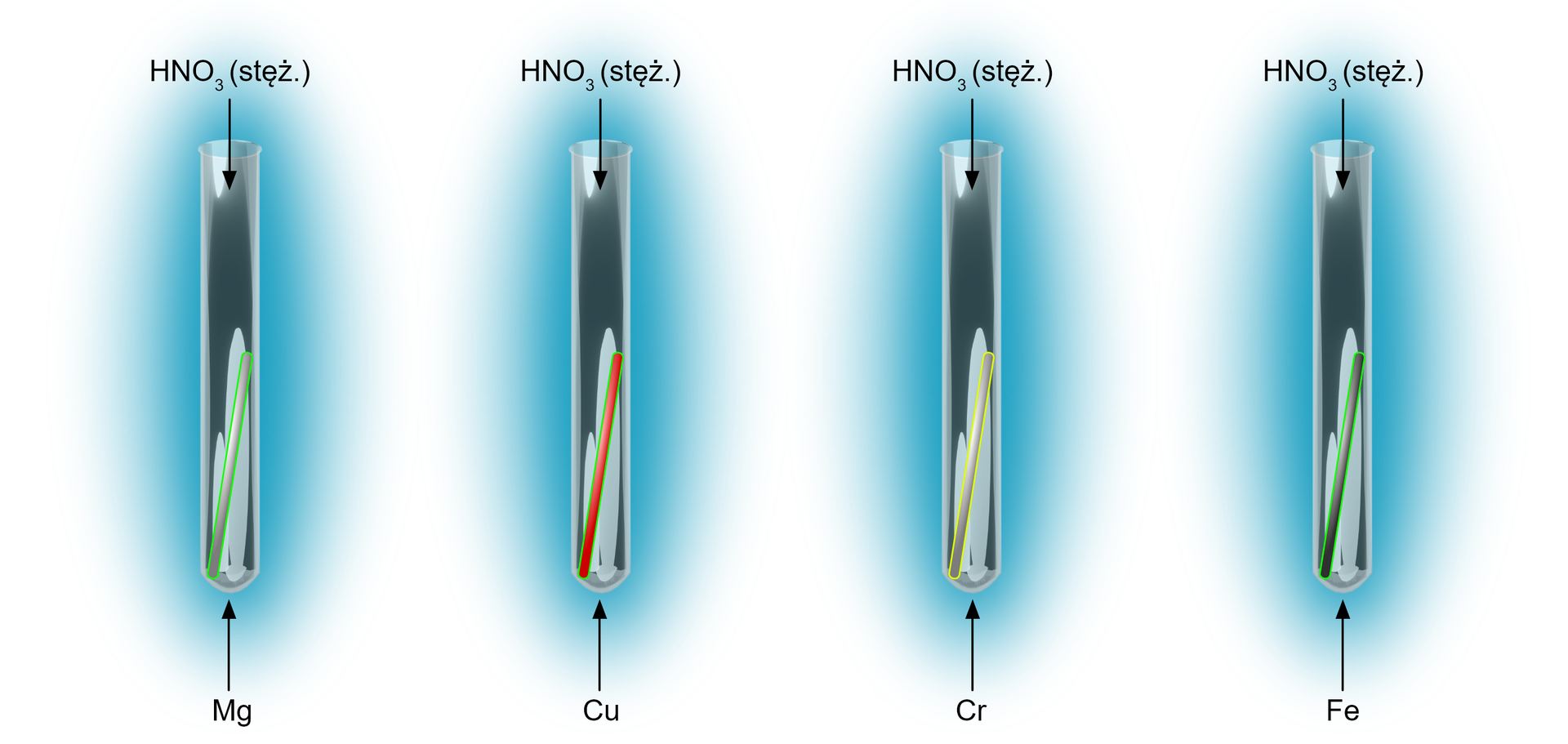
Przeprowadzono doświadczenie, w którym sprawdzano zachowanie się metali (, , , ) w stężonym kwasie azotowym() . Zapisz równania reakcji zachodzące w probówkach (1‑4) i oceń, gdzie zachodzi proces pasywacji.
Zaprojektuj doświadczenie, w którym wykażesz, że glin ulega pasywacji w temperaturze pokojowej.
Metal został wstępnie oczyszczony przez wytrawienie w kwasie chlorowodorowym. Możliwe odpowiedzi: 1. woda destylowana, glin, 2. rozcieńczony kwas azotowy(V), cynk, 3. rozcieńczony kwas azotowy(V), glin, 4. stężony kwas azotowy(V), glin
3. Zapisz obserwacje i wnioski.