Sprawdź się
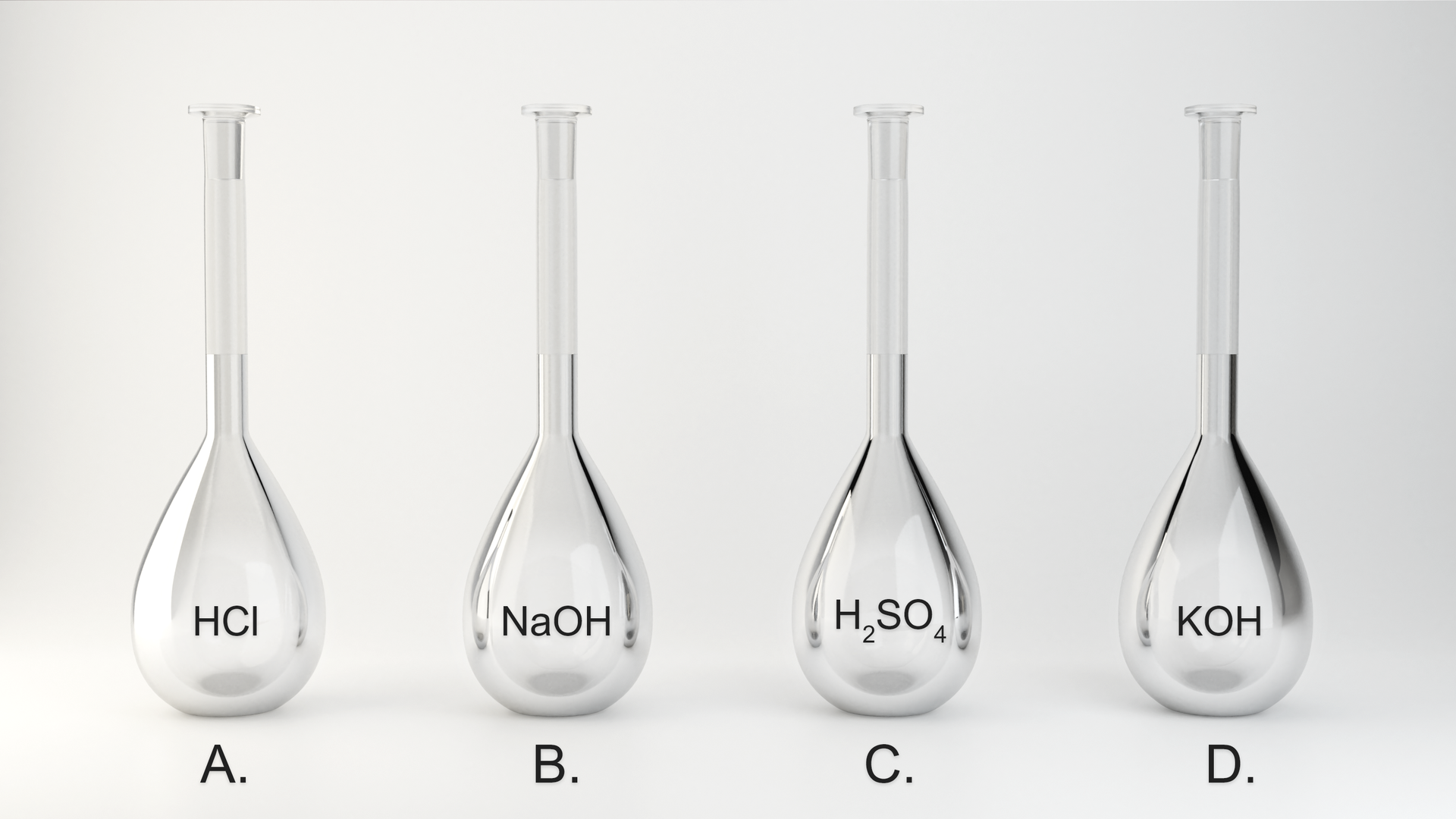
W czterech kolbach o pojemności 1000 znajduje się 0,01 mola różnych substancji. Wykonaj obliczenia i zaznacz kolbę, w której jest najniższe, odpowiedź uzasadnij.
Do 100 0,2 molowego roztworu wodorotlenku potasu dodano 900 wody. Wykonaj obliczenia i oceń zmianę roztworu.
Uczeń miał za zadanie obliczyć roztworu , przygotowanego zgodnie z procedurą przedstawioną poniżej.
Instrukcja:
1. Sporządzanie roztworu: Do kolby miarowej o pojemności 250 wlać porcję wody destylowanej, dodać 5 stężonego kwasu solnego i ostrożnie dopełnić do kreski wodą.
2. Obliczenia: do obliczeń przyjmij następujące masy molowe MIndeks dolny ClCl = 35,5 , MIndeks dolny HH = 1 , gęstość roztworu kwasu solnego 1,16 , a stężenie procentowe stężonego roztworu wynosi 36%.
Uczeń w punkcie nr 2 przedstawił następujące obliczenia:
Oceń poprawność wykonania zadania. Odpowiedź uzasadnij.
Wykonano doświadczenie, przedstawione na poniższym rysunku.
Wykonano doświadczenie. Zapoznaj się z jego opisem.
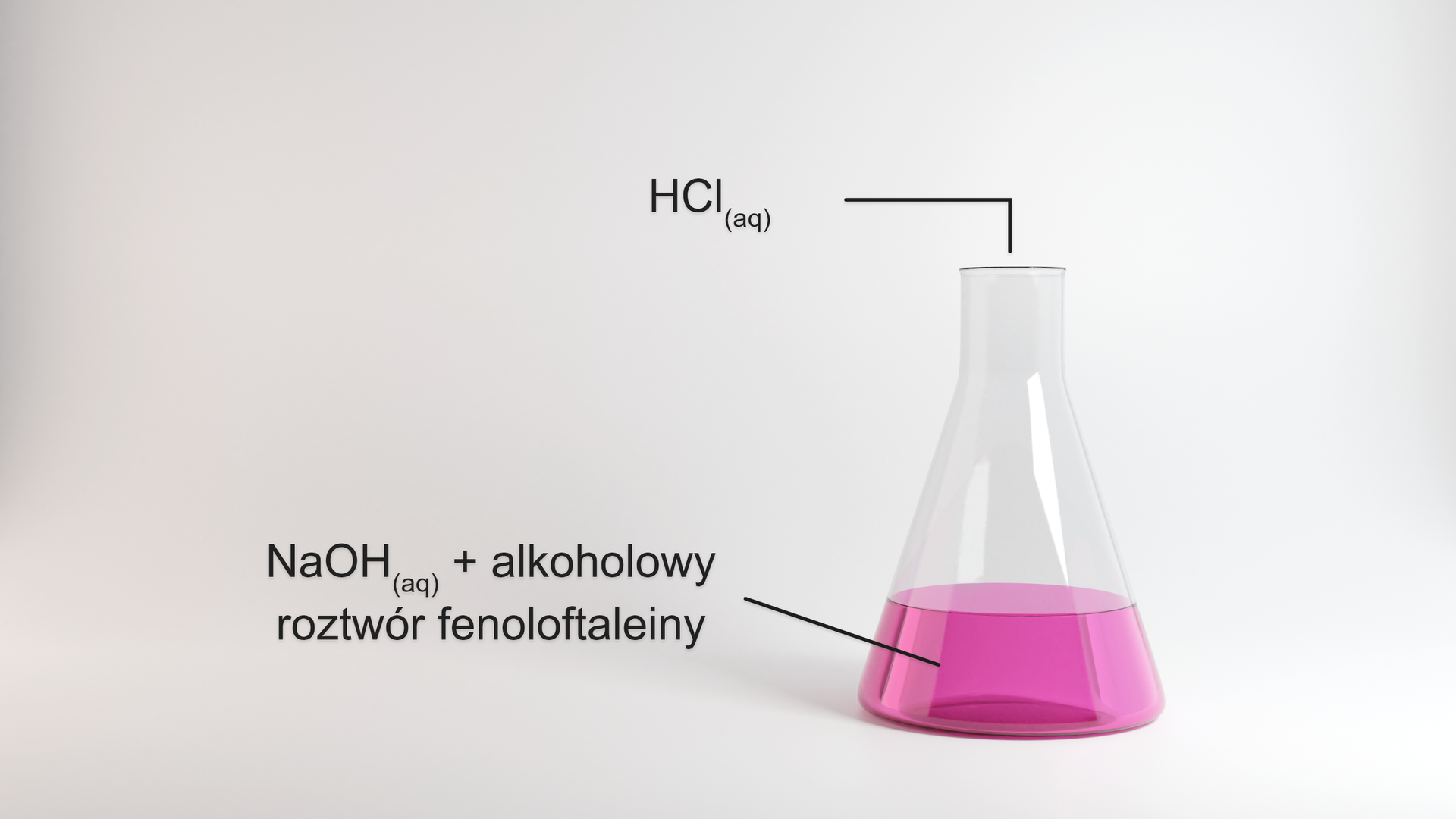
W kolbie zaszła reakcja opisana równaniem:
W doświadczeniu zmieszano 100 roztworu o stężeniu 0,1 oraz 100 roztworu o stężeniu 0,2 . Po dodaniu kwasu do roztworu wodorotlenku sodu z dodatkiem fenoloftaleiny, zauważono, że malinowa barwa w roztworze zanika. Na podstawie obserwacji postawiono następującą hipotezę:
Zanik malinowej barwy w roztworze wskazuje na to, że kwas chlorowodorowy przereagował z wodorotlenkiem sodu i roztwór w kolbie uzyskał odczyn obojętny.
Zweryfikuj tę hipotezę, wykonując odpowiednie obliczenia. Podaj sprzęt i odczynniki, jakich użyto w doświadczeniu. Uzasadnij swoją opinię, formułując odpowiedni wniosek.
W laboratorium wykonano eksperyment przedstawiony na poniższym rysunku. Następnie sprawdzono -metrem roztworu. Przyrząd wskazał wartość 7,5.
W laboratorium wykonano eksperyment. Zapoznaj się z opisem rysunku. Następnie sprawdzono -metrem roztworu. Przyrząd wskazał wartość 7,5.
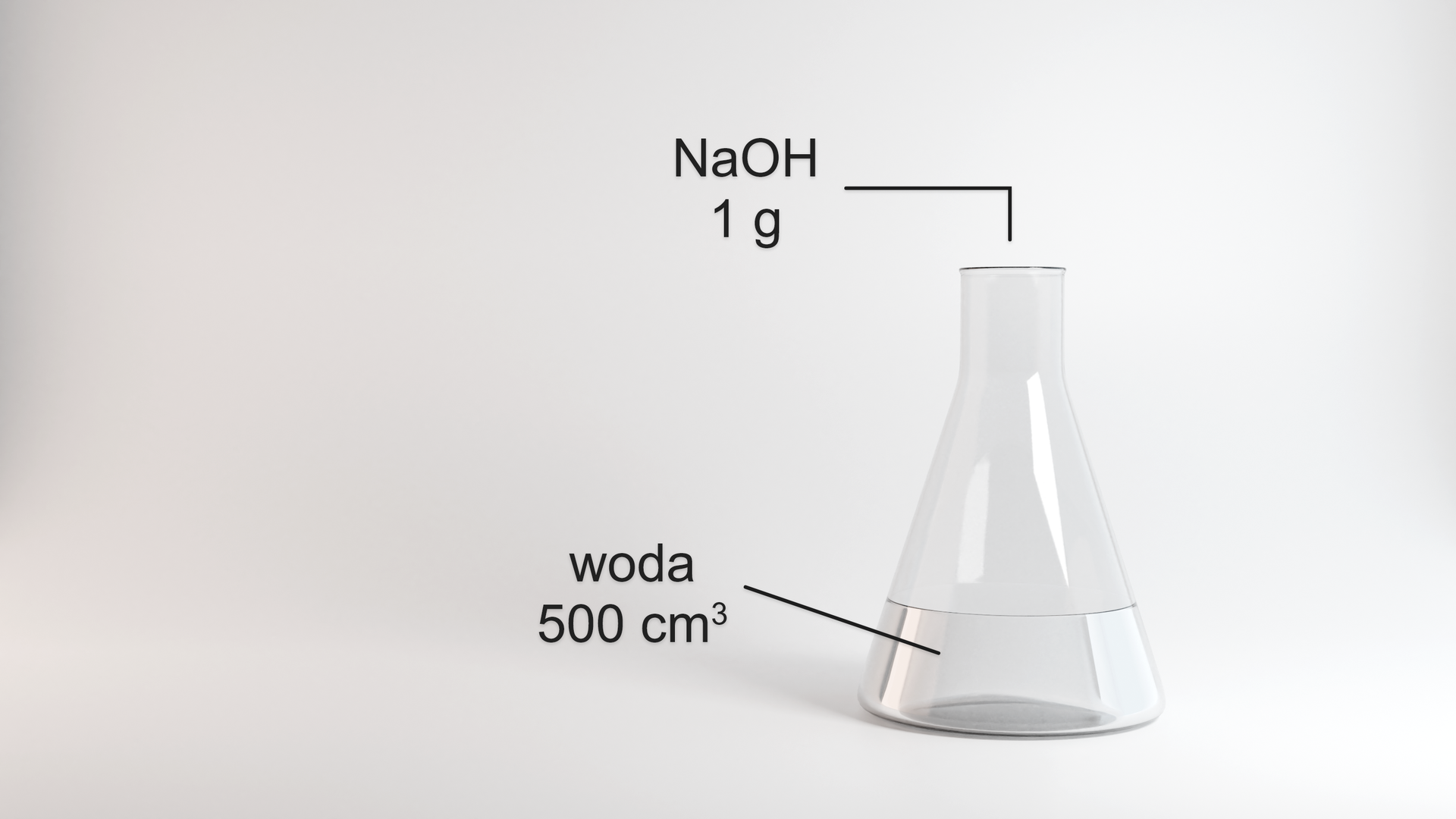
Przedstaw problem badawczy i zaproponuj hipotezę. Na podstawie wykonanych obliczeń zweryfikuj postawioną hipotezę i sformułuj wnioski.