Sprawdź się
Wpisz wzory odpowiednich jonów w luki w poniższym tekście.
, ,
Przyczyną kwasowego odczynu roztworów wodnych substancji chemicznych jest to, że stężnie jonów ............, które powstają w reakcji, jest większe od stężenia jonów .............
Natomiast za odczyn zasadowy roztworów wodnych substancji chemicznych odpowiada przeważające stężenie jonów .............
Oceń prawdziwość poniższych zdań.
| Zdanie | Prawda | Fałsz |
| Wodny roztwór octanu sodu ma odczyn obojętny. | □ | □ |
| Wodny roztwór kwasu fluorowodorowego ma odczyn kwasowy, ponieważ w reakcji z wodą powstają jony oksoniowe. | □ | □ |
| Wodny roztwór wodorotlenku sodu ma odczyn zasadowy, ponieważ w reakcji z wodą powstają jony wodoronadtlenkowe. | □ | □ |
| W reakcji amoniaku z wodą powstają kationy amonu. | □ | □ |
| Wodny roztwór bromku amonu ma odczyn kwasowy. | □ | □ |
Zbadano odczyn roztworów niżej podanych soli przy pomocy papierka uniwersalnego. Który lub które roztwory wykazują pH>7? Wybierz prawidłową odpowiedź.
Dokończ poniższe równania tak, aby cząsteczki wody pełniły funkcję zasady.
A.
B.
C.
D.
Dla poniższych indywiduów chemicznych zapisz sprzężoną zasadę lub kwas wg teorii Brønsteda-Lowry’ego.
A.
B.
C.
D.
Wodny roztwór wodoroortofosforanu(V) sodu barwi uniwersalny papierek wskaźnikowy na niebiesko, natomiast wodny roztwór diwodoroortofosforanu(V) sodu na czerwono. Dla obu soli zapisz po jednym równaniu reakcji chemicznej (w formie jonowej skróconej), która jest odpowiedzialna za odczyn wodnego roztworu soli.
A.
B.
Uzupełnij poniższe równaniea reakcji chemicznej tak, aby jon pełnił rolę kwasu wg teorii kwasów i zasad Brønsteda‑Lowry’ego.
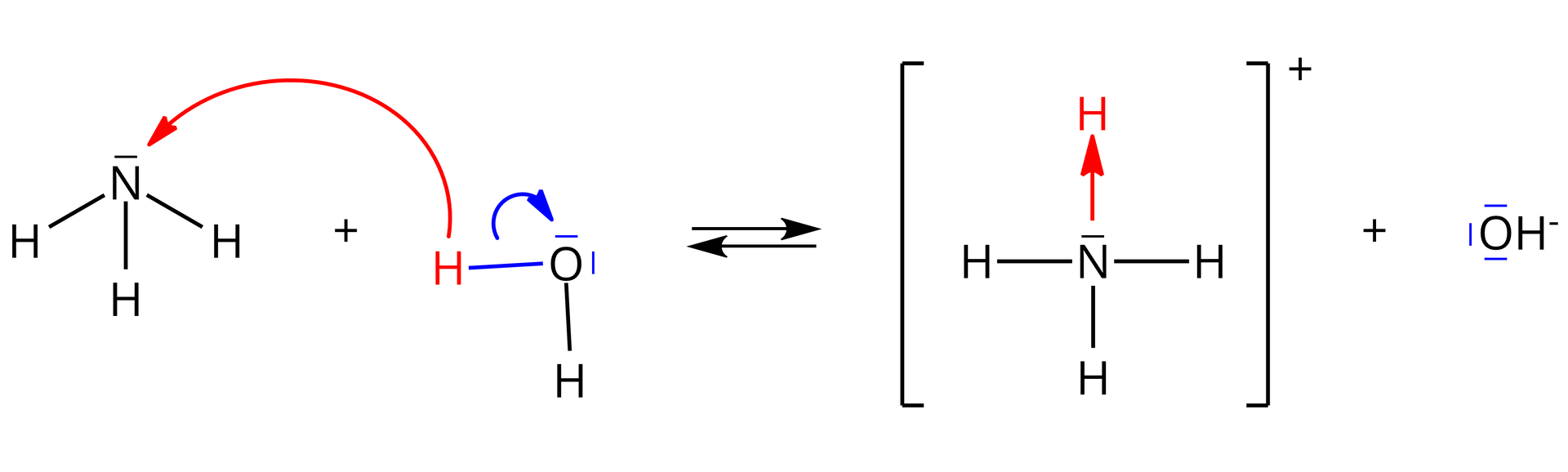
Amoniak wg teorii Brønsteda-Lowry’ego wobec wody jest zasadą, ponieważ przyjmuje jon wodoru zgodnie z reakcją:
Odwołując się do budowy amoniaku, wyjaśnij, dlaczego może on przyjąć jon wodoru.